江苏省栟茶高级中学2010届高三化学预教学案
文档属性
| 名称 | 江苏省栟茶高级中学2010届高三化学预教学案 |  | |
| 格式 | rar | ||
| 文件大小 | 91.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2009-12-15 18:45:00 | ||
图片预览




文档简介
本资料来自于资源最齐全的21世纪教育网www.21cnjy.com
江苏省栟茶高级中学2010届高三化学预教学案
硫及其化合物 季本峰2009-12-4
[思考](1)请写出单质S、O2、Cl2、分别和Fe反应的化学方程式。
1.硫的性质 突破P97,98
[例1] 为了证明铁和硫反应产物中铁的化合价,下面是某同学设计的实验过程的一部分:
请回答下列问题:
⑴混合粉末A中硫粉过量的原因是___________________________________________。
⑵反应在“惰气环境中”进行的原因是 ______________________________________。
⑶操作①用烧热的玻璃棒点触混合粉末,反应即可持续进行,说明________________________________________________________。
⑷操作②的作用是什么____________________________________________ 。
⑸操作③稀H2SO4煮沸的目的是____________________________________。
⑹为了证明产物中铁元素的价态,对 D溶液的实验操作最好是 ___________________
[讨论思考](2)请根据下列反应现象,找出与之相应的溶质并说明SO2在反应中表现的性质。
溶液 溶质 SO2性质 反应离子方程式
①使紫色石蕊试剂变红色
②使红色溶液变无色
③使橙色溶液变无色
④使紫红色溶液变无色
⑤使蓝色溶液变无色
⑥使黄色溶液变浅绿色
⑦使无色溶液出现白色沉淀,继续通SO2沉淀又溶解
⑧使无色溶液出现白色沉淀,继续通SO2沉淀不溶解
2、二氧化硫的性质 突破P98
[思考] (3)如何鉴别SO2和CO2 ?
[讨论总结] SO2和CO2的比较
[例2]有两个实验小组的同学为探究过氧化钠与二氧化硫的反应,都用如下图所示的装置进行实验。通入SO2气体,将带余烬的木条插入试管C中,木条复燃。
请回答下列问题:
(1)第1小组同学认为Na2O2与SO2反应生成了Na2SO3和O2,该反应的化学方程式是:
(2)请设计一种实验方案证明Na2O2与SO2反应生成的白色固体中含有Na2SO3。
(3)第2小组同学认为Na2O2与SO2反应除了生成Na2SO3和O2外,还有Na2SO4生成。为检验是否有Na2SO4生成,他们设计了如下方案:
上述方案是否合理 。请简要说明理由:
[思考](4)SO2和Cl2分别通入石蕊试液中现象有何不同
若将SO2和Cl2等体积混合再通入石蕊试液中,又有何现象?
[讨论总结] 漂白原理的比较
[例3]有关二氧化硫的叙述中正确的是( )
A.用石灰水很容易区分二氧化碳和二氧化硫
B.常温常压下饱和二氧化硫水溶液的物质的量浓度约为1.7mol/L。
C.二氧化硫具有还原性,不可以用浓硫酸干燥。
D.二氧化硫通入氢硫酸中,溶液的pH先变大后变小。
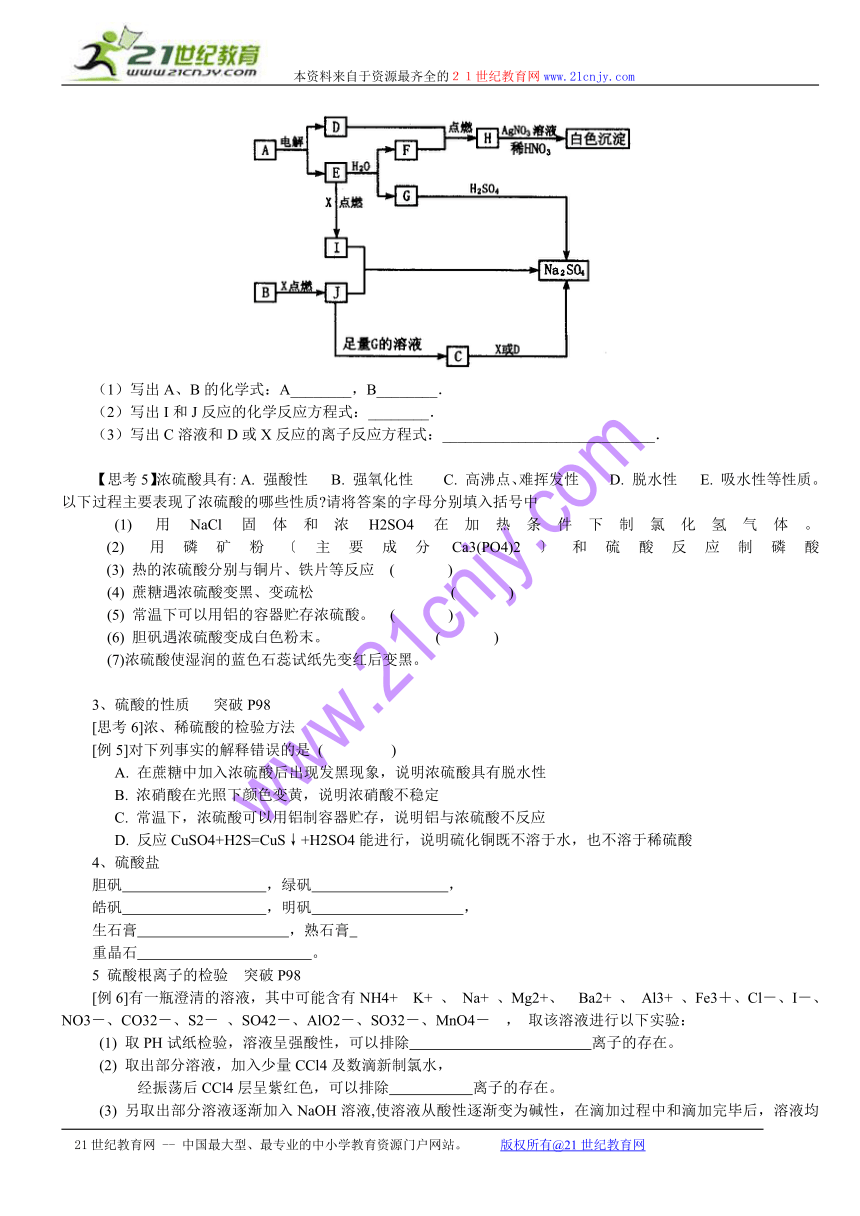
[例4]下图每个方框表示有关的一种反应物或生成物,方框中字母是物质代号,已知B、D、E、F、X均为单质,判断并回答下列问题:
(1)写出A、B的化学式:A________,B________.
(2)写出I和J反应的化学反应方程式:________.
(3)写出C溶液和D或X反应的离子反应方程式:____________________________.
【思考5】浓硫酸具有: A. 强酸性 B. 强氧化性 C. 高沸点、难挥发性 D. 脱水性 E. 吸水性等性质。以下过程主要表现了浓硫酸的哪些性质 请将答案的字母分别填入括号中
(1) 用NaCl固体和浓H2SO4在加热条件下制氯化氢气体。 (2) 用磷矿粉〔主要成分Ca3(PO4)2〕和硫酸反应制磷酸 (3) 热的浓硫酸分别与铜片、铁片等反应 ( )
(4) 蔗糖遇浓硫酸变黑、变疏松 ( )
(5) 常温下可以用铝的容器贮存浓硫酸。 ( )
(6) 胆矾遇浓硫酸变成白色粉末。 ( )
(7)浓硫酸使湿润的蓝色石蕊试纸先变红后变黑。
3、硫酸的性质 突破P98
[思考6]浓、稀硫酸的检验方法
[例5]对下列事实的解释错误的是 ( )
A. 在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有脱水性
B. 浓硝酸在光照下颜色变黄,说明浓硝酸不稳定
C. 常温下,浓硫酸可以用铝制容器贮存,说明铝与浓硫酸不反应
D. 反应CuSO4+H2S=CuS↓+H2SO4能进行,说明硫化铜既不溶于水,也不溶于稀硫酸
4、硫酸盐
胆矾 ,绿矾 ,
皓矾 ,明矾 ,
生石膏 ,熟石膏
重晶石 。
5 硫酸根离子的检验 突破P98
[例6]有一瓶澄清的溶液,其中可能含有NH4+ K+ 、 Na+ 、Mg2+、 Ba2+ 、 Al3+ 、Fe3+、Cl-、I-、NO3-、CO32-、S2- 、SO42-、AlO2-、SO32-、MnO4- , 取该溶液进行以下实验:
(1) 取PH试纸检验,溶液呈强酸性,可以排除 离子的存在。
(2) 取出部分溶液,加入少量CCl4及数滴新制氯水,
经振荡后CCl4层呈紫红色,可以排除 离子的存在。
(3) 另取出部分溶液逐渐加入NaOH溶液,使溶液从酸性逐渐变为碱性,在滴加过程中和滴加完毕后,溶液均无沉淀产生,则又可以排除 离子的存在。
(4) 取出部分上述碱性溶液加Na2CO3溶液后,有白色沉淀生成,证明 离子存在,又可排除 离子存在。
(5) 将(3) 得到的碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝。
根据上述实验事实确定:该溶液中肯定存在的离子是 。
还不能确定是否存在的离子是 。
[例7]硫铁矿在高温下被氧气氧化并产生SO2气体:4FeS2+11O2=8SO2+2Fe2O3。设空气中N2占4/5、O2占1/5,试完成下列各题:
(1) 55L空气和足量FeS2完全反应后,气体体积(同温同压下,下同)变为 L。
(2) 充分反应后(空气过量),则所得混合气体中SO2的体积分数n的取值范围 (以分数表示)。
(3) 若所得混合气体中SO2的体积分数为0.08,则所得混合气体中O2的体积分数 。
(4) 若该反应过程中,转移22mol电子,试通过计算确定用生成的SO2最多可制得98%的硫酸多少克?
强化训练:
1.(09福建卷7) 能实现下列物质间直接转化的元素是w.w.w.k.s.5.u.c.o.m
A. 硅 B. 硫 C. 铜 D. 铁
2.(09广东化学17) 常温下,往H2O2溶液中滴加少量FeSO4溶液,可发生如下两个反应:2Fe2++H2O2+2H+=2Fe3++2H2O 2Fe3++H2O2=2Fe2++O2↑+2H+下列说法正确的是
A.H2O2的氧化性比Fe3+强,其还原性比Fe2+弱
B.在H2O2分解过程中,溶液的pH逐渐下降
C.在H2O2分解过程中, Fe2+和Fe3+的总量保持不变
D.H2O2生产过程要严格避免混入Fe2+
3.(09北京卷8)下列叙述正确的是
A.将通入溶液中至饱和,无沉淀产生;再通入,产生沉淀
B.在稀硫酸中加入铜粉,铜粉不溶解;再加入固体,铜粉仍不溶解
C.向溶液中滴加氨水,产生白色沉淀;再加入溶液,沉淀消失
D.纯锌与稀硫酸反应产生氨气的速率较慢;再加入少量固体,速率不改变
k.s.5.u.c.o.m4.下列过程中,最终的白色沉淀物不一定是BaSO4的是( )
A.Fe(NO3)2溶液白色沉淀
B.Ba(NO3)2溶液白色沉淀
C.无色溶液白色沉淀
D.无色溶液无色溶液白色沉淀
5.关于酸雨的下列分析正确的是( )
A.因空气中无催化剂,SO2不能转化成SO3,酸雨中只含H2SO3
B.SO2在空气中有条件形成SO3,所以酸雨中含H2SO4
C.酸雨是无法避免的
D.H2SO4形成的酸雨比H2SO3危害大
6.为了除去混在CO2中的SO2和O2,下列试剂使用的顺序正确的是①饱和Na2CO3溶液;②饱和NaHCO3溶液;③浓硫酸;④灼热的铜网;⑤碱石灰( )
A.①②③ B.②③④ C.②⑤④ D.③④⑤
7.将11.2g铁粉和2.2g硫粉均匀混合,在密闭容器中加热到红热,冷却后加入足量的盐酸, 在标况下收集到的气体体积为( )
A.11.2L B.5.6L C.4.48L D.2.24L
8.在一定条件下,将70ml H2S气体和90mlO2混合,点燃并使其均反应完。再恢复
到原来条件则生成SO2生成气体的体积为( )
A.70ml B.60ml C.55ml D.50ml
9.对于反应Br2+SO2+2H2O2HBr+H2SO4和2HBr+H2SO4(浓) Br2+SO2+2H2O下列说法中正确的是( )
A.它们互为可逆反应
B.它们互相矛盾,不可能符合事实
C.反应条件的改变引起了反应方向的改变,它们都符合事实
D.氧化性:(浓)H2SO4>Br2;还原性:SO2>HBr
10.下列各组离子在水溶液中能大量共存的是( )
A.CO、HCO、OH-、Na+
B.K+、Cl-、S2-、CO
C.H+、Br-、Na+、SO
D.Ba2+、Cu2+、NO、SO
11. (09全国卷Ⅰ27)(15分)
浓H2SO4和木炭在加热时发生反应的化学方程式是
2 H2SO4 (浓) + C CO2↑+ 2 H2O + 2SO2↑
请从下图中选用所需的仪器(可重复选用)组成一套进行该反应并检出反应产物的装置。现提供浓H2SO4、木炭和酸性KMnO4溶液,其他固、液试剂自选。(连接和固定仪器用的玻璃管、胶管、铁夹、铁架台及加热装置等均略去)
将所选的仪器按连接顺序由上至下依次填入下表,并写出该仪器中应加试剂的名称及其作用。
选用的仪器(填字母) 加入的试剂 作用
12.如图所示,已知:
①甲、乙、丙、丁均为前三周期元素的单质。
②在一定条件下甲与丙和甲与丁都按物质的量之比1∶3反应,分别生成X和Y,在产物中元素甲呈负价。
③在一定条件下乙与丙和乙与丁都按物质的量之比1∶2反应,分别生成Z和W,在产物中元素乙呈负价。
请填空:
(1)甲是_______________ 乙是 。
(2)甲与丙反应生成X的化学方程式是 ______________________________。
(3)和丁反应生成W的化学方程式________________________________
13下图是有关硫及其化合物的实验装置:
实验中用到的实验试剂在下列中选择:①浓硫酸;②70%硫酸;③25%硫酸;④新开封的亚硫酸钠粉末;⑤硫化亚铁;⑥氢氧化钠溶液;⑦溴水;⑧碳酸钠溶液.
在实验开始不久即在B瓶中析出固体粉末状物质.试回答:
(1)A中分液漏斗盛放的试剂是 平底烧瓶中盛有的试剂是 .其中在实验时反应的化学方程式为 .
(2)B中的化学方程式是 ,反应的氧化产物和还原产物的物质的量比是 .
(3)E(启普发生器)中盛有的两种试剂及发生反应的离子方程式是:试剂 ,反应: .
(4)如果A、E两装置气体发生速度相同,流量也相同时,在D中反应的离子方程式是
.
(5)D的作用是 ,C的作用是 .
14、用图3-5所示的实验过程,测定含Na2SO3的硫酸钠中Na2SO3的质量分数(Na:23克/摩;Ba:137克/摩;S:32克/摩).
图3-5
测定沉淀乙(纯净干燥)的质量W1g,试回答:
(1)试剂A溶液是 ,检验A稍过量的方法是 ;
(2)试剂B溶液是 ,B的作用是 ;
(3)沉淀甲的化学式是 ,沉淀 乙的化学式是 ;
(4)沉淀甲与B反应的离子方程式是 ;
15.臭氧层是地球生命的保护神,臭氧比氧气具有更强的氧化性。实验室可将氧气通过高压放电管来制取臭氧:
(1)若在上述反应中有30%的氧气转化为臭氧,所得混合气的平均摩尔质量为______g/mol
(保留一位小数)。
(2)将8L氧气通过放电管后,恢复到原状况,得到气体6.5L,其中臭氧为_____________L。
(3)实验室将氧气和臭氧的混合气体0.896L(标准状况)通入盛有20.0g铜粉的反应器中,充分加热后,粉末的质量变为21.6g。则原混合气中臭氧的体积分数为__________________。
硫及其化合物答案
[例1](1)防止因铁粉过量而使滤渣C中含铁粉与H2SO4反应,生成Fe2+干扰实验(2)防止环境中的O2参与反应 (3)硫和铁粉反应是放热的
(4)除去混合物中的硫粉 3S+6KOH====2K2S+K2SO3+3H2O CS2
(5)防止H2SO4中溶解的氧气氧化生成的Fe2+
(6)加入煮沸的KSCN溶液,看是否变为血红色溶液
[思考] (3)①闻味
②分别通入溴水或酸性KMnO4溶液
③分别通入氢硫酸溶液
④分别通入品红溶液等
[例2] (1)(3分) 2Na2O2+2SO2=2Na2SO3+O2
(2)(3分) 取反应后的固体配成溶液,滴加稀盐酸看能否产生使湿润品红试纸褪色的气体。
(3)(每空2分) 不合理
①HNO3氧化性强,会把Na2SO3氧化为Na2SO4。
②溶于水时,若Na2O2剩余,也能把Na2SO3氧化为Na2SO4。
[例3]BD
[例4](1)NaCl(2分) S(2分)
(2) (2分)
(3) 或
[思考6]⑴取少量蒸馏水,向其中加入少量试样硫酸,如能放出大量热则为浓硫酸,反之为稀硫酸。
⑵手掂分量,因浓硫酸密度大,则重者为浓硫酸,轻者为稀硫酸。
⑶观察状态,略微摇动,若为油状粘稠液体为浓硫酸,另一为稀硫酸。
⑷取少量试液,向其中投入铁片,若产生大量气泡则为稀硫酸,另一为浓硫酸(钝化)。
⑸用玻棒蘸取试样在纸上写字,立即变黑者为浓硫酸,另一为稀硫酸。
⑹取少量试液,投入胆矾,颜色改变者为浓硫酸,另一为稀硫酸。
⑺取少量试样,分别投入小块铜片,稍加热,发生反应的(有气泡产生,溶液变蓝)为浓硫酸,无现象的稀硫酸。
[例5]C
[例6]1 CO32-S2-AlO2-SO32-
2 Fe3+MnO4-NO3-
3 Mg2+ Al3+
4 Ba2+ SO42-
5 NH4+ I-
K+ 、 Na+ 、 Cl-
[例7](1)52L
(2)0(3)0.096
(4)400g
强化训练:1B 2CD 3C 4.C 5.BD
6.B 7.C 8.C 9.CD 10.B
11 C 浓硫硫和木炭 产生反应物
B 无水硫酸铜 检验是否有水
A 品红 检验SO2
A 酸性KMnO4 除去SO2
A 澄清石灰水 检验CO2的存在。
12(1)氮 氧
(2)N2+3H22NH3
(3)O2+2Mg2MgO
13.(1)70%的H2SO4;新开封的无水Na2SO3;
Na2SO3+H2SO4 =Na2SO4+SO2↑+H2O
(2)2H2S+SO2=3S+2H2+2H2O
(3)25%H2SO4;FeS;FeS+2H+=Fe2++H2S↑
(4)SO2+2OH-=SO32-+H2O
(5)吸收多余的SO2防止污杂空气;防止NaOH溶液倒吸至B中,起保护作用
14.(1)BaCl2或Ba(OH)2溶液;取和量溶液乙,再滴加少量Na2SO4和H2SO4,如果出现
沉淀,说明A试剂已过量
(2)盐酸;溶解BaSO4
(3)BaSO3及BaSO4;BaSO4
(4)BaSO3+2H-=Ba2++H2O+SO2↑
15(1)35.6 (2)3 (3)0.5
D
C
B
A
操作③
加煮沸的稀H2SO4
加CS2并过滤
操作②
操作①
Fe、S混合粉末
惰气环境中
黑色固 体
滤渣
溶液
白色
沉淀
将B中反应后的固体溶解于水
BaCl2溶液
稀硝酸
仍有部分白色沉淀不溶解,证明有Na2SO4生成
△
21世纪教育网 -- 中国最大型、最专业的中小学教育资源门户网站。 版权所有@21世纪教育网
江苏省栟茶高级中学2010届高三化学预教学案
硫及其化合物 季本峰2009-12-4
[思考](1)请写出单质S、O2、Cl2、分别和Fe反应的化学方程式。
1.硫的性质 突破P97,98
[例1] 为了证明铁和硫反应产物中铁的化合价,下面是某同学设计的实验过程的一部分:
请回答下列问题:
⑴混合粉末A中硫粉过量的原因是___________________________________________。
⑵反应在“惰气环境中”进行的原因是 ______________________________________。
⑶操作①用烧热的玻璃棒点触混合粉末,反应即可持续进行,说明________________________________________________________。
⑷操作②的作用是什么____________________________________________ 。
⑸操作③稀H2SO4煮沸的目的是____________________________________。
⑹为了证明产物中铁元素的价态,对 D溶液的实验操作最好是 ___________________
[讨论思考](2)请根据下列反应现象,找出与之相应的溶质并说明SO2在反应中表现的性质。
溶液 溶质 SO2性质 反应离子方程式
①使紫色石蕊试剂变红色
②使红色溶液变无色
③使橙色溶液变无色
④使紫红色溶液变无色
⑤使蓝色溶液变无色
⑥使黄色溶液变浅绿色
⑦使无色溶液出现白色沉淀,继续通SO2沉淀又溶解
⑧使无色溶液出现白色沉淀,继续通SO2沉淀不溶解
2、二氧化硫的性质 突破P98
[思考] (3)如何鉴别SO2和CO2 ?
[讨论总结] SO2和CO2的比较
[例2]有两个实验小组的同学为探究过氧化钠与二氧化硫的反应,都用如下图所示的装置进行实验。通入SO2气体,将带余烬的木条插入试管C中,木条复燃。
请回答下列问题:
(1)第1小组同学认为Na2O2与SO2反应生成了Na2SO3和O2,该反应的化学方程式是:
(2)请设计一种实验方案证明Na2O2与SO2反应生成的白色固体中含有Na2SO3。
(3)第2小组同学认为Na2O2与SO2反应除了生成Na2SO3和O2外,还有Na2SO4生成。为检验是否有Na2SO4生成,他们设计了如下方案:
上述方案是否合理 。请简要说明理由:
[思考](4)SO2和Cl2分别通入石蕊试液中现象有何不同
若将SO2和Cl2等体积混合再通入石蕊试液中,又有何现象?
[讨论总结] 漂白原理的比较
[例3]有关二氧化硫的叙述中正确的是( )
A.用石灰水很容易区分二氧化碳和二氧化硫
B.常温常压下饱和二氧化硫水溶液的物质的量浓度约为1.7mol/L。
C.二氧化硫具有还原性,不可以用浓硫酸干燥。
D.二氧化硫通入氢硫酸中,溶液的pH先变大后变小。
[例4]下图每个方框表示有关的一种反应物或生成物,方框中字母是物质代号,已知B、D、E、F、X均为单质,判断并回答下列问题:
(1)写出A、B的化学式:A________,B________.
(2)写出I和J反应的化学反应方程式:________.
(3)写出C溶液和D或X反应的离子反应方程式:____________________________.
【思考5】浓硫酸具有: A. 强酸性 B. 强氧化性 C. 高沸点、难挥发性 D. 脱水性 E. 吸水性等性质。以下过程主要表现了浓硫酸的哪些性质 请将答案的字母分别填入括号中
(1) 用NaCl固体和浓H2SO4在加热条件下制氯化氢气体。 (2) 用磷矿粉〔主要成分Ca3(PO4)2〕和硫酸反应制磷酸 (3) 热的浓硫酸分别与铜片、铁片等反应 ( )
(4) 蔗糖遇浓硫酸变黑、变疏松 ( )
(5) 常温下可以用铝的容器贮存浓硫酸。 ( )
(6) 胆矾遇浓硫酸变成白色粉末。 ( )
(7)浓硫酸使湿润的蓝色石蕊试纸先变红后变黑。
3、硫酸的性质 突破P98
[思考6]浓、稀硫酸的检验方法
[例5]对下列事实的解释错误的是 ( )
A. 在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有脱水性
B. 浓硝酸在光照下颜色变黄,说明浓硝酸不稳定
C. 常温下,浓硫酸可以用铝制容器贮存,说明铝与浓硫酸不反应
D. 反应CuSO4+H2S=CuS↓+H2SO4能进行,说明硫化铜既不溶于水,也不溶于稀硫酸
4、硫酸盐
胆矾 ,绿矾 ,
皓矾 ,明矾 ,
生石膏 ,熟石膏
重晶石 。
5 硫酸根离子的检验 突破P98
[例6]有一瓶澄清的溶液,其中可能含有NH4+ K+ 、 Na+ 、Mg2+、 Ba2+ 、 Al3+ 、Fe3+、Cl-、I-、NO3-、CO32-、S2- 、SO42-、AlO2-、SO32-、MnO4- , 取该溶液进行以下实验:
(1) 取PH试纸检验,溶液呈强酸性,可以排除 离子的存在。
(2) 取出部分溶液,加入少量CCl4及数滴新制氯水,
经振荡后CCl4层呈紫红色,可以排除 离子的存在。
(3) 另取出部分溶液逐渐加入NaOH溶液,使溶液从酸性逐渐变为碱性,在滴加过程中和滴加完毕后,溶液均无沉淀产生,则又可以排除 离子的存在。
(4) 取出部分上述碱性溶液加Na2CO3溶液后,有白色沉淀生成,证明 离子存在,又可排除 离子存在。
(5) 将(3) 得到的碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝。
根据上述实验事实确定:该溶液中肯定存在的离子是 。
还不能确定是否存在的离子是 。
[例7]硫铁矿在高温下被氧气氧化并产生SO2气体:4FeS2+11O2=8SO2+2Fe2O3。设空气中N2占4/5、O2占1/5,试完成下列各题:
(1) 55L空气和足量FeS2完全反应后,气体体积(同温同压下,下同)变为 L。
(2) 充分反应后(空气过量),则所得混合气体中SO2的体积分数n的取值范围 (以分数表示)。
(3) 若所得混合气体中SO2的体积分数为0.08,则所得混合气体中O2的体积分数 。
(4) 若该反应过程中,转移22mol电子,试通过计算确定用生成的SO2最多可制得98%的硫酸多少克?
强化训练:
1.(09福建卷7) 能实现下列物质间直接转化的元素是w.w.w.k.s.5.u.c.o.m
A. 硅 B. 硫 C. 铜 D. 铁
2.(09广东化学17) 常温下,往H2O2溶液中滴加少量FeSO4溶液,可发生如下两个反应:2Fe2++H2O2+2H+=2Fe3++2H2O 2Fe3++H2O2=2Fe2++O2↑+2H+下列说法正确的是
A.H2O2的氧化性比Fe3+强,其还原性比Fe2+弱
B.在H2O2分解过程中,溶液的pH逐渐下降
C.在H2O2分解过程中, Fe2+和Fe3+的总量保持不变
D.H2O2生产过程要严格避免混入Fe2+
3.(09北京卷8)下列叙述正确的是
A.将通入溶液中至饱和,无沉淀产生;再通入,产生沉淀
B.在稀硫酸中加入铜粉,铜粉不溶解;再加入固体,铜粉仍不溶解
C.向溶液中滴加氨水,产生白色沉淀;再加入溶液,沉淀消失
D.纯锌与稀硫酸反应产生氨气的速率较慢;再加入少量固体,速率不改变
k.s.5.u.c.o.m4.下列过程中,最终的白色沉淀物不一定是BaSO4的是( )
A.Fe(NO3)2溶液白色沉淀
B.Ba(NO3)2溶液白色沉淀
C.无色溶液白色沉淀
D.无色溶液无色溶液白色沉淀
5.关于酸雨的下列分析正确的是( )
A.因空气中无催化剂,SO2不能转化成SO3,酸雨中只含H2SO3
B.SO2在空气中有条件形成SO3,所以酸雨中含H2SO4
C.酸雨是无法避免的
D.H2SO4形成的酸雨比H2SO3危害大
6.为了除去混在CO2中的SO2和O2,下列试剂使用的顺序正确的是①饱和Na2CO3溶液;②饱和NaHCO3溶液;③浓硫酸;④灼热的铜网;⑤碱石灰( )
A.①②③ B.②③④ C.②⑤④ D.③④⑤
7.将11.2g铁粉和2.2g硫粉均匀混合,在密闭容器中加热到红热,冷却后加入足量的盐酸, 在标况下收集到的气体体积为( )
A.11.2L B.5.6L C.4.48L D.2.24L
8.在一定条件下,将70ml H2S气体和90mlO2混合,点燃并使其均反应完。再恢复
到原来条件则生成SO2生成气体的体积为( )
A.70ml B.60ml C.55ml D.50ml
9.对于反应Br2+SO2+2H2O2HBr+H2SO4和2HBr+H2SO4(浓) Br2+SO2+2H2O下列说法中正确的是( )
A.它们互为可逆反应
B.它们互相矛盾,不可能符合事实
C.反应条件的改变引起了反应方向的改变,它们都符合事实
D.氧化性:(浓)H2SO4>Br2;还原性:SO2>HBr
10.下列各组离子在水溶液中能大量共存的是( )
A.CO、HCO、OH-、Na+
B.K+、Cl-、S2-、CO
C.H+、Br-、Na+、SO
D.Ba2+、Cu2+、NO、SO
11. (09全国卷Ⅰ27)(15分)
浓H2SO4和木炭在加热时发生反应的化学方程式是
2 H2SO4 (浓) + C CO2↑+ 2 H2O + 2SO2↑
请从下图中选用所需的仪器(可重复选用)组成一套进行该反应并检出反应产物的装置。现提供浓H2SO4、木炭和酸性KMnO4溶液,其他固、液试剂自选。(连接和固定仪器用的玻璃管、胶管、铁夹、铁架台及加热装置等均略去)
将所选的仪器按连接顺序由上至下依次填入下表,并写出该仪器中应加试剂的名称及其作用。
选用的仪器(填字母) 加入的试剂 作用
12.如图所示,已知:
①甲、乙、丙、丁均为前三周期元素的单质。
②在一定条件下甲与丙和甲与丁都按物质的量之比1∶3反应,分别生成X和Y,在产物中元素甲呈负价。
③在一定条件下乙与丙和乙与丁都按物质的量之比1∶2反应,分别生成Z和W,在产物中元素乙呈负价。
请填空:
(1)甲是_______________ 乙是 。
(2)甲与丙反应生成X的化学方程式是 ______________________________。
(3)和丁反应生成W的化学方程式________________________________
13下图是有关硫及其化合物的实验装置:
实验中用到的实验试剂在下列中选择:①浓硫酸;②70%硫酸;③25%硫酸;④新开封的亚硫酸钠粉末;⑤硫化亚铁;⑥氢氧化钠溶液;⑦溴水;⑧碳酸钠溶液.
在实验开始不久即在B瓶中析出固体粉末状物质.试回答:
(1)A中分液漏斗盛放的试剂是 平底烧瓶中盛有的试剂是 .其中在实验时反应的化学方程式为 .
(2)B中的化学方程式是 ,反应的氧化产物和还原产物的物质的量比是 .
(3)E(启普发生器)中盛有的两种试剂及发生反应的离子方程式是:试剂 ,反应: .
(4)如果A、E两装置气体发生速度相同,流量也相同时,在D中反应的离子方程式是
.
(5)D的作用是 ,C的作用是 .
14、用图3-5所示的实验过程,测定含Na2SO3的硫酸钠中Na2SO3的质量分数(Na:23克/摩;Ba:137克/摩;S:32克/摩).
图3-5
测定沉淀乙(纯净干燥)的质量W1g,试回答:
(1)试剂A溶液是 ,检验A稍过量的方法是 ;
(2)试剂B溶液是 ,B的作用是 ;
(3)沉淀甲的化学式是 ,沉淀 乙的化学式是 ;
(4)沉淀甲与B反应的离子方程式是 ;
15.臭氧层是地球生命的保护神,臭氧比氧气具有更强的氧化性。实验室可将氧气通过高压放电管来制取臭氧:
(1)若在上述反应中有30%的氧气转化为臭氧,所得混合气的平均摩尔质量为______g/mol
(保留一位小数)。
(2)将8L氧气通过放电管后,恢复到原状况,得到气体6.5L,其中臭氧为_____________L。
(3)实验室将氧气和臭氧的混合气体0.896L(标准状况)通入盛有20.0g铜粉的反应器中,充分加热后,粉末的质量变为21.6g。则原混合气中臭氧的体积分数为__________________。
硫及其化合物答案
[例1](1)防止因铁粉过量而使滤渣C中含铁粉与H2SO4反应,生成Fe2+干扰实验(2)防止环境中的O2参与反应 (3)硫和铁粉反应是放热的
(4)除去混合物中的硫粉 3S+6KOH====2K2S+K2SO3+3H2O CS2
(5)防止H2SO4中溶解的氧气氧化生成的Fe2+
(6)加入煮沸的KSCN溶液,看是否变为血红色溶液
[思考] (3)①闻味
②分别通入溴水或酸性KMnO4溶液
③分别通入氢硫酸溶液
④分别通入品红溶液等
[例2] (1)(3分) 2Na2O2+2SO2=2Na2SO3+O2
(2)(3分) 取反应后的固体配成溶液,滴加稀盐酸看能否产生使湿润品红试纸褪色的气体。
(3)(每空2分) 不合理
①HNO3氧化性强,会把Na2SO3氧化为Na2SO4。
②溶于水时,若Na2O2剩余,也能把Na2SO3氧化为Na2SO4。
[例3]BD
[例4](1)NaCl(2分) S(2分)
(2) (2分)
(3) 或
[思考6]⑴取少量蒸馏水,向其中加入少量试样硫酸,如能放出大量热则为浓硫酸,反之为稀硫酸。
⑵手掂分量,因浓硫酸密度大,则重者为浓硫酸,轻者为稀硫酸。
⑶观察状态,略微摇动,若为油状粘稠液体为浓硫酸,另一为稀硫酸。
⑷取少量试液,向其中投入铁片,若产生大量气泡则为稀硫酸,另一为浓硫酸(钝化)。
⑸用玻棒蘸取试样在纸上写字,立即变黑者为浓硫酸,另一为稀硫酸。
⑹取少量试液,投入胆矾,颜色改变者为浓硫酸,另一为稀硫酸。
⑺取少量试样,分别投入小块铜片,稍加热,发生反应的(有气泡产生,溶液变蓝)为浓硫酸,无现象的稀硫酸。
[例5]C
[例6]1 CO32-S2-AlO2-SO32-
2 Fe3+MnO4-NO3-
3 Mg2+ Al3+
4 Ba2+ SO42-
5 NH4+ I-
K+ 、 Na+ 、 Cl-
[例7](1)52L
(2)0
(4)400g
强化训练:1B 2CD 3C 4.C 5.BD
6.B 7.C 8.C 9.CD 10.B
11 C 浓硫硫和木炭 产生反应物
B 无水硫酸铜 检验是否有水
A 品红 检验SO2
A 酸性KMnO4 除去SO2
A 澄清石灰水 检验CO2的存在。
12(1)氮 氧
(2)N2+3H22NH3
(3)O2+2Mg2MgO
13.(1)70%的H2SO4;新开封的无水Na2SO3;
Na2SO3+H2SO4 =Na2SO4+SO2↑+H2O
(2)2H2S+SO2=3S+2H2+2H2O
(3)25%H2SO4;FeS;FeS+2H+=Fe2++H2S↑
(4)SO2+2OH-=SO32-+H2O
(5)吸收多余的SO2防止污杂空气;防止NaOH溶液倒吸至B中,起保护作用
14.(1)BaCl2或Ba(OH)2溶液;取和量溶液乙,再滴加少量Na2SO4和H2SO4,如果出现
沉淀,说明A试剂已过量
(2)盐酸;溶解BaSO4
(3)BaSO3及BaSO4;BaSO4
(4)BaSO3+2H-=Ba2++H2O+SO2↑
15(1)35.6 (2)3 (3)0.5
D
C
B
A
操作③
加煮沸的稀H2SO4
加CS2并过滤
操作②
操作①
Fe、S混合粉末
惰气环境中
黑色固 体
滤渣
溶液
白色
沉淀
将B中反应后的固体溶解于水
BaCl2溶液
稀硝酸
仍有部分白色沉淀不溶解,证明有Na2SO4生成
△
21世纪教育网 -- 中国最大型、最专业的中小学教育资源门户网站。 版权所有@21世纪教育网
