从铝土矿到铝合金(一)
图片预览






文档简介
课件14张PPT。 铝的性质 人因奋斗而美丽铝的物理性质铝是银白色的轻金属,较软,密度2.7g/cm3,熔点660.4℃,沸点2467℃
纯铝的导电性很好,铝是热的良导体,在工业上可用铝制造各种热交换器、散热材料和民用炊具等。
铝有良好的延展性,能够抽成细丝,轧制成各种铝制品,还可制成薄于0.01mm的铝箔,广泛地用于包装香烟、糖果等。 地壳中最多的金属元素铝的化学性质铝在地壳中主要是以铝土矿(主要成分为Al2O3)的形式存在
铝的原子结构
易失去电子,形成Al3+
化学性质活泼
较强的还原性一.铝与非金属(O2,Cl2,S )反应铝在空气中易被氧化,表面会形成一层氧化膜(Al2O3){对铝具有保护作用}
铝可以在氧气中剧烈燃烧(发光,发热)
化学方程式:4Al+3O2 = 2Al2O3
点燃试着写出铝与S及Cl2的化学方程式2Al+3S =Al2S3
2Al+3Cl2 =2AlCl3△△二.铝与水反应常温下铝能与水反应吗?(与钠,镁比较)
铝跟冷水不反应,跟沸水能发生缓慢反应
2Al+6H2O=2Al(OH)3+3H2↑
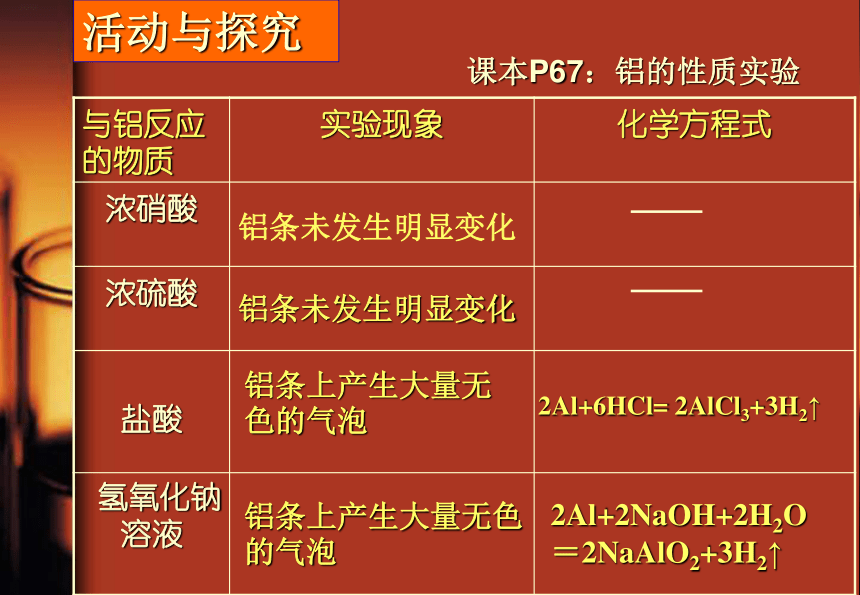
△2Al+6HCl= 2AlCl3+3H2↑2Al+2NaOH+2H2O=2NaAlO2+3H2↑铝条未发生明显变化铝条未发生明显变化铝条上产生大量无色的气泡
铝条上产生大量无色的气泡活动与探究课本P67:铝的性质实验三.铝与酸碱反应1.与酸反应
① 2Al+6HCl =2AlCl3+3H2↑
② 2Al+3H2SO4=Al2(SO4)3+3H2 ↑
离子方程式:2Al+6H+=2Al3++3H2↑
为什么铝在浓酸中会没有明显象?问题:常温下,铝遇浓硫酸、浓硝酸时在表面生成致密
的氧化膜而发生钝化
(工业上有时还用铝槽车贮运浓硝酸、浓硫酸)2.与碱反应
离子方程式:2Al3++2OH-+2H2O=2AlO2-+3H2↑ 2Al+2NaOH+2H2O=2NaAlO2+3H2↑2Al+6H2O=2Al(OH)3+3H2↑Al(OH)3+NaOH=NaAlO2+2H2O2Al+2NaOH+6H2O=2NaAlO2+3H2↑+4H2O反应机理: 四.铝热反应 原理: 利用铝的强还原性 和铝转化为氧化铝时能放出大量热的性质,工业上常用铝粉来还原一些金属氧化物2Al+Fe2O3=2Fe+Al2O3高温铝热反应的实质是高温下,
较活泼的铝置换出较不活泼的金
工业上常用于冶炼金属。铝热反应
在生活中的应用练习:1. 有人对铝制品因为表面氧化出现灰色而总感到不美观,所以常用钢丝球进行擦洗,你认为有必要吗?为什么?
2.将表面已完全钝化的铝条投入下列溶液中,不会发生反应的是 ( )
A.稀硝酸 B.稀盐酸
C.硝酸铜 D.氢氧化钠
C3.和铝粉可以发生铝热反应的是 ( )
A. 氧化钠 B. 镁粉
C. 氧化钨 D. 硫粉
4.写出Al分别与Cr2O3 、 MnO2 、V2O5 的反应化学方程式
C2Al+Cr2O3==2Cr+Al2O3
4Al+3MnO2==3Mn+2Al2O3
10Al+3V2O5==6V+5Al2O3
高温高温高温5.铝粉投入某无色溶液中产生H2,则下列离子组合可存在于该无色溶液中的是 ( )
A. H+,Mg2+,Ba2+,Cl-
B. OH-, NO3- , Cl-, Ba2+
C. H+,Cu2+,K+ ,SO42-
D. OH-, Mg2+, CO32-, NO3-
AB作业:1.相同物质的量(a mol)的铝与足量的盐酸或足量的氢氧化钠反应时,用去的酸和氢氧化钠的物质的量相等吗?产生的氢气的物质的量相等吗?(做练习本上)
2. 优化(第三课时)
纯铝的导电性很好,铝是热的良导体,在工业上可用铝制造各种热交换器、散热材料和民用炊具等。
铝有良好的延展性,能够抽成细丝,轧制成各种铝制品,还可制成薄于0.01mm的铝箔,广泛地用于包装香烟、糖果等。 地壳中最多的金属元素铝的化学性质铝在地壳中主要是以铝土矿(主要成分为Al2O3)的形式存在
铝的原子结构
易失去电子,形成Al3+
化学性质活泼
较强的还原性一.铝与非金属(O2,Cl2,S )反应铝在空气中易被氧化,表面会形成一层氧化膜(Al2O3){对铝具有保护作用}
铝可以在氧气中剧烈燃烧(发光,发热)
化学方程式:4Al+3O2 = 2Al2O3
点燃试着写出铝与S及Cl2的化学方程式2Al+3S =Al2S3
2Al+3Cl2 =2AlCl3△△二.铝与水反应常温下铝能与水反应吗?(与钠,镁比较)
铝跟冷水不反应,跟沸水能发生缓慢反应
2Al+6H2O=2Al(OH)3+3H2↑
△2Al+6HCl= 2AlCl3+3H2↑2Al+2NaOH+2H2O=2NaAlO2+3H2↑铝条未发生明显变化铝条未发生明显变化铝条上产生大量无色的气泡
铝条上产生大量无色的气泡活动与探究课本P67:铝的性质实验三.铝与酸碱反应1.与酸反应
① 2Al+6HCl =2AlCl3+3H2↑
② 2Al+3H2SO4=Al2(SO4)3+3H2 ↑
离子方程式:2Al+6H+=2Al3++3H2↑
为什么铝在浓酸中会没有明显象?问题:常温下,铝遇浓硫酸、浓硝酸时在表面生成致密
的氧化膜而发生钝化
(工业上有时还用铝槽车贮运浓硝酸、浓硫酸)2.与碱反应
离子方程式:2Al3++2OH-+2H2O=2AlO2-+3H2↑ 2Al+2NaOH+2H2O=2NaAlO2+3H2↑2Al+6H2O=2Al(OH)3+3H2↑Al(OH)3+NaOH=NaAlO2+2H2O2Al+2NaOH+6H2O=2NaAlO2+3H2↑+4H2O反应机理: 四.铝热反应 原理: 利用铝的强还原性 和铝转化为氧化铝时能放出大量热的性质,工业上常用铝粉来还原一些金属氧化物2Al+Fe2O3=2Fe+Al2O3高温铝热反应的实质是高温下,
较活泼的铝置换出较不活泼的金
工业上常用于冶炼金属。铝热反应
在生活中的应用练习:1. 有人对铝制品因为表面氧化出现灰色而总感到不美观,所以常用钢丝球进行擦洗,你认为有必要吗?为什么?
2.将表面已完全钝化的铝条投入下列溶液中,不会发生反应的是 ( )
A.稀硝酸 B.稀盐酸
C.硝酸铜 D.氢氧化钠
C3.和铝粉可以发生铝热反应的是 ( )
A. 氧化钠 B. 镁粉
C. 氧化钨 D. 硫粉
4.写出Al分别与Cr2O3 、 MnO2 、V2O5 的反应化学方程式
C2Al+Cr2O3==2Cr+Al2O3
4Al+3MnO2==3Mn+2Al2O3
10Al+3V2O5==6V+5Al2O3
高温高温高温5.铝粉投入某无色溶液中产生H2,则下列离子组合可存在于该无色溶液中的是 ( )
A. H+,Mg2+,Ba2+,Cl-
B. OH-, NO3- , Cl-, Ba2+
C. H+,Cu2+,K+ ,SO42-
D. OH-, Mg2+, CO32-, NO3-
AB作业:1.相同物质的量(a mol)的铝与足量的盐酸或足量的氢氧化钠反应时,用去的酸和氢氧化钠的物质的量相等吗?产生的氢气的物质的量相等吗?(做练习本上)
2. 优化(第三课时)
