《硫和氮的氧化物》第1课时
文档属性
| 名称 | 《硫和氮的氧化物》第1课时 |  | |
| 格式 | rar | ||
| 文件大小 | 60.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2009-12-25 14:53:00 | ||
图片预览





文档简介
课件23张PPT。《硫和氮的氧化物》
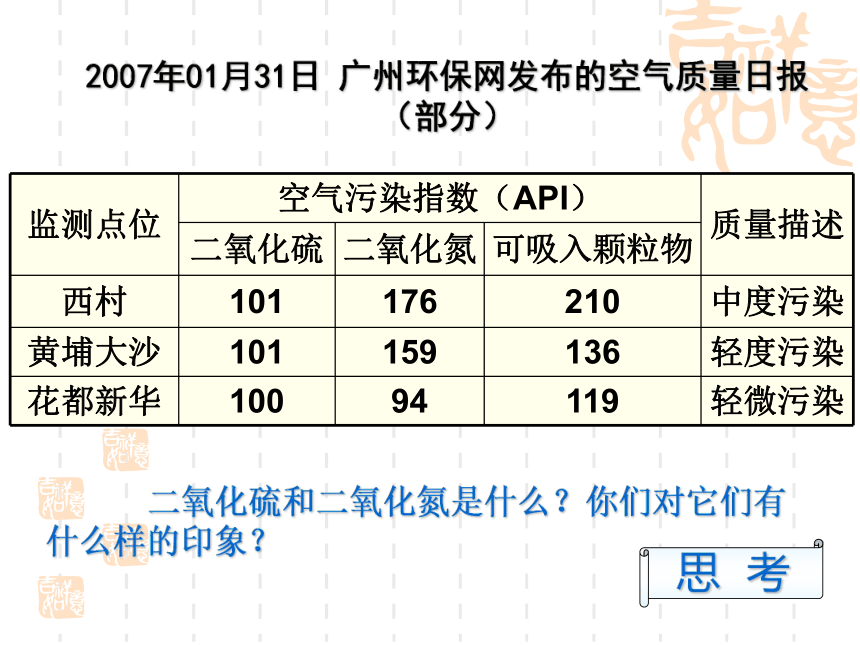
第1课时 参赛课题 汕头市潮阳区第一中学 谢新民2007年01月31日 广州环保网发布的空气质量日报
(部分) 二氧化硫和二氧化氮是什么?你们对它们有什么样的印象?思 考硫的氧化物 1. SO2的来源 火山爆发、森林火灾、有机体分解、
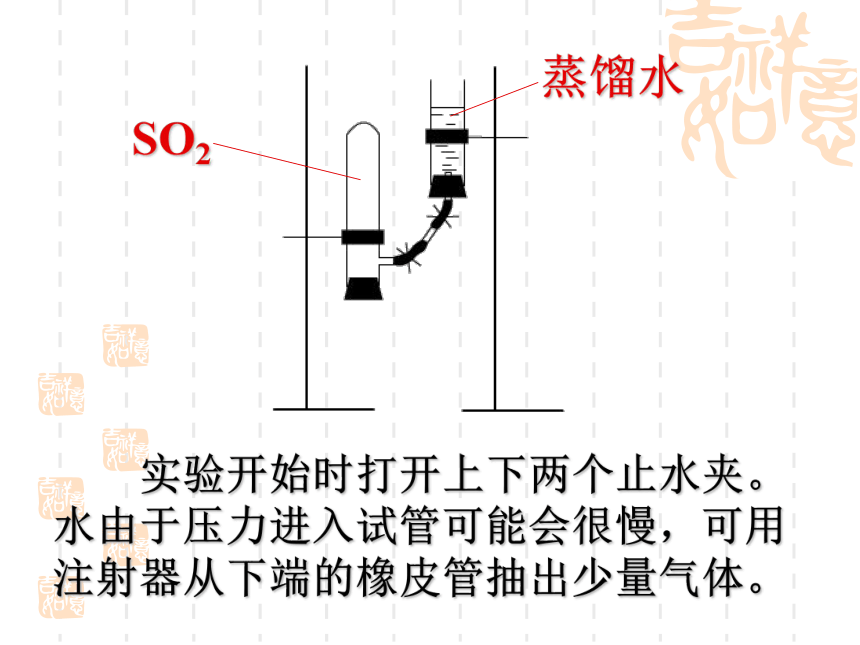
海洋雾沫等。硫粉天然:人为:化石燃料的燃烧、工业尾气等。 实验开始时打开上下两个止水夹。水由于压力进入试管可能会很慢,可用注射器从下端的橡皮管抽出少量气体。 硫的氧化物 2. SO2的物理性质 无色、密度比空气大、易溶于水、有刺激性气味、易液化。 思 考根据物质的分类和SO2中硫元素的化合价,推测其可能有的性质?其性质类似哪个氧化物?
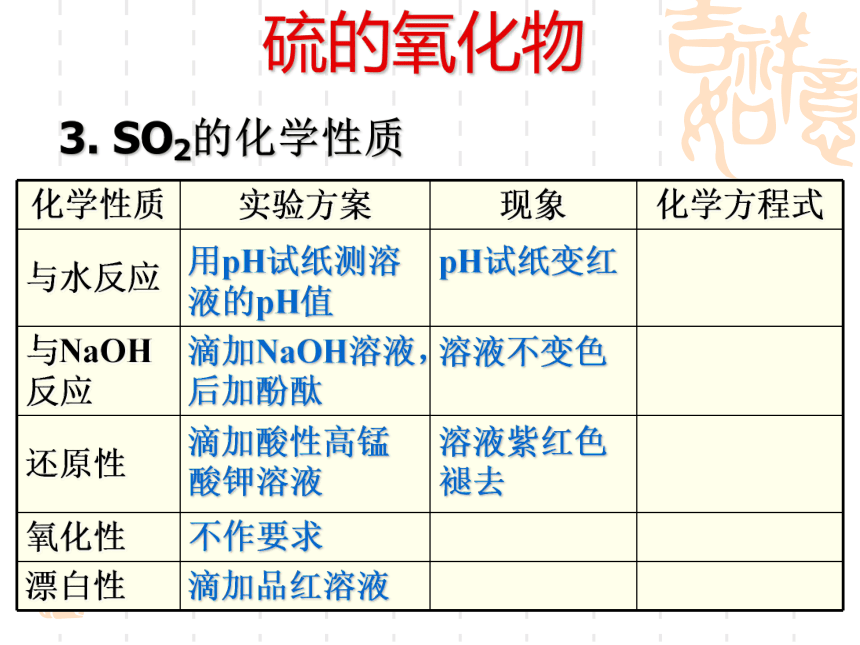
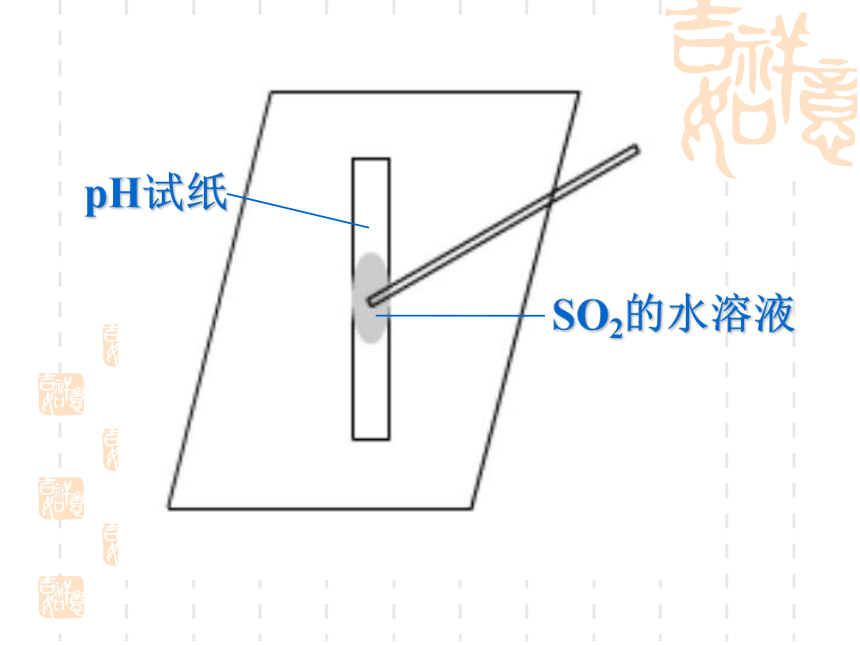
请设计实验验证SO2的上述性质?完成下面表格。硫的氧化物 3. SO2的化学性质SO2的水溶液pH试纸由此可知SO2可用来做什么?这种酸雨在放置一段时间后酸性会发生什么变化?为什么? 硫的氧化物 3. SO2的化学性质① SO2与水反应可逆反应:在相同条件下,既能向正反应方向进行、
又能向逆反应方向进行的反应。 2H2SO3+O2=2H2SO4思 考现在知道SO2是如何导致酸雨的吗?SO2+H2O H2SO3硫的氧化物 3. SO2的化学性质① SO2与水反应可逆反应:在相同条件下,既能向正反应方向进行、
又能向逆反应方向进行的反应。 2H2SO3+O2=2H2SO4这种酸雨在放置一段时间后酸性会增强。工业制硫酸: SO3+H2O=H2SO4SO2的水溶液酸性高锰酸钾溶液硫的氧化物 3. SO2的化学性质② SO2的还原性① SO2与水反应SO2既有氧化性,也有还原性,以还原性为主。硫的氧化物 3. SO2的化学性质② SO2的还原性① SO2与水反应③ SO2与NaOH反应 SO2+2NaOH=Na2SO3 +H2O 硫的氧化物 3. SO2的化学性质② SO2的还原性① SO2与水反应③ SO2与NaOH反应 ④ SO2具有漂白性,但不稳定 为什么会这样呢?这一点与HClO的漂白性有什么区别?
SO2的这一性质我们可以用来做什么? 思 考硫的氧化物 3. SO2的化学性质② SO2的还原性① SO2与水反应③ SO2与NaOH反应 ④ SO2具有漂白性,但不稳定 SO2的漂白是非氧化还原反应,漂白效果是暂时的,
HClO的漂白是氧化还原反应,漂白效果是永久的。用SO2漂白食品,对人体有害。硫的氧化物 3. SO2的化学性质② SO2的还原性① SO2与水反应③ SO2与NaOH反应 ④ SO2具有漂白性,但不稳定 SO2能使所有有颜色的东西漂白吗? SO2能使酸性KMnO4溶液褪色,是因为其漂白性吗?如何用实验加以证明?思 考硫的氧化物 3. SO2的化学性质② SO2的还原性① SO2与水反应③ SO2与NaOH反应 ④ SO2具有漂白性,但不稳定 SO2的漂白是非氧化还原反应,漂白效果是暂时的,
HClO的漂白是氧化还原反应,漂白效果是永久的。用SO2漂白食品,对人体有害。SO2并不能使所有有颜色的东西漂白。SO2能酸性KMnO4溶液褪色,不是其漂白性而是其还原性。硫的氧化物 1.下列污染现象主要与SO2有关的是
A.臭氧空洞 B.酸雨
C.光化学烟雾 D.温室效应
2.以下气体能用NaOH固体干燥的是:
A.NH3 B.SO2
C.CO2 D.HCl
3.能鉴别SO2和CO2的试剂是:
A.品红溶液 B.澄清石灰水
C.紫色石蕊试液 D.高锰酸钾溶液硫的氧化物 4.某冶炼厂利用炼铜产生的SO2生产硫酸,
变废为宝,化害为利。其原理是
A.利用了SO2的水溶性,将SO2直接通
入水中
B.利用了SO2的氧化性,将SO2直接通
入水中
C.利用了SO2的氧化性,使其与O2反
应而转化为SO3,再与水反应
D.利用了SO2的还原性,使其与O2反
应而转化为SO3,再与水反应 硫的氧化物 3. SO2的化学性质② SO2的还原性① SO2与水反应③ SO2与NaOH反应 ④ SO2具有漂白性,但不稳定 小结:SO2①物质分类的角度——酸性氧化物;②氧化还原的角度——以还原性为主;③特殊性角度——漂白性(暂时)硫的氧化物 作业:
1.某学生利用如图装置做如下实验:在试管中注入某无色溶液,加热试管,溶液变为红色,冷却后恢复无色,则此溶液可能是 溶液。加热时溶液由无色变为红色的原因是 。 2.请用最少的仪器设计一个装置(画出装置示意图)一次性验证SO2的主要化学性质。提示:可用Na2SO3与浓硫酸反应来制取SO2气体。 多谢指导!
(部分) 二氧化硫和二氧化氮是什么?你们对它们有什么样的印象?思 考硫的氧化物 1. SO2的来源 火山爆发、森林火灾、有机体分解、
海洋雾沫等。硫粉天然:人为:化石燃料的燃烧、工业尾气等。 实验开始时打开上下两个止水夹。水由于压力进入试管可能会很慢,可用注射器从下端的橡皮管抽出少量气体。 硫的氧化物 2. SO2的物理性质 无色、密度比空气大、易溶于水、有刺激性气味、易液化。 思 考根据物质的分类和SO2中硫元素的化合价,推测其可能有的性质?其性质类似哪个氧化物?
请设计实验验证SO2的上述性质?完成下面表格。硫的氧化物 3. SO2的化学性质SO2的水溶液pH试纸由此可知SO2可用来做什么?这种酸雨在放置一段时间后酸性会发生什么变化?为什么? 硫的氧化物 3. SO2的化学性质① SO2与水反应可逆反应:在相同条件下,既能向正反应方向进行、
又能向逆反应方向进行的反应。 2H2SO3+O2=2H2SO4思 考现在知道SO2是如何导致酸雨的吗?SO2+H2O H2SO3硫的氧化物 3. SO2的化学性质① SO2与水反应可逆反应:在相同条件下,既能向正反应方向进行、
又能向逆反应方向进行的反应。 2H2SO3+O2=2H2SO4这种酸雨在放置一段时间后酸性会增强。工业制硫酸: SO3+H2O=H2SO4SO2的水溶液酸性高锰酸钾溶液硫的氧化物 3. SO2的化学性质② SO2的还原性① SO2与水反应SO2既有氧化性,也有还原性,以还原性为主。硫的氧化物 3. SO2的化学性质② SO2的还原性① SO2与水反应③ SO2与NaOH反应 SO2+2NaOH=Na2SO3 +H2O 硫的氧化物 3. SO2的化学性质② SO2的还原性① SO2与水反应③ SO2与NaOH反应 ④ SO2具有漂白性,但不稳定 为什么会这样呢?这一点与HClO的漂白性有什么区别?
SO2的这一性质我们可以用来做什么? 思 考硫的氧化物 3. SO2的化学性质② SO2的还原性① SO2与水反应③ SO2与NaOH反应 ④ SO2具有漂白性,但不稳定 SO2的漂白是非氧化还原反应,漂白效果是暂时的,
HClO的漂白是氧化还原反应,漂白效果是永久的。用SO2漂白食品,对人体有害。硫的氧化物 3. SO2的化学性质② SO2的还原性① SO2与水反应③ SO2与NaOH反应 ④ SO2具有漂白性,但不稳定 SO2能使所有有颜色的东西漂白吗? SO2能使酸性KMnO4溶液褪色,是因为其漂白性吗?如何用实验加以证明?思 考硫的氧化物 3. SO2的化学性质② SO2的还原性① SO2与水反应③ SO2与NaOH反应 ④ SO2具有漂白性,但不稳定 SO2的漂白是非氧化还原反应,漂白效果是暂时的,
HClO的漂白是氧化还原反应,漂白效果是永久的。用SO2漂白食品,对人体有害。SO2并不能使所有有颜色的东西漂白。SO2能酸性KMnO4溶液褪色,不是其漂白性而是其还原性。硫的氧化物 1.下列污染现象主要与SO2有关的是
A.臭氧空洞 B.酸雨
C.光化学烟雾 D.温室效应
2.以下气体能用NaOH固体干燥的是:
A.NH3 B.SO2
C.CO2 D.HCl
3.能鉴别SO2和CO2的试剂是:
A.品红溶液 B.澄清石灰水
C.紫色石蕊试液 D.高锰酸钾溶液硫的氧化物 4.某冶炼厂利用炼铜产生的SO2生产硫酸,
变废为宝,化害为利。其原理是
A.利用了SO2的水溶性,将SO2直接通
入水中
B.利用了SO2的氧化性,将SO2直接通
入水中
C.利用了SO2的氧化性,使其与O2反
应而转化为SO3,再与水反应
D.利用了SO2的还原性,使其与O2反
应而转化为SO3,再与水反应 硫的氧化物 3. SO2的化学性质② SO2的还原性① SO2与水反应③ SO2与NaOH反应 ④ SO2具有漂白性,但不稳定 小结:SO2①物质分类的角度——酸性氧化物;②氧化还原的角度——以还原性为主;③特殊性角度——漂白性(暂时)硫的氧化物 作业:
1.某学生利用如图装置做如下实验:在试管中注入某无色溶液,加热试管,溶液变为红色,冷却后恢复无色,则此溶液可能是 溶液。加热时溶液由无色变为红色的原因是 。 2.请用最少的仪器设计一个装置(画出装置示意图)一次性验证SO2的主要化学性质。提示:可用Na2SO3与浓硫酸反应来制取SO2气体。 多谢指导!
