第二节 富集在海水中的元素--氯
文档属性
| 名称 | 第二节 富集在海水中的元素--氯 |
|
|
| 格式 | rar | ||
| 文件大小 | 158.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2009-12-25 00:00:00 | ||
图片预览




文档简介
本资料来自于资源最齐全的21世纪教育网www.21cnjy.com
第二课时
【主干知识梳理】
一、Cl-的检验。
在五只试管中分别加入2-3毫升稀盐酸、NaCl溶液、Na2CO3溶液、自来水和蒸馏水。然后分别加入几滴AgNO3溶液,再加入稀硝酸。
实验现象:(见下表格)
加入AgNO3溶液后现象 加入稀硝酸后现象 解释或化学方程式
NaCl溶液 有白色沉淀生成 沉淀不溶解 NaCl+AgNO3=AgCl+NaNO3
Na2CO3溶液 有白色沉淀生成 沉淀溶解 Na2CO3++2AgNO3=Ag2CO3+ 2NaNO3
自来水 有白色沉淀生成 沉淀不溶解 Ag++Cl-=AgCl
稀盐酸 有白色沉淀生成 沉淀不溶解 HCl+AgNO3=AgCl+HNO3
蒸馏水 无现象 无现象 —————————————————
(2)检验Cl-的方法:可以先加入AgNO3溶液,后用硝酸酸化;也可以先加入硝酸酸化,再加入AgNO3溶液;还可以加入用硝酸酸化的硝酸银溶液。
二、氯气的实验室制法:
1、反应原理:MnO2+4HCl(浓)△MnCl2+Cl2↑+2H2O.
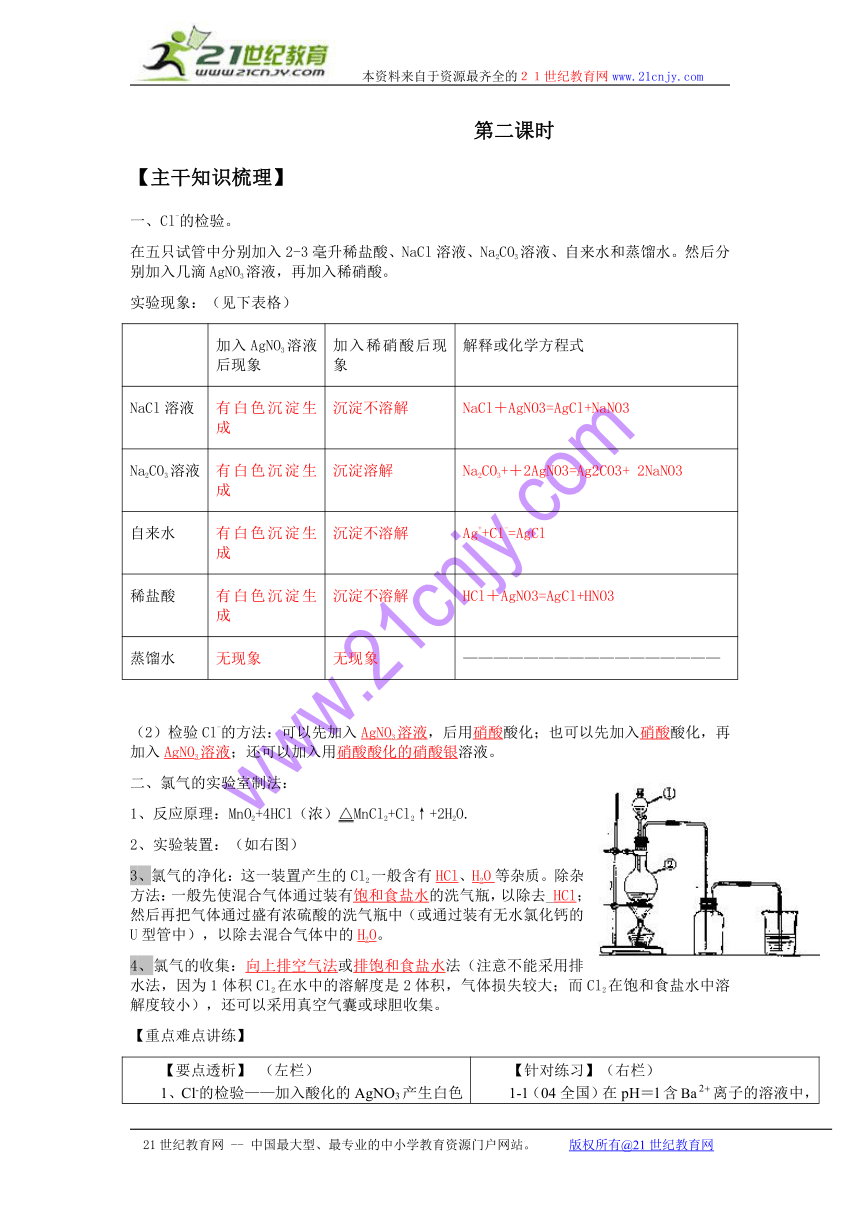
2、实验装置:(如右图)
3、氯气的净化:这一装置产生的Cl2一般含有HCl、H2O等杂质。除杂方法:一般先使混合气体通过装有饱和食盐水的洗气瓶,以除去_HCl;然后再把气体通过盛有浓硫酸的洗气瓶中(或通过装有无水氯化钙的U型管中),以除去混合气体中的H2O。
4、氯气的收集:向上排空气法或排饱和食盐水法(注意不能采用排水法,因为1体积Cl2在水中的溶解度是2体积,气体损失较大;而Cl2在饱和食盐水中溶解度较小),还可以采用真空气囊或球胆收集。
【重点难点讲练】
【要点透析】 (左栏) 1、Cl-的检验——加入酸化的AgNO3产生白色沉淀,从而可以鉴定Cl-的存在,酸化的目的可排除其他离子的干扰。【例1】在未知液中加入AgNO3溶液有白色沉淀生成,加入稀硝酸后,沉淀部分溶解,有无色无味的气体生成,将气体通人澄清石灰水,石灰水变浑浊,由此判断水溶液中含有( )A.Cl-,SO B.Cl-,NOC.Cl-,CO D.Cl-,OH-【解析】解析:由已知能使澄清石灰水变浑浊的无色无味气体应是CO2,又因为加入稀HNO3后沉淀部分溶解,故原溶液中除含有CO2外,还有Cl-。【答案】C小结:2、氯气的实验室制法——装置分析:“固体+液体→气体”类型。液体加入一般选择分液漏斗,有利于控制液体反应物的加入量,并保持漏斗中的反应物不外逸以污染环境;加热仪器一般采用圆底烧瓶,;采用酒精灯加热;生成的混合气体要经过洗气以除去气体杂质;尾气应经过处理以防止污染环境。【例2】将氯气用导管通入较浓的NaOH和H2O2的混合液中,在导管口与混合液的接触处有闪烁的红光出现。这是因为通气后混合液中产生的ClO-被H2O2还原,发生激烈反应,产生能量较高的氧分子,它立即转变为普通氧分子,将多余的能量以红光放出。进行此实验,所用的仪器及导管如图1—2—4。编号①②③④⑤⑥仪器及导管(一个)(一个)橡皮管图1—2—4根据要求填写下列空白:(1)组装氯气发生器时,应选用的仪器及导管(填写图中编号)是______。(2)实验进行中,按气流方向从左到右的顺序,气体流经的各仪器及导管的编号依次是______。(3)仪器①的橡皮塞上应有______个孔,原因是_______________________。(4)实验时,仪器①中除观察到红光外还有__________现象。(5)实验需用约10%H2O2溶液100mL,现用市售30%(密度近似为1 g/cm3)H2O2来配制,其具体配制方法是___________________________________________________________ ____________________。(6)实验时仪器①中ClO-与H2O2反应的离子方程式是________________________________________________。【解析】 本题是信息迁移式的综合实验题,其特点是将实验原理、反应、装置连接、装置细节、实验现象、操作,以及有关离子方程式等结合起来,问题虽很基本,但综合能力层次较高,本题难度适中。在中学化学教学中,氯气的实验室制法是固液加热的反应,因此组装发生器时应选②、③及导管。导管选④还是⑤要考虑整个实验,注意图中明确指出④和⑤都仅有一个,而在整个实验装置中,④要插入①,所以在组装发生器时只能选导管⑤。在回答问题(2)时不要忽略两个导管要用橡皮管连接,因此正确的回答是②⑤⑥④①。问题(3)要注意对于有气体参加或生成的反应的实验装置,一方面要考虑不漏气,检查气密性(包括气体的发生,直到气体参加化学反应之前的装置部分都不应漏气);另一方面也要考虑装置的最后(指气体发生化学反应之后的装置部分)要与大气相通,使多余的气体或反应产生的气体能排出(即放空),否则由于这些气体不能排出,使得装置内压力不断增大会发生爆炸。因此①中橡皮塞上应有2个(或2个以上)孔,以使瓶内外压强相等。由题可知,H2O2作还原剂时其氧化产物为O2。尽管高能的O2转变成普通O2,多余能量以光 (红色)形式放出,但O2还是气体,因而实验时仪器①中除观察到红光外还可观察到冒气泡的现象。问题(5)中溶液配制是中学化学实验中最基本操作之一。要注意题目要求具体配制方法,即要说清所取浓溶液的量,用什么量器量取,放入什么容器中,加入多少水稀释和搅拌均匀等配制的全过程。问题(6)Cl2+2NaOH====NaCl+NaClO+H2O该反应是中学生熟悉的,又由试题给的信息可知,H2O2与ClO-的反应中产物是O2,由此可推断出强碱介质中H2O2与ClO-反应,H2O2是还原剂,ClO-是氧化剂,其产物只能是Cl-。所以ClO-与H2O2反应的离子方程式是:ClO-+H2O2====Cl-+O2↑+H2O。【答案】 (1)③②⑤(2)②⑤⑥④①(3)2,使瓶内外压强相等(写出其他合理的与大气相通的方法,如多孔也算对)(4)冒气泡(5)用量筒取33 mL(或34 mL)30%H2O2溶液加入烧杯中,再加入67 mL(或66 mL)水(或加水稀释至100 mL),搅拌均匀(6)ClO-+H2O2====Cl-+O2↑+H2O小结:氯气的实验室制法注意事项①因浓盐酸有挥发性,制氯气装置应使用分液漏斗(仪器)并盖上玻璃塞。②滴加浓盐酸不能过快,加热方式为微热。③氯气中含有HCl、水气,先通过盛饱和食盐水的洗气瓶,再通过盛有浓硫酸的洗气瓶。④多余的氯气应使用NaOH溶液吸收,反应的离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O⑤为确保实验过程中分液漏斗里的液体顺利流下,可采取的方法有:一是把分液漏斗和圆底烧瓶用橡皮管相连通、二是在分液漏斗下端套一个小试管。 【针对练习】(右栏)1-1(04全国)在pH=l含离子的溶液中,还能大量存在的离子是( )A. B. C. D.1-2常温常压下,下列溶液中含有大量氯离子的是( )A.NaCl饱和溶液B.新制氯水C.AgCl饱和溶液D.KClO3溶液1-3(02上海)在氯氧化法处理含CN-的废水过程中,液氯在碱性条件下可以将氰化物氧化成氰酸盐(其毒性仅为氰化物的千分之一),氰酸盐进一步被氧化为无毒物质。(1)某厂废水中含KCN,其浓度为650mg / L。现用氯氧化法处理,发生如下反应(其中N均为-3价):KCN+2KOH+Cl2 → KOCN+2KCl+H2O被氧化的元素是 __________ 。(2)投入过量液氯,可将氰酸盐进一步氧化为氮气。请配平下列化学方程式,并标出电子转移方向和数目: KOCN+ KOH+ Cl2 → CO2 + N2 + KCl + H2O(3)若处理上述废水20L,使KCN完全转化为无毒物质,至少需液氯 g。2-1(05上海)以下各种尾气吸收装置中,适合于吸收易溶性气体,而且能防止倒吸的是( )2-2有人设计了以下六步操作制备氯气,其操作顺序为:_________①向分液漏斗中加入浓盐酸,并将导气管插入集气瓶②检查装置的气密性③把酒精灯放在铁架台上,根据酒精灯火焰确定铁圈高度,固定铁圈,放上石棉网④在烧瓶上装好分液漏斗,安装好导气管⑤向烧瓶中装入二氧化锰固体⑥将烧瓶固定在铁架台上 2-3 将0.15 mol的MnO2与过量的 12 mol/L的浓盐酸反应,和50 mL 12 mol/L的浓盐酸与足量的MnO2反应两者产生的Cl2相比(其他反应条件相同) ( ) A. 一样多 B.前者较后者多 C. 后者较前者多 D.无法比较2-4.(06沈阳市高三教学质量检测)将潮湿的Cl2通过甲装置后,再通过放有干燥红色布条的乙装置,红色布条不褪色。则甲装置中所盛试剂(足量)可能是(YCY) ①浓硫酸 ②NaOH溶液 ③KI溶液 ④饱和食盐水 A.①② B.②③ C.①②③ D.①②③④答案:C2-5.(06年吉林省实验中学二阶段测试)将Cl2通入70℃的NaOH溶液中,同时发生两个反应: ①NaOH+Cl2→NaClO+NaCl+H2O ②NaOH+Cl2→NaClO3+NaCl+H2O反应后,测得反应 ①和反应②的生成物中氧化产物的物质的量之比为4:1,则被氧化和被还原的氯元素的 物质的量之比是 ( ) A.5:9 B.4:9 C.5:2 D.11:2答案:A2-5.(06年浙江省一模)经常对环境进行消毒是预防禽流感传染的有效途径。某消毒液为无色液体,用红色石蕊试纸检验,发现试纸先变蓝后褪色。则该消毒液的主要成分可能是:A.KMnO B.HOC.NaClO D.Cl答案:C2-6. 现用浓盐酸、MnO2共热制Cl2,并用Cl2和Ca(OH)2反应制少量漂白粉,现已知反应2Cl2+2Ca(OH)2=Ca(ClO)2+CaCl2+2H2O+Q温度稍高即发生副反应6Cl2+6Ca(OH)2=CaCl2+Ca(ClO3)2+6H2O。甲、乙、丙三人分别设计三个实验装置,如下图所示:(1)请指出三个装置的各自的缺点或错误(如没有可不填)甲__________,乙__________,丙__________。(2)下图中甲由A、B两部分组成,乙由C、D、E三部分组成,丙由F、G组成,从上述甲、乙、丙三套装置中选出合理的部分(按气流从左到右的方向)组装一套较完善的实验装置(填所选部分的编号) ____________________.(3)实验中若用12mol· L-1的浓盐酸100mL与足量的MnO2反应,最终生成Ca(ClO)2的物质的量总是小于0.15mol,其可能的主要原因是______________________________.(假定各步反应无反应物损耗且无副反应发生)。答案:(1)甲:①发生装置错误,②U型管右端没有接尾气处理装置。乙:①没有降温装置,②D应换成U型管,改装消石灰。丙:①没有降温装置,②没有尾气处理装置。 (2)C(F)、B、E (3)MnO2只能氧化浓HCl,随着反应的进行,c(Cl-)减小,还原性减弱,反应不能继续进行。
【课时同步练习】
【基础达标】
1.以下说法中错误的是( )
A.Cl-已达到8电子稳定结构,Cl-显电性
B.Cl不显电性,性质很稳定
C.氯原子和氯离子由于最外层电子数不同所以性质也不同
D.氯原子和氯离子的性质相同,因为它们的质子数相同
2.室验室制取的氯气中混有氧化氢,除去氯化氢气体最好采用的物质是( )
A.水 B.NaOH溶液 C.饱和食盐水 D.氨水
3.新制氯水中存在的微粒是( )
A.Cl2、HClO
B.Cl、Cl-、Cl2
C.Cl2 Cl- H+ ClO- H2O和极少量OH-
D.Cl2 Cl- H+ HClO ClO- H2O和极少量OH-
4.往某溶液中通入过量氯气,再滴入Ba(NO3)2和HNO3溶液后,溶液中有白色沉淀,原溶液可能是( )
A.AgNO3 B.Na2SO3 C.Na2CO3 D.CaCl2
5.实验室用下列两种方法制氯气:①用含HCl 146g的浓盐酸与足量的MnO2反应;②用87gMnO2与足量浓盐酸反应。所得的氯气( )
A.①比②多 B.②比①多 C.一样多 D.无法比较
6.在3Cl2+6KOHKClO3+5KCl+3H2O中,下列说法不正确的是( )
①Cl2是氧化剂,KOH是还原剂②KCl是还原产物,KClO3是氧化产物③反应中每3个Cl2分子中有5个电子转移④被氧化的氯原子是被还原氯原子物质的量的5倍⑤被还原的氯原子的物质的量是被氧化的氯原子的物质的量的5倍。
A.①④ B.③④ C.①⑤ D. ②③
7.在密闭容器中,盛有H2、O2、Cl2的混合气体,通过电火花点燃,三种气体正好完成反应,冷至室温后,所得盐酸的质量分数为25.26%,则容器中原有H2、O2、Cl2的物质的量之比是( )
A.6:3:1 B.9:4:1 C.13:6:1 D.10:6:1
8.已知下列氧化还原反应:
2BrO3-+Cl2Br2+2ClO3-
5Cl2+I2+6H2O2IO3-+10Cl-+12H+
ClO3-+5Cl-+6H+3Cl2+3H2O
上述条件下,各微粒氧化性由强到弱的排列顺序正确的是( )
A.ClO3->BrO3->I03->Cl2
B.BrO3->Cl2>ClO3->IO3-
C.BrO3->ClO3->Cl2>IO3-
D.Cl2>BrO3->ClO3->IO3-
9、下图是实验室制取纯净干燥氯气的装置
(1)图中有 处错误,分别为A B
C D E
(2)分液漏斗中应加入(填代号)
A.稀HNO3 B.H2O C.浓HCl D.稀HCl
圆底烧瓶中应加入(填代号)
A.浓H2SO4 B.MnO2固体 C.KmnO4固体
(3)写出制气装置中浓HCl与MnO2反应的方程式
(4)用双线桥标出(3)中反应的电子转移情况
(5)标准状态下若有VLCl2生成,则被氧化的nHCl mol
[能力提升]
1、实验室制取氯气可以有以下途径,用化学方程式表示如下。若制取等质量的氯气,消耗盐酸最少的是( )
A.8HCl+K2Cr2O72KCl+Cr2O3+4H2O+3Cl2↑
B.16HCl+2KMnO42MnCl2+8H2O+2KCl+5Cl2↑
C.4HCl+MnO2MnCl2+2H2O+Cl2↑ D.6HCl+KClO3KCl+3H2O+3Cl2↑
2、在含有NaCl、NaBr、NaI混合溶液中滴加足量的溴水,经充分反应后,将溶液蒸干并灼烧,残渣固体为:
A、NaCl、I2 B、NaBr、NaCl和Br2 C、NaBr、NaCl和I2 D、NaCl、NaBr
3、砹是原子序数最大的卤族元素,推测砹或砹的化合物最不可能具有的性质是
①砹化氢很稳定 ②砹单质与水反应,使砹全部转化成氢砹酸和次砹酸 ③砹化合物的熔点较高 ④砹是黑色固体 ⑤砹化银难溶于水 ⑥砹易溶于某些有机溶剂
A、只有 ①② B、只有①③④ C、只有③④⑤⑥ D、只有②④⑥
4、取碘水四份于试管中,编号为Ⅰ、Ⅱ、Ⅲ、Ⅳ,分别加入汽油、CCl4、酒精、NaCl溶液,振荡后静置,现象正确的是
A、Ⅰ中溶液分层,上层无色 B、II中溶液分层,下层紫红色
C、Ⅲ中溶液分层,下层呈棕色 D、Ⅳ中溶液不分层,溶液由棕色变成黄绿色
5、氯化碘(ICl)的化学性质跟氯气相似,预计它跟水反应的最初生成物是
A、HI和HClO B、HCl和HIO C、HClO3和HIO D、HClO和HIO
6、(2004年北京西城区模拟题)某炼金厂的废水因连降暴雨而溢出,导致河水严重污染。炼金废水中所含CN-有剧毒,其性质与卤素离子相似,还原性介于I-与Br-之间,HCN为弱酸。下列说法不正确的是
A.CN-可以和稀硫酸反应生成HCN B.CN-可被Cl2氧化成(CN)2
C.在水溶液中(CN)2可被F-还原 D.HCN的电子式为
7、ClO2是一种消毒杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制得ClO2: 2KClO3+H2C2O4+H2SO42ClO2↑+K2SO4+2CO2↑+2H2O,下列说法正确的是
A、KClO3在反应中得到电子 B、ClO2是氧化产物
C、H2C2O4在反应中被氧化 D、1 molKClO3参加反应有2mol电子转移
8、使相同摩尔浓度的NaCl、MgCl2、AlCl3溶液中的Cl-离子完全沉淀时,若所用相同浓度的AgNO3溶液的体积比为3:2:1,则上述三种溶液的体积比是
A、9:4:1 B、3:2:1 C、6:3:2 D、9:3:1
A.①③ B.③⑥ C.②④⑥ D.①②④⑤⑦
9.根据右图的实验,填空和回答问题:
(1)烧瓶中所发生的主要反应的化学方程式是
装置(B)的烧杯中冷水所起的作用是
装置(C)的烧杯中冷水所起的作用是
(2)进行此实验时,烧瓶内的橡皮塞最好用锡箔包住,用橡皮管连接的两玻璃管口要相互靠紧,这是因为
(3)装置(C)的烧杯中使用倒置漏斗可防止液体倒吸,试简述其原因 。
10.甲、乙、丙、丁分别是盐酸、碳酸钠、氯化钙、硝酸银4种溶液中的一种。将它们两两混合后,观察到的现象如表所示,其中丁与乙混合产生的是无色气体。
甲 乙 丙 丁
甲 ―― ↓ ↓
乙 ↓ ―― ↓ ↑
丙 ↓ ↓ ―― ↓
丁 ↑ ↓ ――
请回答下面的问题:
(1)写出丁与乙反应的离子方程式:________________________________________。
(2)这四种溶液分别是:甲:_________、乙:_________、丙:_________、丁:_________(用溶质的化学式表示)。
第二课时针对练习1-1C1-2A1-3(1)碳或(C)
(3) 35.5
2-1BD2-2④②③⑥⑤①
2-3B
基础达标:1、BD2、C3、D4、B5、B6、A7、C8、C
9、(1)5,未使用酒精灯,未使用石棉网,A、B试剂瓶中导管方向错误,A、B位置颠倒,D中试剂错误。(2)C,B(3)MnO2+4HCl(浓)△MnCl2+Cl2↑+2H2O(4)略
(5)V/11、2
能力提升:1、D2、D3、A4、B5、B6、C
7、AC8、D9、(1)NaBr+H2SO4(浓) NaHSO4+HBr↑ MnO2+4HBrMnBr2+Br2↑+2H2O,冷凝,吸收未冷凝的气体 (2)溴蒸气会腐蚀橡皮管 (3)当气体被吸收时,液体上升到漏斗中,由于漏斗的容积大,导致烧杯中液面下降,使漏斗口脱离液面,漏斗中液体又流回烧杯内,从而防止了倒吸。
10、(1)2H++=H2O+CO2↑ (2)CaCl2、Na2CO3、AgNO3、HCl
第三节第一课时:针对练习:1-1D1-2A2-1B2-2C3-1 A 3-2(1)2Na2O2+2SO2=2Na2SO3+O2
(2)取白色固体,加稀硫酸,产生能使晶红溶液褪色的气体。
(3)不合理 稀硝酸能将亚硫酸钡氧化为硫酸钡
基础达标:1、C2、D3、C4、B5、C6、C7、AC8、A
9、①Hg+SHgS②下10、(1)①2H2SO3+O22H2SO4②小(2)C
(3)不可取。因SO2的排放总量没有减少,所以进一步形成的酸雨仍会造成对全球的危害。
能力提升:1、B。
2.C
3、B
4、D
5.B 6.A 7.D
8.(1)H2S+Cl2 S+2HCl
(2)2Na+H2S Na2S+H2↑
(3)SO2+Br2+2H2OH? 2SO4+2HBr
(4)2H2S+SO2 3S+2H2O
(5)H2SH? H2+S
(6)SO2+2NaOH Na2SO3+H2O
9.(1)Cl2、SO2、H2S
(2)Cl2+SO2+2H2O H2SO4+2HCl SO2
(3)溶液由黄色变成浅绿色
SO2+2FeCl3+2H2O H2SO4+2FeCl2+2HCl
(4)H2S+Br2 2HBr+S↓Br2
21世纪教育网 -- 中国最大型、最专业的中小学教育资源门户网站。 版权所有@21世纪教育网
第二课时
【主干知识梳理】
一、Cl-的检验。
在五只试管中分别加入2-3毫升稀盐酸、NaCl溶液、Na2CO3溶液、自来水和蒸馏水。然后分别加入几滴AgNO3溶液,再加入稀硝酸。
实验现象:(见下表格)
加入AgNO3溶液后现象 加入稀硝酸后现象 解释或化学方程式
NaCl溶液 有白色沉淀生成 沉淀不溶解 NaCl+AgNO3=AgCl+NaNO3
Na2CO3溶液 有白色沉淀生成 沉淀溶解 Na2CO3++2AgNO3=Ag2CO3+ 2NaNO3
自来水 有白色沉淀生成 沉淀不溶解 Ag++Cl-=AgCl
稀盐酸 有白色沉淀生成 沉淀不溶解 HCl+AgNO3=AgCl+HNO3
蒸馏水 无现象 无现象 —————————————————
(2)检验Cl-的方法:可以先加入AgNO3溶液,后用硝酸酸化;也可以先加入硝酸酸化,再加入AgNO3溶液;还可以加入用硝酸酸化的硝酸银溶液。
二、氯气的实验室制法:
1、反应原理:MnO2+4HCl(浓)△MnCl2+Cl2↑+2H2O.
2、实验装置:(如右图)
3、氯气的净化:这一装置产生的Cl2一般含有HCl、H2O等杂质。除杂方法:一般先使混合气体通过装有饱和食盐水的洗气瓶,以除去_HCl;然后再把气体通过盛有浓硫酸的洗气瓶中(或通过装有无水氯化钙的U型管中),以除去混合气体中的H2O。
4、氯气的收集:向上排空气法或排饱和食盐水法(注意不能采用排水法,因为1体积Cl2在水中的溶解度是2体积,气体损失较大;而Cl2在饱和食盐水中溶解度较小),还可以采用真空气囊或球胆收集。
【重点难点讲练】
【要点透析】 (左栏) 1、Cl-的检验——加入酸化的AgNO3产生白色沉淀,从而可以鉴定Cl-的存在,酸化的目的可排除其他离子的干扰。【例1】在未知液中加入AgNO3溶液有白色沉淀生成,加入稀硝酸后,沉淀部分溶解,有无色无味的气体生成,将气体通人澄清石灰水,石灰水变浑浊,由此判断水溶液中含有( )A.Cl-,SO B.Cl-,NOC.Cl-,CO D.Cl-,OH-【解析】解析:由已知能使澄清石灰水变浑浊的无色无味气体应是CO2,又因为加入稀HNO3后沉淀部分溶解,故原溶液中除含有CO2外,还有Cl-。【答案】C小结:2、氯气的实验室制法——装置分析:“固体+液体→气体”类型。液体加入一般选择分液漏斗,有利于控制液体反应物的加入量,并保持漏斗中的反应物不外逸以污染环境;加热仪器一般采用圆底烧瓶,;采用酒精灯加热;生成的混合气体要经过洗气以除去气体杂质;尾气应经过处理以防止污染环境。【例2】将氯气用导管通入较浓的NaOH和H2O2的混合液中,在导管口与混合液的接触处有闪烁的红光出现。这是因为通气后混合液中产生的ClO-被H2O2还原,发生激烈反应,产生能量较高的氧分子,它立即转变为普通氧分子,将多余的能量以红光放出。进行此实验,所用的仪器及导管如图1—2—4。编号①②③④⑤⑥仪器及导管(一个)(一个)橡皮管图1—2—4根据要求填写下列空白:(1)组装氯气发生器时,应选用的仪器及导管(填写图中编号)是______。(2)实验进行中,按气流方向从左到右的顺序,气体流经的各仪器及导管的编号依次是______。(3)仪器①的橡皮塞上应有______个孔,原因是_______________________。(4)实验时,仪器①中除观察到红光外还有__________现象。(5)实验需用约10%H2O2溶液100mL,现用市售30%(密度近似为1 g/cm3)H2O2来配制,其具体配制方法是___________________________________________________________ ____________________。(6)实验时仪器①中ClO-与H2O2反应的离子方程式是________________________________________________。【解析】 本题是信息迁移式的综合实验题,其特点是将实验原理、反应、装置连接、装置细节、实验现象、操作,以及有关离子方程式等结合起来,问题虽很基本,但综合能力层次较高,本题难度适中。在中学化学教学中,氯气的实验室制法是固液加热的反应,因此组装发生器时应选②、③及导管。导管选④还是⑤要考虑整个实验,注意图中明确指出④和⑤都仅有一个,而在整个实验装置中,④要插入①,所以在组装发生器时只能选导管⑤。在回答问题(2)时不要忽略两个导管要用橡皮管连接,因此正确的回答是②⑤⑥④①。问题(3)要注意对于有气体参加或生成的反应的实验装置,一方面要考虑不漏气,检查气密性(包括气体的发生,直到气体参加化学反应之前的装置部分都不应漏气);另一方面也要考虑装置的最后(指气体发生化学反应之后的装置部分)要与大气相通,使多余的气体或反应产生的气体能排出(即放空),否则由于这些气体不能排出,使得装置内压力不断增大会发生爆炸。因此①中橡皮塞上应有2个(或2个以上)孔,以使瓶内外压强相等。由题可知,H2O2作还原剂时其氧化产物为O2。尽管高能的O2转变成普通O2,多余能量以光 (红色)形式放出,但O2还是气体,因而实验时仪器①中除观察到红光外还可观察到冒气泡的现象。问题(5)中溶液配制是中学化学实验中最基本操作之一。要注意题目要求具体配制方法,即要说清所取浓溶液的量,用什么量器量取,放入什么容器中,加入多少水稀释和搅拌均匀等配制的全过程。问题(6)Cl2+2NaOH====NaCl+NaClO+H2O该反应是中学生熟悉的,又由试题给的信息可知,H2O2与ClO-的反应中产物是O2,由此可推断出强碱介质中H2O2与ClO-反应,H2O2是还原剂,ClO-是氧化剂,其产物只能是Cl-。所以ClO-与H2O2反应的离子方程式是:ClO-+H2O2====Cl-+O2↑+H2O。【答案】 (1)③②⑤(2)②⑤⑥④①(3)2,使瓶内外压强相等(写出其他合理的与大气相通的方法,如多孔也算对)(4)冒气泡(5)用量筒取33 mL(或34 mL)30%H2O2溶液加入烧杯中,再加入67 mL(或66 mL)水(或加水稀释至100 mL),搅拌均匀(6)ClO-+H2O2====Cl-+O2↑+H2O小结:氯气的实验室制法注意事项①因浓盐酸有挥发性,制氯气装置应使用分液漏斗(仪器)并盖上玻璃塞。②滴加浓盐酸不能过快,加热方式为微热。③氯气中含有HCl、水气,先通过盛饱和食盐水的洗气瓶,再通过盛有浓硫酸的洗气瓶。④多余的氯气应使用NaOH溶液吸收,反应的离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O⑤为确保实验过程中分液漏斗里的液体顺利流下,可采取的方法有:一是把分液漏斗和圆底烧瓶用橡皮管相连通、二是在分液漏斗下端套一个小试管。 【针对练习】(右栏)1-1(04全国)在pH=l含离子的溶液中,还能大量存在的离子是( )A. B. C. D.1-2常温常压下,下列溶液中含有大量氯离子的是( )A.NaCl饱和溶液B.新制氯水C.AgCl饱和溶液D.KClO3溶液1-3(02上海)在氯氧化法处理含CN-的废水过程中,液氯在碱性条件下可以将氰化物氧化成氰酸盐(其毒性仅为氰化物的千分之一),氰酸盐进一步被氧化为无毒物质。(1)某厂废水中含KCN,其浓度为650mg / L。现用氯氧化法处理,发生如下反应(其中N均为-3价):KCN+2KOH+Cl2 → KOCN+2KCl+H2O被氧化的元素是 __________ 。(2)投入过量液氯,可将氰酸盐进一步氧化为氮气。请配平下列化学方程式,并标出电子转移方向和数目: KOCN+ KOH+ Cl2 → CO2 + N2 + KCl + H2O(3)若处理上述废水20L,使KCN完全转化为无毒物质,至少需液氯 g。2-1(05上海)以下各种尾气吸收装置中,适合于吸收易溶性气体,而且能防止倒吸的是( )2-2有人设计了以下六步操作制备氯气,其操作顺序为:_________①向分液漏斗中加入浓盐酸,并将导气管插入集气瓶②检查装置的气密性③把酒精灯放在铁架台上,根据酒精灯火焰确定铁圈高度,固定铁圈,放上石棉网④在烧瓶上装好分液漏斗,安装好导气管⑤向烧瓶中装入二氧化锰固体⑥将烧瓶固定在铁架台上 2-3 将0.15 mol的MnO2与过量的 12 mol/L的浓盐酸反应,和50 mL 12 mol/L的浓盐酸与足量的MnO2反应两者产生的Cl2相比(其他反应条件相同) ( ) A. 一样多 B.前者较后者多 C. 后者较前者多 D.无法比较2-4.(06沈阳市高三教学质量检测)将潮湿的Cl2通过甲装置后,再通过放有干燥红色布条的乙装置,红色布条不褪色。则甲装置中所盛试剂(足量)可能是(YCY) ①浓硫酸 ②NaOH溶液 ③KI溶液 ④饱和食盐水 A.①② B.②③ C.①②③ D.①②③④答案:C2-5.(06年吉林省实验中学二阶段测试)将Cl2通入70℃的NaOH溶液中,同时发生两个反应: ①NaOH+Cl2→NaClO+NaCl+H2O ②NaOH+Cl2→NaClO3+NaCl+H2O反应后,测得反应 ①和反应②的生成物中氧化产物的物质的量之比为4:1,则被氧化和被还原的氯元素的 物质的量之比是 ( ) A.5:9 B.4:9 C.5:2 D.11:2答案:A2-5.(06年浙江省一模)经常对环境进行消毒是预防禽流感传染的有效途径。某消毒液为无色液体,用红色石蕊试纸检验,发现试纸先变蓝后褪色。则该消毒液的主要成分可能是:A.KMnO B.HOC.NaClO D.Cl答案:C2-6. 现用浓盐酸、MnO2共热制Cl2,并用Cl2和Ca(OH)2反应制少量漂白粉,现已知反应2Cl2+2Ca(OH)2=Ca(ClO)2+CaCl2+2H2O+Q温度稍高即发生副反应6Cl2+6Ca(OH)2=CaCl2+Ca(ClO3)2+6H2O。甲、乙、丙三人分别设计三个实验装置,如下图所示:(1)请指出三个装置的各自的缺点或错误(如没有可不填)甲__________,乙__________,丙__________。(2)下图中甲由A、B两部分组成,乙由C、D、E三部分组成,丙由F、G组成,从上述甲、乙、丙三套装置中选出合理的部分(按气流从左到右的方向)组装一套较完善的实验装置(填所选部分的编号) ____________________.(3)实验中若用12mol· L-1的浓盐酸100mL与足量的MnO2反应,最终生成Ca(ClO)2的物质的量总是小于0.15mol,其可能的主要原因是______________________________.(假定各步反应无反应物损耗且无副反应发生)。答案:(1)甲:①发生装置错误,②U型管右端没有接尾气处理装置。乙:①没有降温装置,②D应换成U型管,改装消石灰。丙:①没有降温装置,②没有尾气处理装置。 (2)C(F)、B、E (3)MnO2只能氧化浓HCl,随着反应的进行,c(Cl-)减小,还原性减弱,反应不能继续进行。
【课时同步练习】
【基础达标】
1.以下说法中错误的是( )
A.Cl-已达到8电子稳定结构,Cl-显电性
B.Cl不显电性,性质很稳定
C.氯原子和氯离子由于最外层电子数不同所以性质也不同
D.氯原子和氯离子的性质相同,因为它们的质子数相同
2.室验室制取的氯气中混有氧化氢,除去氯化氢气体最好采用的物质是( )
A.水 B.NaOH溶液 C.饱和食盐水 D.氨水
3.新制氯水中存在的微粒是( )
A.Cl2、HClO
B.Cl、Cl-、Cl2
C.Cl2 Cl- H+ ClO- H2O和极少量OH-
D.Cl2 Cl- H+ HClO ClO- H2O和极少量OH-
4.往某溶液中通入过量氯气,再滴入Ba(NO3)2和HNO3溶液后,溶液中有白色沉淀,原溶液可能是( )
A.AgNO3 B.Na2SO3 C.Na2CO3 D.CaCl2
5.实验室用下列两种方法制氯气:①用含HCl 146g的浓盐酸与足量的MnO2反应;②用87gMnO2与足量浓盐酸反应。所得的氯气( )
A.①比②多 B.②比①多 C.一样多 D.无法比较
6.在3Cl2+6KOHKClO3+5KCl+3H2O中,下列说法不正确的是( )
①Cl2是氧化剂,KOH是还原剂②KCl是还原产物,KClO3是氧化产物③反应中每3个Cl2分子中有5个电子转移④被氧化的氯原子是被还原氯原子物质的量的5倍⑤被还原的氯原子的物质的量是被氧化的氯原子的物质的量的5倍。
A.①④ B.③④ C.①⑤ D. ②③
7.在密闭容器中,盛有H2、O2、Cl2的混合气体,通过电火花点燃,三种气体正好完成反应,冷至室温后,所得盐酸的质量分数为25.26%,则容器中原有H2、O2、Cl2的物质的量之比是( )
A.6:3:1 B.9:4:1 C.13:6:1 D.10:6:1
8.已知下列氧化还原反应:
2BrO3-+Cl2Br2+2ClO3-
5Cl2+I2+6H2O2IO3-+10Cl-+12H+
ClO3-+5Cl-+6H+3Cl2+3H2O
上述条件下,各微粒氧化性由强到弱的排列顺序正确的是( )
A.ClO3->BrO3->I03->Cl2
B.BrO3->Cl2>ClO3->IO3-
C.BrO3->ClO3->Cl2>IO3-
D.Cl2>BrO3->ClO3->IO3-
9、下图是实验室制取纯净干燥氯气的装置
(1)图中有 处错误,分别为A B
C D E
(2)分液漏斗中应加入(填代号)
A.稀HNO3 B.H2O C.浓HCl D.稀HCl
圆底烧瓶中应加入(填代号)
A.浓H2SO4 B.MnO2固体 C.KmnO4固体
(3)写出制气装置中浓HCl与MnO2反应的方程式
(4)用双线桥标出(3)中反应的电子转移情况
(5)标准状态下若有VLCl2生成,则被氧化的nHCl mol
[能力提升]
1、实验室制取氯气可以有以下途径,用化学方程式表示如下。若制取等质量的氯气,消耗盐酸最少的是( )
A.8HCl+K2Cr2O72KCl+Cr2O3+4H2O+3Cl2↑
B.16HCl+2KMnO42MnCl2+8H2O+2KCl+5Cl2↑
C.4HCl+MnO2MnCl2+2H2O+Cl2↑ D.6HCl+KClO3KCl+3H2O+3Cl2↑
2、在含有NaCl、NaBr、NaI混合溶液中滴加足量的溴水,经充分反应后,将溶液蒸干并灼烧,残渣固体为:
A、NaCl、I2 B、NaBr、NaCl和Br2 C、NaBr、NaCl和I2 D、NaCl、NaBr
3、砹是原子序数最大的卤族元素,推测砹或砹的化合物最不可能具有的性质是
①砹化氢很稳定 ②砹单质与水反应,使砹全部转化成氢砹酸和次砹酸 ③砹化合物的熔点较高 ④砹是黑色固体 ⑤砹化银难溶于水 ⑥砹易溶于某些有机溶剂
A、只有 ①② B、只有①③④ C、只有③④⑤⑥ D、只有②④⑥
4、取碘水四份于试管中,编号为Ⅰ、Ⅱ、Ⅲ、Ⅳ,分别加入汽油、CCl4、酒精、NaCl溶液,振荡后静置,现象正确的是
A、Ⅰ中溶液分层,上层无色 B、II中溶液分层,下层紫红色
C、Ⅲ中溶液分层,下层呈棕色 D、Ⅳ中溶液不分层,溶液由棕色变成黄绿色
5、氯化碘(ICl)的化学性质跟氯气相似,预计它跟水反应的最初生成物是
A、HI和HClO B、HCl和HIO C、HClO3和HIO D、HClO和HIO
6、(2004年北京西城区模拟题)某炼金厂的废水因连降暴雨而溢出,导致河水严重污染。炼金废水中所含CN-有剧毒,其性质与卤素离子相似,还原性介于I-与Br-之间,HCN为弱酸。下列说法不正确的是
A.CN-可以和稀硫酸反应生成HCN B.CN-可被Cl2氧化成(CN)2
C.在水溶液中(CN)2可被F-还原 D.HCN的电子式为
7、ClO2是一种消毒杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制得ClO2: 2KClO3+H2C2O4+H2SO42ClO2↑+K2SO4+2CO2↑+2H2O,下列说法正确的是
A、KClO3在反应中得到电子 B、ClO2是氧化产物
C、H2C2O4在反应中被氧化 D、1 molKClO3参加反应有2mol电子转移
8、使相同摩尔浓度的NaCl、MgCl2、AlCl3溶液中的Cl-离子完全沉淀时,若所用相同浓度的AgNO3溶液的体积比为3:2:1,则上述三种溶液的体积比是
A、9:4:1 B、3:2:1 C、6:3:2 D、9:3:1
A.①③ B.③⑥ C.②④⑥ D.①②④⑤⑦
9.根据右图的实验,填空和回答问题:
(1)烧瓶中所发生的主要反应的化学方程式是
装置(B)的烧杯中冷水所起的作用是
装置(C)的烧杯中冷水所起的作用是
(2)进行此实验时,烧瓶内的橡皮塞最好用锡箔包住,用橡皮管连接的两玻璃管口要相互靠紧,这是因为
(3)装置(C)的烧杯中使用倒置漏斗可防止液体倒吸,试简述其原因 。
10.甲、乙、丙、丁分别是盐酸、碳酸钠、氯化钙、硝酸银4种溶液中的一种。将它们两两混合后,观察到的现象如表所示,其中丁与乙混合产生的是无色气体。
甲 乙 丙 丁
甲 ―― ↓ ↓
乙 ↓ ―― ↓ ↑
丙 ↓ ↓ ―― ↓
丁 ↑ ↓ ――
请回答下面的问题:
(1)写出丁与乙反应的离子方程式:________________________________________。
(2)这四种溶液分别是:甲:_________、乙:_________、丙:_________、丁:_________(用溶质的化学式表示)。
第二课时针对练习1-1C1-2A1-3(1)碳或(C)
(3) 35.5
2-1BD2-2④②③⑥⑤①
2-3B
基础达标:1、BD2、C3、D4、B5、B6、A7、C8、C
9、(1)5,未使用酒精灯,未使用石棉网,A、B试剂瓶中导管方向错误,A、B位置颠倒,D中试剂错误。(2)C,B(3)MnO2+4HCl(浓)△MnCl2+Cl2↑+2H2O(4)略
(5)V/11、2
能力提升:1、D2、D3、A4、B5、B6、C
7、AC8、D9、(1)NaBr+H2SO4(浓) NaHSO4+HBr↑ MnO2+4HBrMnBr2+Br2↑+2H2O,冷凝,吸收未冷凝的气体 (2)溴蒸气会腐蚀橡皮管 (3)当气体被吸收时,液体上升到漏斗中,由于漏斗的容积大,导致烧杯中液面下降,使漏斗口脱离液面,漏斗中液体又流回烧杯内,从而防止了倒吸。
10、(1)2H++=H2O+CO2↑ (2)CaCl2、Na2CO3、AgNO3、HCl
第三节第一课时:针对练习:1-1D1-2A2-1B2-2C3-1 A 3-2(1)2Na2O2+2SO2=2Na2SO3+O2
(2)取白色固体,加稀硫酸,产生能使晶红溶液褪色的气体。
(3)不合理 稀硝酸能将亚硫酸钡氧化为硫酸钡
基础达标:1、C2、D3、C4、B5、C6、C7、AC8、A
9、①Hg+SHgS②下10、(1)①2H2SO3+O22H2SO4②小(2)C
(3)不可取。因SO2的排放总量没有减少,所以进一步形成的酸雨仍会造成对全球的危害。
能力提升:1、B。
2.C
3、B
4、D
5.B 6.A 7.D
8.(1)H2S+Cl2 S+2HCl
(2)2Na+H2S Na2S+H2↑
(3)SO2+Br2+2H2OH? 2SO4+2HBr
(4)2H2S+SO2 3S+2H2O
(5)H2SH? H2+S
(6)SO2+2NaOH Na2SO3+H2O
9.(1)Cl2、SO2、H2S
(2)Cl2+SO2+2H2O H2SO4+2HCl SO2
(3)溶液由黄色变成浅绿色
SO2+2FeCl3+2H2O H2SO4+2FeCl2+2HCl
(4)H2S+Br2 2HBr+S↓Br2
21世纪教育网 -- 中国最大型、最专业的中小学教育资源门户网站。 版权所有@21世纪教育网
