铁、铜及其化合物的应用(二)
图片预览






文档简介
课件15张PPT。知识要点通过生产、生活中
应用实例和实验探究了解
铁、铜、Fe2+、Fe3+
的性质了解
Fe2+、Fe3+
的相互转化,
及其几种检
验方法了解铁铜及
其化合物的
重要应用
并巩固氧化
还原反应铁和铜的应用和物理性质炊具;导线;建材;
生活工具;制具特
性的铁合金等广泛用于电气工业;
制铜合金;各种仪
表的零件等
1.银白色,有金属光泽;2.是电和热的良导体;3.具有良好的延展性;1.纯铜呈紫红色;2.是电和热的良导体;3.具有良好的延展性。4.合金的优良性4.合金的优良性。交流与讨论1.铁与盐酸反应 ;
2.铁在氯气中燃烧 ;
3.铁与硫酸铜溶液反应 ;
4.铜与硝酸银溶液反应 ;
5. ;
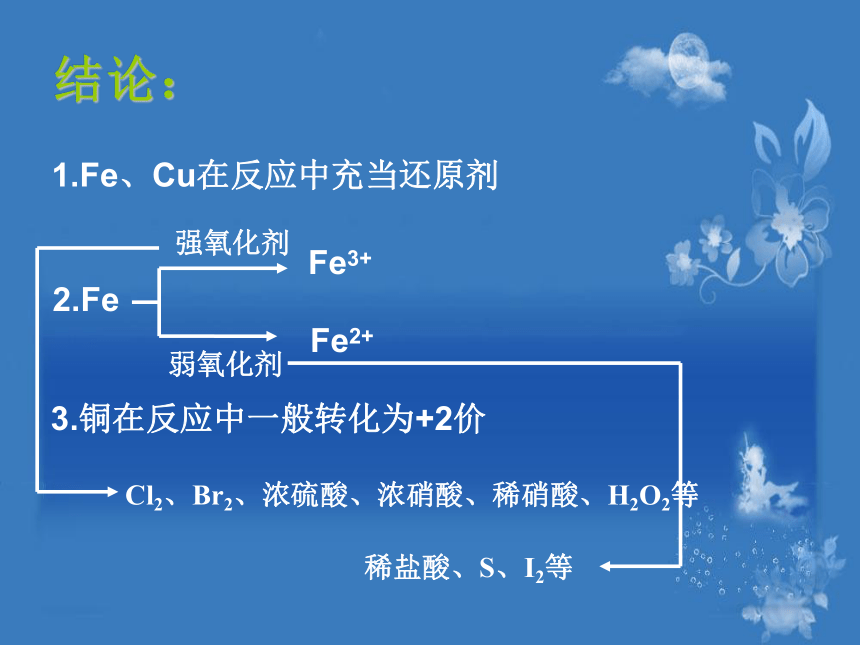
6. ;结论:1.Fe、Cu在反应中充当还原剂
2.FeFe3+Fe2+强氧化剂弱氧化剂3.铜在反应中一般转化为+2价Cl2、Br2、浓硫酸、浓硝酸、稀硝酸、H2O2等稀盐酸、S、I2等信息提示
Fe3+的检验Fe3+ + 3SCN- = Fe(SCN)3血红色可溶实验:Fe3+Fe2+KSCN血红色不变色例:如何判断FeCl2溶液中是否有部分Fe2+
被氧化成Fe3+?鉴别方法Fe2+Fe3+与KSCN显色
反应浅绿色黄色与OH-反应直接观色不显红色血红色白色沉淀迅速变
灰绿最后呈红
褐色立即产生红
褐色沉淀Fe2+与Fe3+的鉴别如何防止FeCl2溶液的Fe2+ 被氧化成Fe3+?Fe2+→Fe3+:
Fe3+→Fe2+:
Fe3+→Fe2+:加入铁、铜、S2-、I-等Fe2+→Fe3+:加入Cl2、酸性KMnO4、
H2O2、浓H2SO4、稀HNO3
加入氧化剂加入还原剂取两只试管,各加入1mL
0.1mol·L-1的FeCl2溶液,向其
中一支试管中加入3滴KSCN
溶液,向另一支试管中,先加入几滴新制的氯水,振荡试管,再向试管中加入三滴KSCN溶液。取两只试管,各加入1mL
0.1mol·L-1的FeCl3溶液,向其
中一支试管中加入3滴KSCN
溶液,向另一支试管中,先加入少量铁粉,振荡试管,静置再向试管中加入三滴KSCN溶液。前一支试管中溶液不变色后一支试管中溶液变成血红色前一支试管中溶液变成血红色后一支试管中溶液不变色印刷电路板中的反应原理:2Fe 3+ + Cu == 2Fe2+ + Cu2+铁三角FeFe(II)Fe(III)
S 、I2、Cu2+ H+等H2、CO、C、Zn等Cl2、Br2、HNO3
H2SO4(浓)等H2、CO、C、Al等Cl2、Br2、HNO3 、H2O2 、O2 H2SO4(浓)、KMnO4Fe、Cu、H2S、S2-
I-等小试牛刀 能与Fe3+反应且能证明Fe3+具有氧化性的物质是:( )
①KSCN②Fe③FeCl2④NaCl
A.④ B. ① C.③ D. ②D证明某溶液只含有Fe2+而不含Fe3+的实验方法是( )
A、先滴加氯水,再滴加KSCN溶液后显红色
B、先滴加KSCN溶液,不显红色,再滴加氯水后显红色
C、滴加NaOH溶液,先产生白色沉淀,后变灰绿,最后显红褐色
D、只需滴加KSCN溶液学以致用BC如何除去杂质,提纯下列各物质足量铁粉足量Cl2或氯水足量铁粉学以致用作业讲义,优化
应用实例和实验探究了解
铁、铜、Fe2+、Fe3+
的性质了解
Fe2+、Fe3+
的相互转化,
及其几种检
验方法了解铁铜及
其化合物的
重要应用
并巩固氧化
还原反应铁和铜的应用和物理性质炊具;导线;建材;
生活工具;制具特
性的铁合金等广泛用于电气工业;
制铜合金;各种仪
表的零件等
1.银白色,有金属光泽;2.是电和热的良导体;3.具有良好的延展性;1.纯铜呈紫红色;2.是电和热的良导体;3.具有良好的延展性。4.合金的优良性4.合金的优良性。交流与讨论1.铁与盐酸反应 ;
2.铁在氯气中燃烧 ;
3.铁与硫酸铜溶液反应 ;
4.铜与硝酸银溶液反应 ;
5. ;
6. ;结论:1.Fe、Cu在反应中充当还原剂
2.FeFe3+Fe2+强氧化剂弱氧化剂3.铜在反应中一般转化为+2价Cl2、Br2、浓硫酸、浓硝酸、稀硝酸、H2O2等稀盐酸、S、I2等信息提示
Fe3+的检验Fe3+ + 3SCN- = Fe(SCN)3血红色可溶实验:Fe3+Fe2+KSCN血红色不变色例:如何判断FeCl2溶液中是否有部分Fe2+
被氧化成Fe3+?鉴别方法Fe2+Fe3+与KSCN显色
反应浅绿色黄色与OH-反应直接观色不显红色血红色白色沉淀迅速变
灰绿最后呈红
褐色立即产生红
褐色沉淀Fe2+与Fe3+的鉴别如何防止FeCl2溶液的Fe2+ 被氧化成Fe3+?Fe2+→Fe3+:
Fe3+→Fe2+:
Fe3+→Fe2+:加入铁、铜、S2-、I-等Fe2+→Fe3+:加入Cl2、酸性KMnO4、
H2O2、浓H2SO4、稀HNO3
加入氧化剂加入还原剂取两只试管,各加入1mL
0.1mol·L-1的FeCl2溶液,向其
中一支试管中加入3滴KSCN
溶液,向另一支试管中,先加入几滴新制的氯水,振荡试管,再向试管中加入三滴KSCN溶液。取两只试管,各加入1mL
0.1mol·L-1的FeCl3溶液,向其
中一支试管中加入3滴KSCN
溶液,向另一支试管中,先加入少量铁粉,振荡试管,静置再向试管中加入三滴KSCN溶液。前一支试管中溶液不变色后一支试管中溶液变成血红色前一支试管中溶液变成血红色后一支试管中溶液不变色印刷电路板中的反应原理:2Fe 3+ + Cu == 2Fe2+ + Cu2+铁三角FeFe(II)Fe(III)
S 、I2、Cu2+ H+等H2、CO、C、Zn等Cl2、Br2、HNO3
H2SO4(浓)等H2、CO、C、Al等Cl2、Br2、HNO3 、H2O2 、O2 H2SO4(浓)、KMnO4Fe、Cu、H2S、S2-
I-等小试牛刀 能与Fe3+反应且能证明Fe3+具有氧化性的物质是:( )
①KSCN②Fe③FeCl2④NaCl
A.④ B. ① C.③ D. ②D证明某溶液只含有Fe2+而不含Fe3+的实验方法是( )
A、先滴加氯水,再滴加KSCN溶液后显红色
B、先滴加KSCN溶液,不显红色,再滴加氯水后显红色
C、滴加NaOH溶液,先产生白色沉淀,后变灰绿,最后显红褐色
D、只需滴加KSCN溶液学以致用BC如何除去杂质,提纯下列各物质足量铁粉足量Cl2或氯水足量铁粉学以致用作业讲义,优化
