河南省南阳市一中2009-2010学年秋期期中考试高二化学试题 附答案
文档属性
| 名称 | 河南省南阳市一中2009-2010学年秋期期中考试高二化学试题 附答案 |  | |
| 格式 | zip | ||
| 文件大小 | 88.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2009-12-31 09:43:00 | ||
图片预览



文档简介
南阳一中2009——2010学年秋期期中考试
高二化学试题
命题人:马欣波 考试时间:2009.11.18
注意事项:
1. 本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,满分120分,考试时间90分钟
2. 将第Ⅰ卷每小题答案涂在答题卡上,考试结束,只交答题卡和答题卷。
用到的相对原子质量:H 1 N 14 O 16 S 32
第I卷(选择题 共48分)
一、选择题(本题包括16小题,每小题3分,每小题只有一个选项符合题意。)
1. 在2A+B == 3C+4D反应中,下面表示的反应速率最快的是 ( )
A. VA=3.0mol·L-1·min-1 B. VB=0.28mol·L-1·S-1
C. VC=4.8mol·L-1·min-1 D. VD=1.0mol·L-1·S-1
2. 在一定温度下,下列叙述不是可逆反应 达到平衡的标志的是( )
(1)C的生成速率与C的分解速率相等;(2)单位时间生成amol A,同时生成3amol B;
(3)A、B、C的浓度不再变化;(4)2v正(B)=3v逆(C)(5)混合气体的总压强不再变化;(6)混合气体的物质的量不再变化;(7)混合气体的平均相对分子质量保持不变时;(8)A、B、C的分子数目比为1:3:2。
A. (2)(8) B. (7)(4) C. (1)(3) D. (5)(6)
3.进入接触室的混和气体体积组成是:SO27%、O211%、N282%。现有100体积混和气体进入接触室,反应后的总体积变为97.2,则SO2的转化率为 ( )
A. 50% B. 60% C. 80% D.90%
4. 可逆反应 达到平衡后,无论加压或降温。B的转化率都增大,则下列结论正确的是( )
A. A为气体,C为固体,正反应为放热反应
B. A为固体,C为气体,正反应为放热反应
C. A为气体,C为固体,正反应为吸热反应
D. A、C均为气体,正反应为吸热反应
5. 根据下列事实,判断离子的氧化性顺序为 ( )
①A+B2+=A2++B ②D+2H2O=D(OH)2+H2↑ ③以B、E为电极与E的盐溶液组成原电池,电极反应为:E2++2e-→E,B→B2+ +2e-
A.D2+>A2+>B2+>E2+ B.D2+>E2+>A2+>B2+
C.E2+>B2+>A2+>D2+ D.A2+>B2+>D2+>E2+
6. 250C和1.01×105Pa时,反应2N2O5(g)=4NO2(g)+O2(g); △H=+56.76kJ/mol,自发进行的原因是( )
A、是吸热反应; B、是放热反应;
C、是熵减少的反应; D、熵增大效应大于能量效应。
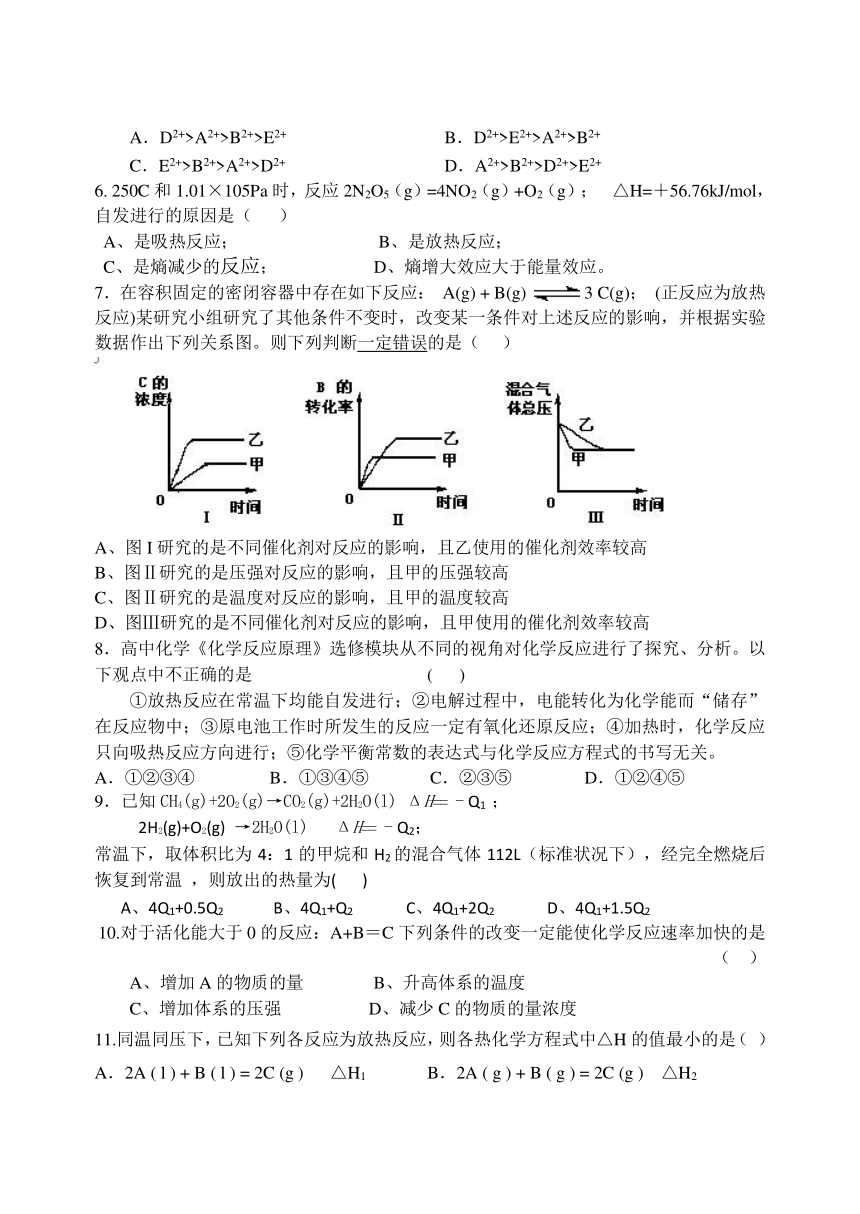
7.在容积固定的密闭容器中存在如下反应: A(g) + B(g) 3 C(g); (正反应为放热反应)某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出下列关系图。则下列判断一定错误的是( )
A、图I研究的是不同催化剂对反应的影响,且乙使用的催化剂效率较高
B、图Ⅱ研究的是压强对反应的影响,且甲的压强较高
C、图Ⅱ研究的是温度对反应的影响,且甲的温度较高
D、图Ⅲ研究的是不同催化剂对反应的影响,且甲使用的催化剂效率较高
8.高中化学《化学反应原理》选修模块从不同的视角对化学反应进行了探究、分析。以下观点中不正确的是 ( )
①放热反应在常温下均能自发进行;②电解过程中,电能转化为化学能而“储存”在反应物中;③原电池工作时所发生的反应一定有氧化还原反应;④加热时,化学反应只向吸热反应方向进行;⑤化学平衡常数的表达式与化学反应方程式的书写无关。
A.①②③④ B.①③④⑤ C.②③⑤ D.①②④⑤
9.已知CH4(g)+2O2(g)→CO2(g)+2H2O(l) ΔH== - Q1 ;
2H2(g)+O2(g) →2H2O(l) ΔH== - Q2;
常温下,取体积比为4:1的甲烷和H2的混合气体112L(标准状况下),经完全燃烧后恢复到常温 ,则放出的热量为( )
A、4Q1+0.5Q2 B、4Q1+Q2 C、4Q1+2Q2 D、4Q1+1.5Q2
10.对于活化能大于0的反应:A+B=C下列条件的改变一定能使化学反应速率加快的是( )
A、增加A的物质的量 B、升高体系的温度
C、增加体系的压强 D、减少C的物质的量浓度
11.同温同压下,已知下列各反应为放热反应,则各热化学方程式中△H的值最小的是( )
A.2A ( l ) + B ( l ) = 2C (g ) △H1 B.2A ( g ) + B ( g ) = 2C (g ) △H2
C.2A ( g ) + B ( g ) = 2C ( l ) △H3 D.2A ( l ) + B ( l ) = 2C ( l ) △H4
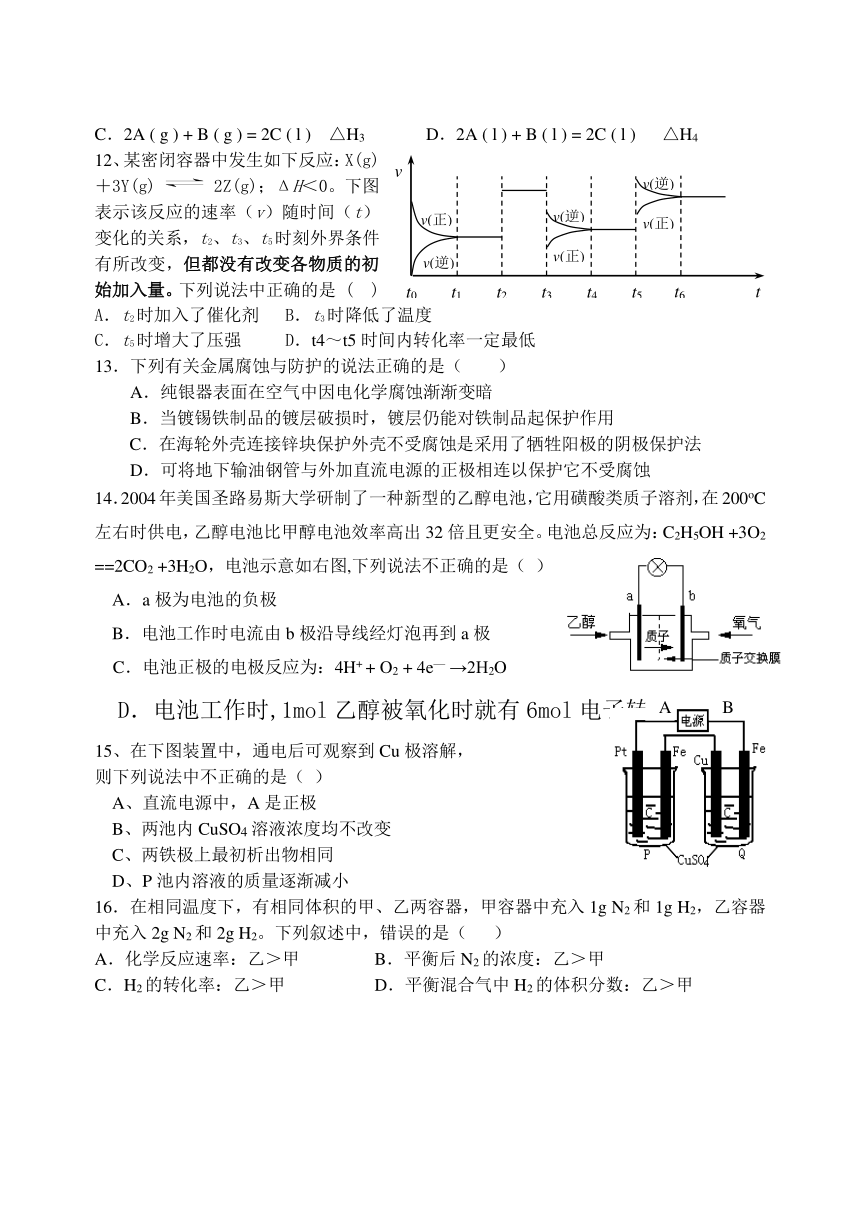
12、某密闭容器中发生如下反应:X(g)+3Y(g)2Z(g);ΔH<0。下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是 ( )
A.t2时加入了催化剂 B.t3时降低了温度
C.t5时增大了压强 D.t4~t5时间内转化率一定最低
13.下列有关金属腐蚀与防护的说法正确的是( )
A.纯银器表面在空气中因电化学腐蚀渐渐变暗
B.当镀锡铁制品的镀层破损时,镀层仍能对铁制品起保护作用
C.在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法
D.可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀
14.2004年美国圣路易斯大学研制了一种新型的乙醇电池,它用磺酸类质子溶剂,在200oC
左右时供电,乙醇电池比甲醇电池效率高出32倍且更安全。电池总反应为:C2H5OH +3O2
==2CO2 +3H2O,电池示意如右图,下列说法不正确的是( )
A.a极为电池的负极
B.电池工作时电流由b极沿导线经灯泡再到a极
C.电池正极的电极反应为:4H+ + O2 + 4e— →2H2O
D.电池工作时,1mol乙醇被氧化时就有6mol电子转移
15、在下图装置中,通电后可观察到Cu极溶解,
则下列说法中不正确的是( )
A、直流电源中,A是正极
B、两池内CuSO4溶液浓度均不改变
C、两铁极上最初析出物相同
D、P池内溶液的质量逐渐减小
16.在相同温度下,有相同体积的甲、乙两容器,甲容器中充入1g N2和1g H2,乙容器中充入2g N2和2g H2。下列叙述中,错误的是( )
A.化学反应速率:乙>甲 B.平衡后N2的浓度:乙>甲
C.H2的转化率:乙>甲 D.平衡混合气中H2的体积分数:乙>甲
第Ⅱ卷(非选择题,共72分)
二、填空题
17. (3分)由金红石TiO2制取单质Ti,涉及到的步骤为::
TiO2TiCl4Ti
已知:① Cs+O2g=CO2g; H=3935 kJ·mol1
② 2COg+O2g=2CO2g; H=566 kJ·mol1
③ TiO2s+2Cl2g=TiCl4s+O2g; H=+141 kJ·mol1
则TiO2s+2Cl2g+2Cs+O2g=TiCl4s+2COg 的H= 。
18、(5分)
⑴在一定条件下,1 mol某气体若被O2完全氧化放热98.0 kJ。现有2 mol 该气体与 1 mol O2在此条件下发生反应,生成相同的化合物达到平衡时放出的热量是176.4 kJ,则该气体的转化率为:
⑵4克硫粉完全燃烧时放出37千焦热量,该反应的热化学方程式是
19.(8分)已知某可逆反应mA(g)+nB(g) qC(g)在密闭容器中进行。如图所示
反应在不同时间t,温度T和压强P与反应物B的体积分数的关系曲线。根据图象填空
(⑴、⑵、⑶题填“>”、“<”或“=”):
⑴温度的关系:T1 T2;
⑵压强的关系:P1 P2;
⑶化学计量数的关系:m+n q;
⑷该反应的正反应为___________反应。(填“吸热”或“放热”)
⑸若B是有色物质,A、C均无色,若容器体积不变,则加入C时混合物颜色_______;若维持容器内压强不变,充入氖气时,混合物颜色_______(填“变深”“变浅”或“不变”)。
20.(15分)某课外活动小组同学用右图装置进行实验,试回答下列问题。
⑴若开始时开关K与a连接,则B极的电极反应为 。
⑵开始时开关K与b连接,则B极的电极反应式为 ,
总反应的离子方程式为 。
有关上述实验,下列说法正确的是(填序号) 。
①溶液中Na+向A极移动
②从A极处逸出的气体能使湿润KI淀粉试纸变蓝
③反应一段时间后加适量盐酸可恢复到电解前电解质的浓度
④若标准状况下B极产生2.24 L气体,则溶液中转移0.2 mol电子
⑶该小组同学认为,如果模拟工业上离子交换膜法制烧碱的方法,那么可以设想用下图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。
①该电解槽的阳极反应式为 。此时通过阴离子交换膜的离子数 (填“大于”或“小于”或“等于”)通过阳离子交换膜的离子数。
②制得的氢氧化钾溶液从出口(填写“A”、“B”、“C”、“D”) 导出。
③通电开始后,阴极附近溶液pH会增大,请简述原因 。
④若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池,则电池正极的电极反应式为 。
21、(10分)在1L容器中通入CO2、H2各2mol,在一定条件下发生反应:CO2+H2CO+H2O,回答下列问题:
(1)在830℃条件下,反应达到平衡时CO2的浓度为1mol·L-1。该条件下平衡常数K1=________,H2的转化率为
(2)在800℃条件下,已知该条件下的平衡常数K2=0.81,则平衡时[H2O]=_____ (保留2位有效数字)。
(3)该反应的正反应为___________反应(填“吸热”、“放热”)。
(4)在(1)的基础上,压缩容器体积至0.5L。该条件下的平衡常数为K3。则K3________K1
(填“大于”、“小于”或“等于”)。理由是___________________________________。
三、
22、(11分)工业上合成氨的化学反应 N2(g)+ 3H2(g) 2NH3(g)
△H = - 46.2KJ·mol-1、 △S = -198.3J·mol-1·K-1。在容积为10L的密闭容器中,通入40mol N2和120mol H2在一定条件下进行反应,4S后达到平衡状态,此时N2的浓度为2mol/L。通过计算回答下列问题:
⑴ 在温度为500K时,该反应 (填“能”或“不能”)自发进行。反应进行到平衡状态时△H—T △S = 。
⑵ 用N2 表示的4S内化学反应的平均速率是多少?(要求解题过程)
⑶ 计算在该条件下N2 的平衡转化率是多少?此时混合气体中NH3的体积分数是多少?(要求解题过程)
⑷ 为了提高氨气的产率,可以选择的方法是 (填序号,错选扣分)。
① 升高温度 ② 增大压强 ③ 使用催化剂 ④ 及时分离出NH3
四、附加题(20分)
23、(5分)将2molSO2和2molSO3气体混合于容积一定的密闭容器中,在一定条件下发生反应:2SO2+O22SO3,达平衡时SO3为n mol。在相同温度下,按下列配比在该容器中放入起始物质,达平衡时,SO3的物质的量将大于n mol的是
A.2molSO2和1molO2
B.2molSO2、1molO2和2molSO3
C.4molSO2和1molO2
D.3molSO2、1molO2和1molSO3
24、(5分)一定温度下,在一个固定容积的密闭容器中,可逆反应:A(g)+2B(g) C(g)达到平衡时,(A)=2mol·L-1,(B)=7mol·L-1,(C)=3mol·L-1。试确定B的起始浓度(B)的取值范围是______________;
25.(10分)常温、常压下,可发生如下反应:A(g)+B(g)C(g)+nD(g),若将2 mol A和2 mol B混合充入体积可变的密闭容器中,在不同条件下达到平衡时,C的浓度如下:
温度/℃ 压强/ Pa C平衡浓度/ mol·L-1
25 1×105 1.0
25 2×105 1.8
25 4×105 3.2
25 5×105 6.0
(1)可逆反应中,化学计量数n取值范围为 ,
理由是 。
(2)在5×105Pa时,D的状态为
南阳一中2009——2010学年秋期期中考试
高二化学答题卷
第Ⅱ卷(非选择题,共72分)
题号 二 三 四 总分
得分
二、填空题
17.
18、⑴ ⑵
19. ⑴ ⑵ ⑶
⑷___________(填“吸热”或“放热”)
⑸ _____ __; _______ (填“变深”“变浅”或“不变”)。
20.⑴ ⑵ ;
; (填序号)
⑶① ; (填“大于”或“小于”或“等于”)
② (填写“A”、“B”、“C”、“D”)
③
④
21(1) ,
(2) (保留2位有效数字)。(3) ______(填“吸热”、“放热”)。
(4)K3________K1(填“大于”、“小于”或“等于”)
理由是
三、22、⑴ (填“能”或“不能”);
⑵ 用N2 表示的4S内化学反应的平均速率是多少?
⑶ 计算在该条件下N2 的平衡转化率是多少?此时混合气体中NH3的体积分数是多少?
⑷ 为了提高氨气的产率,可以选择的方法是 (填序号,错选扣分)。
① 升高温度 ② 增大压强 ③ 使用催化剂 ④ 及时分离出NH3
四、附加题(20分)
23、 24、______________;
25.(1)n取值范围为 ,
理由是 。
(2)在5×105Pa时,D的状态为
南阳一中2009——2010学年秋期期中考试
高二化学答案
1 2 3 4 5 6 7 8
B A C A C D A D
9 10 11 12 13 14 15 16
A B C A C D B D
二、
17、(3分)-80 kJ·mol1
18、⑴90%(2分) ⑵Ss+O2g=SO2g; H=296 kJ·mol1(3分)
19、(共8分)(1) >(2) <(3) < (4)吸热 (各1分)
(5) 变深 , 变浅 (各2分)
20、21、4.(15分) (1)Fe = Fe2++2e- 2分
(2)2H+ + 2e- = H2↑(写成 2 H2O + 2e- = H2↑+2OH-也给分)2分
2Cl- + 2H2O 电解 2OH- + H2↑ + Cl2↑ 2分 ②1分
(3) ① 4OH- = 2H2O + O2↑+ 4e-,2分 < 1分 ② D 1分
③水的电离出的H+放电,使OH-浓度增大 2分 ④ O2 + 2H2O + 4e- = 4OH- 2分
21(1)1(2分)50%(2分) (2)0.95mol/L(2分)(2)吸热(1分) (4)等于(1分),温度不变,平衡常数不变。(2分)
三、
22、(1)能;0 (2分)(2) 0.5 mol·L-1·S-1 (2分)
(3)50% (2分); 33.3% (2分) (4) ② ④ (2分)
四、附加题
23、(5分)⑴BD
24、(5分)3mol·L-1≤C(B)≤13mol·L-1;
25、(1)n>1 (2分) 压强增加到2倍,C的浓度只增加到1.8倍,说明增大压强平衡向逆反应方向移动,正反应是气体物质的量增大的反应,故n>1。(3分)(2)固态或液态(5分)
t4
t5
t3
t2
t1
t0
v
v(逆)
v(正)
v(逆)
v(正)
t
v(逆)
v(正)
t6
A
B
B
B的
体积
分数
t(时间)
T1、P1
T1、P2
T2、P2
※※※※※※※※※※※※※※※※※※※※ 班级 姓名 考号 ※※※※※※※※※※※※※※※※※※
※※※※※※※※※※※※※※※※※※ 密 ※※※※※※※※※※※※ 封 ※※※※※※※※※※※※ 线 ※※※※※※※※※※※※※※※※
PAGE
高二化学试题
命题人:马欣波 考试时间:2009.11.18
注意事项:
1. 本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,满分120分,考试时间90分钟
2. 将第Ⅰ卷每小题答案涂在答题卡上,考试结束,只交答题卡和答题卷。
用到的相对原子质量:H 1 N 14 O 16 S 32
第I卷(选择题 共48分)
一、选择题(本题包括16小题,每小题3分,每小题只有一个选项符合题意。)
1. 在2A+B == 3C+4D反应中,下面表示的反应速率最快的是 ( )
A. VA=3.0mol·L-1·min-1 B. VB=0.28mol·L-1·S-1
C. VC=4.8mol·L-1·min-1 D. VD=1.0mol·L-1·S-1
2. 在一定温度下,下列叙述不是可逆反应 达到平衡的标志的是( )
(1)C的生成速率与C的分解速率相等;(2)单位时间生成amol A,同时生成3amol B;
(3)A、B、C的浓度不再变化;(4)2v正(B)=3v逆(C)(5)混合气体的总压强不再变化;(6)混合气体的物质的量不再变化;(7)混合气体的平均相对分子质量保持不变时;(8)A、B、C的分子数目比为1:3:2。
A. (2)(8) B. (7)(4) C. (1)(3) D. (5)(6)
3.进入接触室的混和气体体积组成是:SO27%、O211%、N282%。现有100体积混和气体进入接触室,反应后的总体积变为97.2,则SO2的转化率为 ( )
A. 50% B. 60% C. 80% D.90%
4. 可逆反应 达到平衡后,无论加压或降温。B的转化率都增大,则下列结论正确的是( )
A. A为气体,C为固体,正反应为放热反应
B. A为固体,C为气体,正反应为放热反应
C. A为气体,C为固体,正反应为吸热反应
D. A、C均为气体,正反应为吸热反应
5. 根据下列事实,判断离子的氧化性顺序为 ( )
①A+B2+=A2++B ②D+2H2O=D(OH)2+H2↑ ③以B、E为电极与E的盐溶液组成原电池,电极反应为:E2++2e-→E,B→B2+ +2e-
A.D2+>A2+>B2+>E2+ B.D2+>E2+>A2+>B2+
C.E2+>B2+>A2+>D2+ D.A2+>B2+>D2+>E2+
6. 250C和1.01×105Pa时,反应2N2O5(g)=4NO2(g)+O2(g); △H=+56.76kJ/mol,自发进行的原因是( )
A、是吸热反应; B、是放热反应;
C、是熵减少的反应; D、熵增大效应大于能量效应。
7.在容积固定的密闭容器中存在如下反应: A(g) + B(g) 3 C(g); (正反应为放热反应)某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出下列关系图。则下列判断一定错误的是( )
A、图I研究的是不同催化剂对反应的影响,且乙使用的催化剂效率较高
B、图Ⅱ研究的是压强对反应的影响,且甲的压强较高
C、图Ⅱ研究的是温度对反应的影响,且甲的温度较高
D、图Ⅲ研究的是不同催化剂对反应的影响,且甲使用的催化剂效率较高
8.高中化学《化学反应原理》选修模块从不同的视角对化学反应进行了探究、分析。以下观点中不正确的是 ( )
①放热反应在常温下均能自发进行;②电解过程中,电能转化为化学能而“储存”在反应物中;③原电池工作时所发生的反应一定有氧化还原反应;④加热时,化学反应只向吸热反应方向进行;⑤化学平衡常数的表达式与化学反应方程式的书写无关。
A.①②③④ B.①③④⑤ C.②③⑤ D.①②④⑤
9.已知CH4(g)+2O2(g)→CO2(g)+2H2O(l) ΔH== - Q1 ;
2H2(g)+O2(g) →2H2O(l) ΔH== - Q2;
常温下,取体积比为4:1的甲烷和H2的混合气体112L(标准状况下),经完全燃烧后恢复到常温 ,则放出的热量为( )
A、4Q1+0.5Q2 B、4Q1+Q2 C、4Q1+2Q2 D、4Q1+1.5Q2
10.对于活化能大于0的反应:A+B=C下列条件的改变一定能使化学反应速率加快的是( )
A、增加A的物质的量 B、升高体系的温度
C、增加体系的压强 D、减少C的物质的量浓度
11.同温同压下,已知下列各反应为放热反应,则各热化学方程式中△H的值最小的是( )
A.2A ( l ) + B ( l ) = 2C (g ) △H1 B.2A ( g ) + B ( g ) = 2C (g ) △H2
C.2A ( g ) + B ( g ) = 2C ( l ) △H3 D.2A ( l ) + B ( l ) = 2C ( l ) △H4
12、某密闭容器中发生如下反应:X(g)+3Y(g)2Z(g);ΔH<0。下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是 ( )
A.t2时加入了催化剂 B.t3时降低了温度
C.t5时增大了压强 D.t4~t5时间内转化率一定最低
13.下列有关金属腐蚀与防护的说法正确的是( )
A.纯银器表面在空气中因电化学腐蚀渐渐变暗
B.当镀锡铁制品的镀层破损时,镀层仍能对铁制品起保护作用
C.在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法
D.可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀
14.2004年美国圣路易斯大学研制了一种新型的乙醇电池,它用磺酸类质子溶剂,在200oC
左右时供电,乙醇电池比甲醇电池效率高出32倍且更安全。电池总反应为:C2H5OH +3O2
==2CO2 +3H2O,电池示意如右图,下列说法不正确的是( )
A.a极为电池的负极
B.电池工作时电流由b极沿导线经灯泡再到a极
C.电池正极的电极反应为:4H+ + O2 + 4e— →2H2O
D.电池工作时,1mol乙醇被氧化时就有6mol电子转移
15、在下图装置中,通电后可观察到Cu极溶解,
则下列说法中不正确的是( )
A、直流电源中,A是正极
B、两池内CuSO4溶液浓度均不改变
C、两铁极上最初析出物相同
D、P池内溶液的质量逐渐减小
16.在相同温度下,有相同体积的甲、乙两容器,甲容器中充入1g N2和1g H2,乙容器中充入2g N2和2g H2。下列叙述中,错误的是( )
A.化学反应速率:乙>甲 B.平衡后N2的浓度:乙>甲
C.H2的转化率:乙>甲 D.平衡混合气中H2的体积分数:乙>甲
第Ⅱ卷(非选择题,共72分)
二、填空题
17. (3分)由金红石TiO2制取单质Ti,涉及到的步骤为::
TiO2TiCl4Ti
已知:① Cs+O2g=CO2g; H=3935 kJ·mol1
② 2COg+O2g=2CO2g; H=566 kJ·mol1
③ TiO2s+2Cl2g=TiCl4s+O2g; H=+141 kJ·mol1
则TiO2s+2Cl2g+2Cs+O2g=TiCl4s+2COg 的H= 。
18、(5分)
⑴在一定条件下,1 mol某气体若被O2完全氧化放热98.0 kJ。现有2 mol 该气体与 1 mol O2在此条件下发生反应,生成相同的化合物达到平衡时放出的热量是176.4 kJ,则该气体的转化率为:
⑵4克硫粉完全燃烧时放出37千焦热量,该反应的热化学方程式是
19.(8分)已知某可逆反应mA(g)+nB(g) qC(g)在密闭容器中进行。如图所示
反应在不同时间t,温度T和压强P与反应物B的体积分数的关系曲线。根据图象填空
(⑴、⑵、⑶题填“>”、“<”或“=”):
⑴温度的关系:T1 T2;
⑵压强的关系:P1 P2;
⑶化学计量数的关系:m+n q;
⑷该反应的正反应为___________反应。(填“吸热”或“放热”)
⑸若B是有色物质,A、C均无色,若容器体积不变,则加入C时混合物颜色_______;若维持容器内压强不变,充入氖气时,混合物颜色_______(填“变深”“变浅”或“不变”)。
20.(15分)某课外活动小组同学用右图装置进行实验,试回答下列问题。
⑴若开始时开关K与a连接,则B极的电极反应为 。
⑵开始时开关K与b连接,则B极的电极反应式为 ,
总反应的离子方程式为 。
有关上述实验,下列说法正确的是(填序号) 。
①溶液中Na+向A极移动
②从A极处逸出的气体能使湿润KI淀粉试纸变蓝
③反应一段时间后加适量盐酸可恢复到电解前电解质的浓度
④若标准状况下B极产生2.24 L气体,则溶液中转移0.2 mol电子
⑶该小组同学认为,如果模拟工业上离子交换膜法制烧碱的方法,那么可以设想用下图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。
①该电解槽的阳极反应式为 。此时通过阴离子交换膜的离子数 (填“大于”或“小于”或“等于”)通过阳离子交换膜的离子数。
②制得的氢氧化钾溶液从出口(填写“A”、“B”、“C”、“D”) 导出。
③通电开始后,阴极附近溶液pH会增大,请简述原因 。
④若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池,则电池正极的电极反应式为 。
21、(10分)在1L容器中通入CO2、H2各2mol,在一定条件下发生反应:CO2+H2CO+H2O,回答下列问题:
(1)在830℃条件下,反应达到平衡时CO2的浓度为1mol·L-1。该条件下平衡常数K1=________,H2的转化率为
(2)在800℃条件下,已知该条件下的平衡常数K2=0.81,则平衡时[H2O]=_____ (保留2位有效数字)。
(3)该反应的正反应为___________反应(填“吸热”、“放热”)。
(4)在(1)的基础上,压缩容器体积至0.5L。该条件下的平衡常数为K3。则K3________K1
(填“大于”、“小于”或“等于”)。理由是___________________________________。
三、
22、(11分)工业上合成氨的化学反应 N2(g)+ 3H2(g) 2NH3(g)
△H = - 46.2KJ·mol-1、 △S = -198.3J·mol-1·K-1。在容积为10L的密闭容器中,通入40mol N2和120mol H2在一定条件下进行反应,4S后达到平衡状态,此时N2的浓度为2mol/L。通过计算回答下列问题:
⑴ 在温度为500K时,该反应 (填“能”或“不能”)自发进行。反应进行到平衡状态时△H—T △S = 。
⑵ 用N2 表示的4S内化学反应的平均速率是多少?(要求解题过程)
⑶ 计算在该条件下N2 的平衡转化率是多少?此时混合气体中NH3的体积分数是多少?(要求解题过程)
⑷ 为了提高氨气的产率,可以选择的方法是 (填序号,错选扣分)。
① 升高温度 ② 增大压强 ③ 使用催化剂 ④ 及时分离出NH3
四、附加题(20分)
23、(5分)将2molSO2和2molSO3气体混合于容积一定的密闭容器中,在一定条件下发生反应:2SO2+O22SO3,达平衡时SO3为n mol。在相同温度下,按下列配比在该容器中放入起始物质,达平衡时,SO3的物质的量将大于n mol的是
A.2molSO2和1molO2
B.2molSO2、1molO2和2molSO3
C.4molSO2和1molO2
D.3molSO2、1molO2和1molSO3
24、(5分)一定温度下,在一个固定容积的密闭容器中,可逆反应:A(g)+2B(g) C(g)达到平衡时,(A)=2mol·L-1,(B)=7mol·L-1,(C)=3mol·L-1。试确定B的起始浓度(B)的取值范围是______________;
25.(10分)常温、常压下,可发生如下反应:A(g)+B(g)C(g)+nD(g),若将2 mol A和2 mol B混合充入体积可变的密闭容器中,在不同条件下达到平衡时,C的浓度如下:
温度/℃ 压强/ Pa C平衡浓度/ mol·L-1
25 1×105 1.0
25 2×105 1.8
25 4×105 3.2
25 5×105 6.0
(1)可逆反应中,化学计量数n取值范围为 ,
理由是 。
(2)在5×105Pa时,D的状态为
南阳一中2009——2010学年秋期期中考试
高二化学答题卷
第Ⅱ卷(非选择题,共72分)
题号 二 三 四 总分
得分
二、填空题
17.
18、⑴ ⑵
19. ⑴ ⑵ ⑶
⑷___________(填“吸热”或“放热”)
⑸ _____ __; _______ (填“变深”“变浅”或“不变”)。
20.⑴ ⑵ ;
; (填序号)
⑶① ; (填“大于”或“小于”或“等于”)
② (填写“A”、“B”、“C”、“D”)
③
④
21(1) ,
(2) (保留2位有效数字)。(3) ______(填“吸热”、“放热”)。
(4)K3________K1(填“大于”、“小于”或“等于”)
理由是
三、22、⑴ (填“能”或“不能”);
⑵ 用N2 表示的4S内化学反应的平均速率是多少?
⑶ 计算在该条件下N2 的平衡转化率是多少?此时混合气体中NH3的体积分数是多少?
⑷ 为了提高氨气的产率,可以选择的方法是 (填序号,错选扣分)。
① 升高温度 ② 增大压强 ③ 使用催化剂 ④ 及时分离出NH3
四、附加题(20分)
23、 24、______________;
25.(1)n取值范围为 ,
理由是 。
(2)在5×105Pa时,D的状态为
南阳一中2009——2010学年秋期期中考试
高二化学答案
1 2 3 4 5 6 7 8
B A C A C D A D
9 10 11 12 13 14 15 16
A B C A C D B D
二、
17、(3分)-80 kJ·mol1
18、⑴90%(2分) ⑵Ss+O2g=SO2g; H=296 kJ·mol1(3分)
19、(共8分)(1) >(2) <(3) < (4)吸热 (各1分)
(5) 变深 , 变浅 (各2分)
20、21、4.(15分) (1)Fe = Fe2++2e- 2分
(2)2H+ + 2e- = H2↑(写成 2 H2O + 2e- = H2↑+2OH-也给分)2分
2Cl- + 2H2O 电解 2OH- + H2↑ + Cl2↑ 2分 ②1分
(3) ① 4OH- = 2H2O + O2↑+ 4e-,2分 < 1分 ② D 1分
③水的电离出的H+放电,使OH-浓度增大 2分 ④ O2 + 2H2O + 4e- = 4OH- 2分
21(1)1(2分)50%(2分) (2)0.95mol/L(2分)(2)吸热(1分) (4)等于(1分),温度不变,平衡常数不变。(2分)
三、
22、(1)能;0 (2分)(2) 0.5 mol·L-1·S-1 (2分)
(3)50% (2分); 33.3% (2分) (4) ② ④ (2分)
四、附加题
23、(5分)⑴BD
24、(5分)3mol·L-1≤C(B)≤13mol·L-1;
25、(1)n>1 (2分) 压强增加到2倍,C的浓度只增加到1.8倍,说明增大压强平衡向逆反应方向移动,正反应是气体物质的量增大的反应,故n>1。(3分)(2)固态或液态(5分)
t4
t5
t3
t2
t1
t0
v
v(逆)
v(正)
v(逆)
v(正)
t
v(逆)
v(正)
t6
A
B
B
B的
体积
分数
t(时间)
T1、P1
T1、P2
T2、P2
※※※※※※※※※※※※※※※※※※※※ 班级 姓名 考号 ※※※※※※※※※※※※※※※※※※
※※※※※※※※※※※※※※※※※※ 密 ※※※※※※※※※※※※ 封 ※※※※※※※※※※※※ 线 ※※※※※※※※※※※※※※※※
PAGE
同课章节目录
