福建省厦门六中09-10学年高二上学期12月月考
文档属性
| 名称 | 福建省厦门六中09-10学年高二上学期12月月考 |

|
|
| 格式 | rar | ||
| 文件大小 | 150.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2010-01-06 00:00:00 | ||
图片预览



文档简介
福建省厦门六中09-10学年高二上学期12月月考
化学试题
(考试时间:90分钟 总分:97分)
第Ⅰ卷(选择题 共50分)
相对原子质量:H-1 C-12 O-16 N-14 F-19 Cl-35.5 Br-80 I-137
一、单项选择题(本题包括10小题,每小题2分,共20分。)
1.某原子核外共有6个电子,分布在K与L电子层上,在下列L层分布中正确的是。
A. ?? ??B.
C.?????? ?D.
2.下列原子中,第一电离能最大的是
A. B B. C C. Al D. Si
3下列各组元素中,电负性依次减小的是
A. K、Na、Al B. O、Cl、H
C. As、P、H D. O、S、Cl
4.下列各基态原子或离子的电子排布式错误的是
A. Na+: 1s22s22p6 B. F:1s22s22p5
C. O2-: 1s22s22p4 D. Ar:1s22s22p63s23p6
5.下列能跟氢原子形成最强极性键的原子是
A.F B.Cl C.Br D.I
6.下列化合物分子中的所有碳原子不可能处于同一平面的是:
A.甲苯 B.硝基苯
C.2-甲基丙烯 D.2-甲基丙烷
7. 下列叙述不正确的是
A.天然气和沼气的主要成分是甲烷
B. 等物质的量的乙醇和乙酸完全燃烧时所需氧气的质量相等
C. 纤维素乙酸酯、油脂和蛋白质在一定条件都能水解
D. 葡萄糖和蔗糖都含有C、H、O三种元素,但不是同系物
8.以下表示氦原子结构的化学用语中,对电子运动状态描述最详尽的是
A.He B. C.1s2 D.
9. 北京奥运会期间对大量盆栽鲜花施用了S-诱抗素制剂,以保证鲜花盛开,S-诱抗素的分子结构如图,下列关于该分子说法正确的是
A.含有碳碳双键、羟基、羰基、羧基
B.含有苯环、羟基、羰基、羧基
C.含有羟基、羰基、羧基、酯基
D.含有碳碳双键、苯环、羟基、羰基
10. 下列关于常见有机物的说法不正确的是
A. 乙烯和苯都能与溴水反应
B. 乙酸和油脂都能与氢氧化钠溶液反应
C. 糖类和蛋白质都是人体重要的营养物质
D. 乙烯和甲烷可用酸性高锰酸钾溶液鉴别
二、单项选择题(本题包括10小题,每小题3分,共30分。)
11.有关乙烯分子中的化学键描述正确的是
A.每个碳原子的sp2杂化轨道中的其中一个形成π键
B.每个碳原子的未参加杂化的2p轨道形成σ键
C.碳原子的三个sp2杂化轨道与其它原子形成三个σ键
D.碳原子的未参加杂化的2p轨道与其它原子形成σ键
12.下列不能根据元素电负性判断的是
A.判断一种元素是金属还是非金属
B. 判断化合物中元素正负价
C.判断化学键类型
D. 判断化合物溶解度
13. 下列微粒中,最外层未成对电子数最多的是
A. O B. P C. Mn D. Fe3+
14.下列各组微粒,半径大小比较中错误的是
A.K >Na >Li B.Na+>Mg2+>Al3+
C.Mg2+>Na+>F- D.Cl->F->F
15.下列分子中,所有原子的最外层均为8电子结构的是
A.BeCl2 B.H2S C.NCl3 D.PCl5
16.根据等电子原理,等电子体之间结构相似。以下各组粒子不能互称为等电子体的是
A.CO和N2 B.O3 和SO2
C.CO2和N2O D.N2H4 和C2H4
17.用价层电子对互斥理论预测H2S和BF3的立体结构,两个结论都正确的是
A.直线形;三角锥形????? B. V形;三角锥形
C.直线形;平面三角形??? D. V形;平面三角形
18. 1mol 与足量的NaOH
溶液充分反应,消耗的NaOH的物质的量为
A.5 mol B.4 mol C.3 mol D.2 mol
19.下列叙述错误的是
A.合金材料中可能含有非金属元素
B.人造纤维,合成纤维和光导纤维都是有机高分子化合物
C.加热能杀死流感病毒是因为病毒的蛋白质受热变性
D.在车排气管上加装“催化转化器”是为了减少有害气体的排放
20. 莽草酸是一种合成治疗禽流感药物达菲的原料,鞣酸存在于苹果、生石榴等植物中。下列关于这两种有机化合物的说法正确的是
A. 两种酸都能与溴水反应
B. 两种酸遇三氯化铁溶液都显紫色
C. 鞣酸分子与莽草酸分子相比多了两个碳碳双键
D. 等物质的量的两种酸与足量金属钠反应产生氢气的不同
福建省厦门六中09-10学年高二上学期12月月考
化学试题
第Ⅱ卷(非选择题 共47分)
三、(本题包括2小题,共13分)
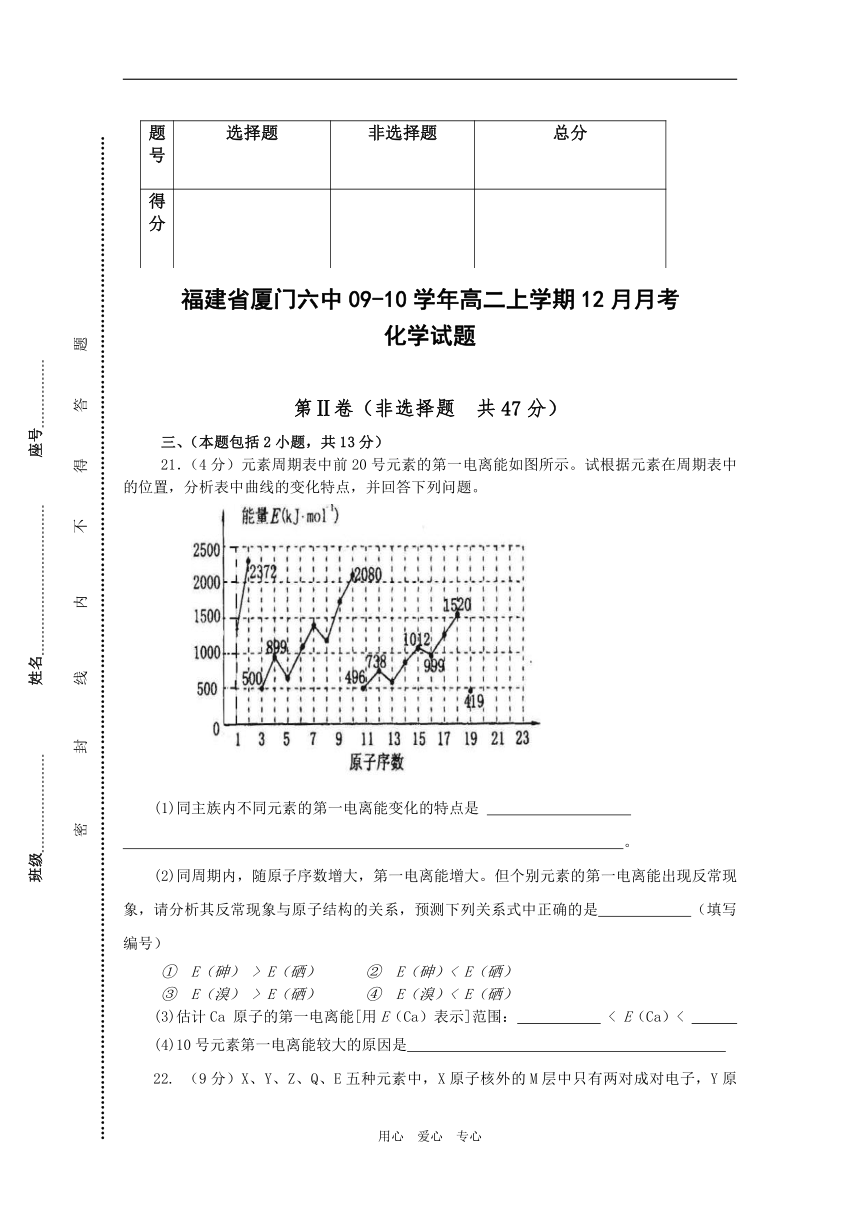
21.(4分)元素周期表中前20号元素的第一电离能如图所示。试根据元素在周期表中的位置,分析表中曲线的变化特点,并回答下列问题。
(1)同主族内不同元素的第一电离能变化的特点是
。
(2)同周期内,随原子序数增大,第一电离能增大。但个别元素的第一电离能出现反常现象,请分析其反常现象与原子结构的关系,预测下列关系式中正确的是 (填写编号)
① E(砷) > E(硒) ② E(砷)< E(硒)
③ E(溴) > E(硒) ④ E(溴)< E(硒)
(3)估计Ca 原子的第一电离能[用E(Ca)表示]范围: < E(Ca)<
(4)10号元素第一电离能较大的原因是
22. (9分)X、Y、Z、Q、E五种元素中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳中含量(质量分数)最高的元素,Q的核电荷数是X与Z的核电荷数之和,E在元素周期表的各元素中电负性最大。请回答下列问题:
(1)X、Y的元素符号依次为 、 ;
(2)XZ2分子的VSEPR构型是 ,YZ2分子的结构是 形,
相同条件下两者在水中的溶解度较大的是 (写分子式)
(3)Q的元素符号是 ,它属于第 周期,它的核外电子排布式为
,在形成化合物时它的最高化合价为 。
21.(1)递减 (2)①③ (3)419、496 (4)各轨道全满难失电子
22.(1)S C
(2)三角形 直线形 SO2。
(3)Cr 四 1S22S22p63S23p63d54S1 +6
四、实验题(共14分)
23. (14分)实验室用燃烧法测定某种氨基酸(CxHyOzNp)的分子组成。取wg该种氨基酸放在纯氧中充分燃烧,生成CO2、H2O和N2。现用下图所示装置进行实验(铁架台、铁夹、酒精灯等未画出),回答下列问题:
A?????? B????? C?????? D??????? E???? F
(1)实验开始时,首先打开止水夹a,关闭止水夹b,通一段时间的纯氧,这样做的目的是??????????????????????????????? ? ????? ;之后则需关闭止水夹?????????? ?,打开止水夹????????????。 (2)图示装置中需要加热的有(填装置代号)???????? ???? 。操作时应先点燃???????????????????处的洒精灯。
(3)装置A中发生反应的化学方程式为?????????????????????? ??????????????? ??。 (4)装置D的作用是???????????????????????????????????????????????????????? 。 (5)为将N2所排水的体积测准,反应前应将连接E和F装置的玻璃导管中充满
????????????????????(填“水”、“空气”或“氧气”),理由是???????????????????????????????????????????? ????? ???????????????????????????????????????????? ???????????????。 (6)读取N2所排水的体积时,要注意:
????????????????????? ?????????????????????;② ?????????? ?????。 ? (7)实验中测得N2的体积为VmL(已换算成标准状况)。为确定此氨基酸的分子式,还需得到的数据有(填字母)????? ?? 。 ? A.生成二氧化碳气体的质量???????? B.生成水的质量 C.通入氧气的体积????????????????? ?D.该氨基酸的摩尔质量 (8)如果将装置中B、C连接顺序变为C、B,该实验的目的能否达到?简述理由:?????????????????????????????????????? ???????。
23. (1)将装置中N2排净 a; b (2)A和D; D
(3)
(4)吸收未反应的O2,保证最终收集到的气体是反应生成的N2
(5)水;
这段玻璃管中如充满气体,将不能被收集和测量,导致较大的实验误差;而充满水时将保证进入装置E的气体体积与排出水的体积基本相等
(6)①量筒应与广口瓶位于同一水平面 ②视线应与刻度线和凹液面最低点相切 (7)A、B、D
(8)不能达到该实验目的。因为碱石灰是碱性干燥剂,将同时吸收H2O和CO2两种
气体,使实验结果缺少必要的数据,无法确定该氨基酸的分子组成 五、推断题(本题包括2小题,共20分)
24. (9分)已知某元素A能与ⅦA族某一元素B生成A的最高价化合物X,在化合物X中B的含量为92.2%,而在与此相应的A的氧化物Y中,氧的含量为72.7%。A与B生成的化合物X为一无色透明液体,沸点77℃,对氢气的相对密度为77。
回答下列问题(不必给出计算过程):
(1)A元素名称 ,并指出属于第 周期第 族;
(2)X的分子式 ,分子空间构型 ,键角 。
(3)Y的分子式 ,分子空间构型 ,键角 。
24.(1)A元素是C,位于第二周期第Ⅳ族 (2)CCl4和CO2
25. (11分)某有机物A(相对分子质量为74)可在一定条件下氧化成无支链的B(碳原子数不变),转化关系如图所示(部分反应条件和产物略),其中有机物G的分子结构中不含溴。
(1)A的分子式为 ?? ? ,B中含有的官能团名称为 。
D的结构简式为 ???? 。
(2)A→E反应的化学方程式为 ?? 。 F→G的反应类型为 。 (3)E在一定条件下可加聚生成聚合物H,H的结构简式为 ????? 。
(4)与A同类的所有同分异构体的简式为:
。
25. (1)C4H10O;?醛基?; CH3CH2CH2COOCH2CH2CH2CH3 (2)CH3CH2CH2CH2OH ?? CH2CH2CH=CH2+H2O;消去反应
(3)
(4)、、、
福建省厦门六中09-10学年高二上学期12月月考
化学试题
1-5 DBBCA 6-10 DBDAA 11-15 CDDCC 16-20 DDABA
21.(1)递减 (2)①③ (3)419、496 (4)各轨道全满难失电子
22.(1)S C
(2)三角形 直线形 SO2。
(3)Cr 四 1S22S22p63S23p63d54S1 +6
23. (1)将装置中N2排净 a; b (2)A和D; D
(3)
(4)吸收未反应的O2,保证最终收集到的气体是反应生成的N2
(5)水;
这段玻璃管中如充满气体,将不能被收集和测量,导致较大的实验误差;而充满水时将保证进入装置E的气体体积与排出水的体积基本相等
(6)①量筒应与广口瓶位于同一水平面 ②视线应与刻度线和凹液面最低点相切 (7)A、B、D
(8)不能达到该实验目的。因为碱石灰是碱性干燥剂,将同时吸收H2O和CO2两种
气体,使实验结果缺少必要的数据,无法确定该氨基酸的分子组成
化学试题
(考试时间:90分钟 总分:97分)
第Ⅰ卷(选择题 共50分)
相对原子质量:H-1 C-12 O-16 N-14 F-19 Cl-35.5 Br-80 I-137
一、单项选择题(本题包括10小题,每小题2分,共20分。)
1.某原子核外共有6个电子,分布在K与L电子层上,在下列L层分布中正确的是。
A. ?? ??B.
C.?????? ?D.
2.下列原子中,第一电离能最大的是
A. B B. C C. Al D. Si
3下列各组元素中,电负性依次减小的是
A. K、Na、Al B. O、Cl、H
C. As、P、H D. O、S、Cl
4.下列各基态原子或离子的电子排布式错误的是
A. Na+: 1s22s22p6 B. F:1s22s22p5
C. O2-: 1s22s22p4 D. Ar:1s22s22p63s23p6
5.下列能跟氢原子形成最强极性键的原子是
A.F B.Cl C.Br D.I
6.下列化合物分子中的所有碳原子不可能处于同一平面的是:
A.甲苯 B.硝基苯
C.2-甲基丙烯 D.2-甲基丙烷
7. 下列叙述不正确的是
A.天然气和沼气的主要成分是甲烷
B. 等物质的量的乙醇和乙酸完全燃烧时所需氧气的质量相等
C. 纤维素乙酸酯、油脂和蛋白质在一定条件都能水解
D. 葡萄糖和蔗糖都含有C、H、O三种元素,但不是同系物
8.以下表示氦原子结构的化学用语中,对电子运动状态描述最详尽的是
A.He B. C.1s2 D.
9. 北京奥运会期间对大量盆栽鲜花施用了S-诱抗素制剂,以保证鲜花盛开,S-诱抗素的分子结构如图,下列关于该分子说法正确的是
A.含有碳碳双键、羟基、羰基、羧基
B.含有苯环、羟基、羰基、羧基
C.含有羟基、羰基、羧基、酯基
D.含有碳碳双键、苯环、羟基、羰基
10. 下列关于常见有机物的说法不正确的是
A. 乙烯和苯都能与溴水反应
B. 乙酸和油脂都能与氢氧化钠溶液反应
C. 糖类和蛋白质都是人体重要的营养物质
D. 乙烯和甲烷可用酸性高锰酸钾溶液鉴别
二、单项选择题(本题包括10小题,每小题3分,共30分。)
11.有关乙烯分子中的化学键描述正确的是
A.每个碳原子的sp2杂化轨道中的其中一个形成π键
B.每个碳原子的未参加杂化的2p轨道形成σ键
C.碳原子的三个sp2杂化轨道与其它原子形成三个σ键
D.碳原子的未参加杂化的2p轨道与其它原子形成σ键
12.下列不能根据元素电负性判断的是
A.判断一种元素是金属还是非金属
B. 判断化合物中元素正负价
C.判断化学键类型
D. 判断化合物溶解度
13. 下列微粒中,最外层未成对电子数最多的是
A. O B. P C. Mn D. Fe3+
14.下列各组微粒,半径大小比较中错误的是
A.K >Na >Li B.Na+>Mg2+>Al3+
C.Mg2+>Na+>F- D.Cl->F->F
15.下列分子中,所有原子的最外层均为8电子结构的是
A.BeCl2 B.H2S C.NCl3 D.PCl5
16.根据等电子原理,等电子体之间结构相似。以下各组粒子不能互称为等电子体的是
A.CO和N2 B.O3 和SO2
C.CO2和N2O D.N2H4 和C2H4
17.用价层电子对互斥理论预测H2S和BF3的立体结构,两个结论都正确的是
A.直线形;三角锥形????? B. V形;三角锥形
C.直线形;平面三角形??? D. V形;平面三角形
18. 1mol 与足量的NaOH
溶液充分反应,消耗的NaOH的物质的量为
A.5 mol B.4 mol C.3 mol D.2 mol
19.下列叙述错误的是
A.合金材料中可能含有非金属元素
B.人造纤维,合成纤维和光导纤维都是有机高分子化合物
C.加热能杀死流感病毒是因为病毒的蛋白质受热变性
D.在车排气管上加装“催化转化器”是为了减少有害气体的排放
20. 莽草酸是一种合成治疗禽流感药物达菲的原料,鞣酸存在于苹果、生石榴等植物中。下列关于这两种有机化合物的说法正确的是
A. 两种酸都能与溴水反应
B. 两种酸遇三氯化铁溶液都显紫色
C. 鞣酸分子与莽草酸分子相比多了两个碳碳双键
D. 等物质的量的两种酸与足量金属钠反应产生氢气的不同
福建省厦门六中09-10学年高二上学期12月月考
化学试题
第Ⅱ卷(非选择题 共47分)
三、(本题包括2小题,共13分)
21.(4分)元素周期表中前20号元素的第一电离能如图所示。试根据元素在周期表中的位置,分析表中曲线的变化特点,并回答下列问题。
(1)同主族内不同元素的第一电离能变化的特点是
。
(2)同周期内,随原子序数增大,第一电离能增大。但个别元素的第一电离能出现反常现象,请分析其反常现象与原子结构的关系,预测下列关系式中正确的是 (填写编号)
① E(砷) > E(硒) ② E(砷)< E(硒)
③ E(溴) > E(硒) ④ E(溴)< E(硒)
(3)估计Ca 原子的第一电离能[用E(Ca)表示]范围: < E(Ca)<
(4)10号元素第一电离能较大的原因是
22. (9分)X、Y、Z、Q、E五种元素中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳中含量(质量分数)最高的元素,Q的核电荷数是X与Z的核电荷数之和,E在元素周期表的各元素中电负性最大。请回答下列问题:
(1)X、Y的元素符号依次为 、 ;
(2)XZ2分子的VSEPR构型是 ,YZ2分子的结构是 形,
相同条件下两者在水中的溶解度较大的是 (写分子式)
(3)Q的元素符号是 ,它属于第 周期,它的核外电子排布式为
,在形成化合物时它的最高化合价为 。
21.(1)递减 (2)①③ (3)419、496 (4)各轨道全满难失电子
22.(1)S C
(2)三角形 直线形 SO2。
(3)Cr 四 1S22S22p63S23p63d54S1 +6
四、实验题(共14分)
23. (14分)实验室用燃烧法测定某种氨基酸(CxHyOzNp)的分子组成。取wg该种氨基酸放在纯氧中充分燃烧,生成CO2、H2O和N2。现用下图所示装置进行实验(铁架台、铁夹、酒精灯等未画出),回答下列问题:
A?????? B????? C?????? D??????? E???? F
(1)实验开始时,首先打开止水夹a,关闭止水夹b,通一段时间的纯氧,这样做的目的是??????????????????????????????? ? ????? ;之后则需关闭止水夹?????????? ?,打开止水夹????????????。 (2)图示装置中需要加热的有(填装置代号)???????? ???? 。操作时应先点燃???????????????????处的洒精灯。
(3)装置A中发生反应的化学方程式为?????????????????????? ??????????????? ??。 (4)装置D的作用是???????????????????????????????????????????????????????? 。 (5)为将N2所排水的体积测准,反应前应将连接E和F装置的玻璃导管中充满
????????????????????(填“水”、“空气”或“氧气”),理由是???????????????????????????????????????????? ????? ???????????????????????????????????????????? ???????????????。 (6)读取N2所排水的体积时,要注意:
????????????????????? ?????????????????????;② ?????????? ?????。 ? (7)实验中测得N2的体积为VmL(已换算成标准状况)。为确定此氨基酸的分子式,还需得到的数据有(填字母)????? ?? 。 ? A.生成二氧化碳气体的质量???????? B.生成水的质量 C.通入氧气的体积????????????????? ?D.该氨基酸的摩尔质量 (8)如果将装置中B、C连接顺序变为C、B,该实验的目的能否达到?简述理由:?????????????????????????????????????? ???????。
23. (1)将装置中N2排净 a; b (2)A和D; D
(3)
(4)吸收未反应的O2,保证最终收集到的气体是反应生成的N2
(5)水;
这段玻璃管中如充满气体,将不能被收集和测量,导致较大的实验误差;而充满水时将保证进入装置E的气体体积与排出水的体积基本相等
(6)①量筒应与广口瓶位于同一水平面 ②视线应与刻度线和凹液面最低点相切 (7)A、B、D
(8)不能达到该实验目的。因为碱石灰是碱性干燥剂,将同时吸收H2O和CO2两种
气体,使实验结果缺少必要的数据,无法确定该氨基酸的分子组成 五、推断题(本题包括2小题,共20分)
24. (9分)已知某元素A能与ⅦA族某一元素B生成A的最高价化合物X,在化合物X中B的含量为92.2%,而在与此相应的A的氧化物Y中,氧的含量为72.7%。A与B生成的化合物X为一无色透明液体,沸点77℃,对氢气的相对密度为77。
回答下列问题(不必给出计算过程):
(1)A元素名称 ,并指出属于第 周期第 族;
(2)X的分子式 ,分子空间构型 ,键角 。
(3)Y的分子式 ,分子空间构型 ,键角 。
24.(1)A元素是C,位于第二周期第Ⅳ族 (2)CCl4和CO2
25. (11分)某有机物A(相对分子质量为74)可在一定条件下氧化成无支链的B(碳原子数不变),转化关系如图所示(部分反应条件和产物略),其中有机物G的分子结构中不含溴。
(1)A的分子式为 ?? ? ,B中含有的官能团名称为 。
D的结构简式为 ???? 。
(2)A→E反应的化学方程式为 ?? 。 F→G的反应类型为 。 (3)E在一定条件下可加聚生成聚合物H,H的结构简式为 ????? 。
(4)与A同类的所有同分异构体的简式为:
。
25. (1)C4H10O;?醛基?; CH3CH2CH2COOCH2CH2CH2CH3 (2)CH3CH2CH2CH2OH ?? CH2CH2CH=CH2+H2O;消去反应
(3)
(4)、、、
福建省厦门六中09-10学年高二上学期12月月考
化学试题
1-5 DBBCA 6-10 DBDAA 11-15 CDDCC 16-20 DDABA
21.(1)递减 (2)①③ (3)419、496 (4)各轨道全满难失电子
22.(1)S C
(2)三角形 直线形 SO2。
(3)Cr 四 1S22S22p63S23p63d54S1 +6
23. (1)将装置中N2排净 a; b (2)A和D; D
(3)
(4)吸收未反应的O2,保证最终收集到的气体是反应生成的N2
(5)水;
这段玻璃管中如充满气体,将不能被收集和测量,导致较大的实验误差;而充满水时将保证进入装置E的气体体积与排出水的体积基本相等
(6)①量筒应与广口瓶位于同一水平面 ②视线应与刻度线和凹液面最低点相切 (7)A、B、D
(8)不能达到该实验目的。因为碱石灰是碱性干燥剂,将同时吸收H2O和CO2两种
气体,使实验结果缺少必要的数据,无法确定该氨基酸的分子组成
