应用广泛的酸碱盐复习1
图片预览








文档简介
课件24张PPT。应用广泛的酸碱盐复习课1.掌握酸碱盐的概念以及它们的性质;
2.掌握常见离子和物质的鉴别;
3.掌握复分解反应条件,会写出常见的化学方程式
4.培养自我归纳总结的能力和学习方法,学会从个别到一般,从一般到个别的归纳推理能力 复习目标本章的特点1、物质多
2、关系多
3、反应多
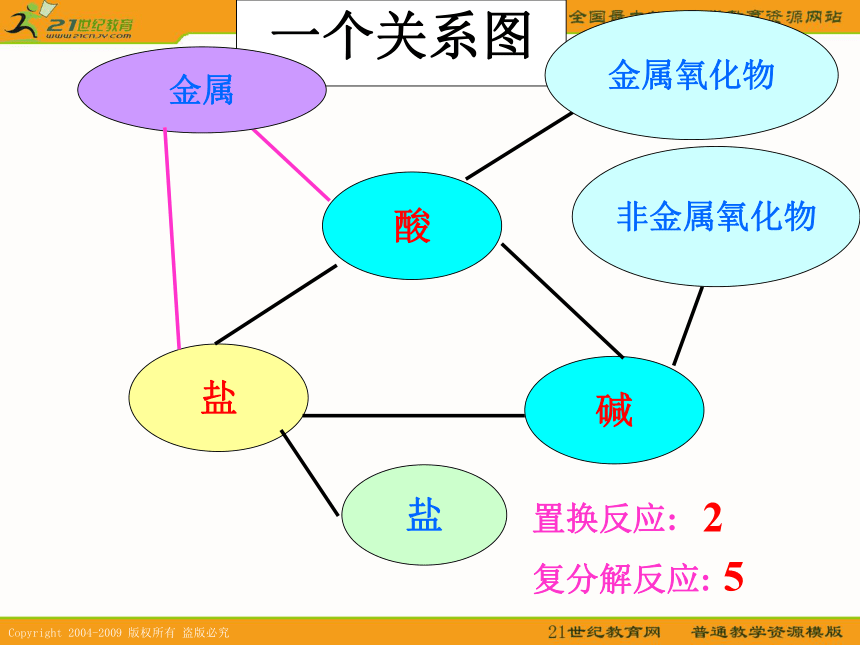
4、用途多本章可概括为:1-9字诀 1、一个关系图
2、两个“表”
3、三类物质的性质
4、四种离子鉴定
5、五种化肥
6、六大物质分类
7、七种常见物质
8、八种沉淀和反应
9、九种颜色物质
一个关系图 酸盐碱金属金属氧化物盐置换反应:
复分解反应:25非金属氧化物两个“表”1 .金属活动顺序表.2 . 酸碱盐溶解性表
K Ca Na Mg Al Zn Fe Sn Pb H Cu Hg Ag Pt Au
K Na NH4 NO3 盐可溶
Cl化物中 Ag 不溶。
SO4盐中 Ba 不溶。
CO3盐 大多沉水中。
碱中只溶K Na Ca 和Ba
下列各组金属中,金属活动顺序排列正确的是( )
①将甲投入稀H2SO4中,有气泡冒出
②将乙投入含甲的盐溶液中有甲析出
③将丙投入稀硫酸中,无现象
A.甲〉乙〉丙 B.乙〉甲〉丙
C.甲〉丙〉乙 D.乙〉丙〉甲B三类物质的性质酸碱盐1、和酸碱指示剂作用2、酸 + 活泼金属 →盐 + H2 3、酸 + 金属氧化物 →盐 + 水4、酸 + 碱 → 盐 + 水5、酸 + 盐 → 新酸 +新 盐
(生成物有一种沉淀或者气体) 酸的性质(HCl、H2SO4) 碱的性质
1、和酸碱指示剂的作用
2、碱 + 酸性氧化物→ 盐 + 水
3、碱 + 酸 → 盐 + 水
4、碱 + 盐 → 碱 + 盐 1、盐 + 金属 →盐 + 金属
2、盐 + 酸 → 盐 + 酸
3、盐 + 碱 → 盐 + 碱
4、盐1 + 盐2 →盐1+ 盐2盐的性质 盐在水溶液中没有共同的离子,因此
盐没有通性,但也有相似的化学性质。Cl - :
SO4 2- :
CO3 2- :
NH4 + :AgNO3 和稀HNO3Ba(NO3)2和 稀HNO3HCl 和 石灰水碱和湿润的红色石蕊试纸
四大离子鉴定 五大化肥 氮肥
磷肥
钾肥
复合肥
微量元素肥料
(叶)(根)(茎)六大物质分类 金属、
金属氧化物、
非金属氧化物、
酸、
碱、
盐、
单质
化合物
金属
非金属氧化物
酸
碱
盐金属氧化物
非金属氧化物纯
净
物七大常见物质 HCl H2SO4 HNO3
NaOH Ca(OH)2 NH3·H2O
Na2CO3
八大沉淀 八大反应AgCl BaSO4 BaCO3 CaCO3 Ag2CO3
Mg(OH) 2 Fe(OH)3 Cu(OH) 2
2、酸+碱 酸+金属氧化物 酸+盐
碱+盐 盐+盐
酸+金属 盐+金属
碱+非金属氧化物
复分解反应置换反应非基本反应类型1、八大沉淀中不与稀酸反应______、_____与稀酸反应产生气体 、 、 。 与稀酸反应溶解_____ _____ ______
2 、不与任何物质发生复分解反应_____ ______ ______ _____
3、制备盐方法很多,如制备FeCl2 用___________反应,制备FeCl3用___________________反应。
4、生成盐和水反应共3种:____________________
____ _____学会"归纳".提高酸+碱; 金属氧化物+酸非金属氧化物+酸1、红色固体: 2、绿色固体: 3、蓝色固体: 4、紫黑色固体: 5、淡黄色固体: 6、无色固体: 7、银白色固体: 8、黑色固体:
9、白色固体:九种颜色的物质铜,氧化铁,氢氧化铁碱式碳酸铜氢氧化铜,硫酸铜晶体高锰酸钾硫磺冰,干冰,金刚石银,铁,镁,铝等金属铁粉 C CuO MnO2 Fe3O4氯化钠,碳酸钠,氢氧化 钙,碳酸钙,硫酸铜等
CaO Ca(OH)2
2. NaCl Na2CO3
3. FeCl3 FeCl2
4. Fe(OH)3 Fe (OH)2
5. FeO Fe2O3 Fe3O4
6 .NH3 NH4
生石灰 熟石灰食盐 纯碱氯化铁 氯化亚铁氢氧化铁 氢氧化亚铁氧化亚铁 氧化铁 四氧化三铁 氨气 铵根学会"比较"1 、欲干燥二氧化碳气体,应选用
的干燥剂是( )
A.氢氧化钠固体 B.浓硫酸
C.稀硫酸 D.生石灰B练一练2 、下列复分解反应不能发生的是:A、NaCl+Na2CO3 B、Zn(OH)2+CuSO4
C、FeCl3+NaOH D、NaCl+KNO3
E、CaCl2+Na2CO3 F、Na2CO3+HNO3
G、Cu(OH)2+HCl H、NaNO3+H2SO4
I、AgCl+HNO3 J、BaCO3+H2SO4A、B、D、H、I练一练3、只用一种试剂就能将NH4Cl、NaCl、(NH4)2SO4、Na2SO4、CuSO4、FeCl3六种物质的溶液鉴别开来,这种试剂是 。练一练Ba(OH)2试一试 1.写出符合条件的反应
有沉淀.气体.水生成_______________________
有两个沉淀生成__________________________
中和反应 _______________________________
2、用CuO、Zn、H2SO4制少量Cu方法
3.过量Fe投入一定量AgNO3、Cu(NO3)2溶液中,得到固体为 ;若将Fe、Cu投入过量AgNO3溶液中 ,得到固体为___________,若Fe有剩 余,滤液中溶质为 。Ag2CO3+2HCl=2AgCl↓+H2O+CO2↑Fe Cu AgAgFe(NO3)2放飞想象对于第七章的复习,你有什么新的收获?对未来你有什么"梦想"呢?
2.掌握常见离子和物质的鉴别;
3.掌握复分解反应条件,会写出常见的化学方程式
4.培养自我归纳总结的能力和学习方法,学会从个别到一般,从一般到个别的归纳推理能力 复习目标本章的特点1、物质多
2、关系多
3、反应多
4、用途多本章可概括为:1-9字诀 1、一个关系图
2、两个“表”
3、三类物质的性质
4、四种离子鉴定
5、五种化肥
6、六大物质分类
7、七种常见物质
8、八种沉淀和反应
9、九种颜色物质
一个关系图 酸盐碱金属金属氧化物盐置换反应:
复分解反应:25非金属氧化物两个“表”1 .金属活动顺序表.2 . 酸碱盐溶解性表
K Ca Na Mg Al Zn Fe Sn Pb H Cu Hg Ag Pt Au
K Na NH4 NO3 盐可溶
Cl化物中 Ag 不溶。
SO4盐中 Ba 不溶。
CO3盐 大多沉水中。
碱中只溶K Na Ca 和Ba
下列各组金属中,金属活动顺序排列正确的是( )
①将甲投入稀H2SO4中,有气泡冒出
②将乙投入含甲的盐溶液中有甲析出
③将丙投入稀硫酸中,无现象
A.甲〉乙〉丙 B.乙〉甲〉丙
C.甲〉丙〉乙 D.乙〉丙〉甲B三类物质的性质酸碱盐1、和酸碱指示剂作用2、酸 + 活泼金属 →盐 + H2 3、酸 + 金属氧化物 →盐 + 水4、酸 + 碱 → 盐 + 水5、酸 + 盐 → 新酸 +新 盐
(生成物有一种沉淀或者气体) 酸的性质(HCl、H2SO4) 碱的性质
1、和酸碱指示剂的作用
2、碱 + 酸性氧化物→ 盐 + 水
3、碱 + 酸 → 盐 + 水
4、碱 + 盐 → 碱 + 盐 1、盐 + 金属 →盐 + 金属
2、盐 + 酸 → 盐 + 酸
3、盐 + 碱 → 盐 + 碱
4、盐1 + 盐2 →盐1+ 盐2盐的性质 盐在水溶液中没有共同的离子,因此
盐没有通性,但也有相似的化学性质。Cl - :
SO4 2- :
CO3 2- :
NH4 + :AgNO3 和稀HNO3Ba(NO3)2和 稀HNO3HCl 和 石灰水碱和湿润的红色石蕊试纸
四大离子鉴定 五大化肥 氮肥
磷肥
钾肥
复合肥
微量元素肥料
(叶)(根)(茎)六大物质分类 金属、
金属氧化物、
非金属氧化物、
酸、
碱、
盐、
单质
化合物
金属
非金属氧化物
酸
碱
盐金属氧化物
非金属氧化物纯
净
物七大常见物质 HCl H2SO4 HNO3
NaOH Ca(OH)2 NH3·H2O
Na2CO3
八大沉淀 八大反应AgCl BaSO4 BaCO3 CaCO3 Ag2CO3
Mg(OH) 2 Fe(OH)3 Cu(OH) 2
2、酸+碱 酸+金属氧化物 酸+盐
碱+盐 盐+盐
酸+金属 盐+金属
碱+非金属氧化物
复分解反应置换反应非基本反应类型1、八大沉淀中不与稀酸反应______、_____与稀酸反应产生气体 、 、 。 与稀酸反应溶解_____ _____ ______
2 、不与任何物质发生复分解反应_____ ______ ______ _____
3、制备盐方法很多,如制备FeCl2 用___________反应,制备FeCl3用___________________反应。
4、生成盐和水反应共3种:____________________
____ _____学会"归纳".提高酸+碱; 金属氧化物+酸非金属氧化物+酸1、红色固体: 2、绿色固体: 3、蓝色固体: 4、紫黑色固体: 5、淡黄色固体: 6、无色固体: 7、银白色固体: 8、黑色固体:
9、白色固体:九种颜色的物质铜,氧化铁,氢氧化铁碱式碳酸铜氢氧化铜,硫酸铜晶体高锰酸钾硫磺冰,干冰,金刚石银,铁,镁,铝等金属铁粉 C CuO MnO2 Fe3O4氯化钠,碳酸钠,氢氧化 钙,碳酸钙,硫酸铜等
CaO Ca(OH)2
2. NaCl Na2CO3
3. FeCl3 FeCl2
4. Fe(OH)3 Fe (OH)2
5. FeO Fe2O3 Fe3O4
6 .NH3 NH4
生石灰 熟石灰食盐 纯碱氯化铁 氯化亚铁氢氧化铁 氢氧化亚铁氧化亚铁 氧化铁 四氧化三铁 氨气 铵根学会"比较"1 、欲干燥二氧化碳气体,应选用
的干燥剂是( )
A.氢氧化钠固体 B.浓硫酸
C.稀硫酸 D.生石灰B练一练2 、下列复分解反应不能发生的是:A、NaCl+Na2CO3 B、Zn(OH)2+CuSO4
C、FeCl3+NaOH D、NaCl+KNO3
E、CaCl2+Na2CO3 F、Na2CO3+HNO3
G、Cu(OH)2+HCl H、NaNO3+H2SO4
I、AgCl+HNO3 J、BaCO3+H2SO4A、B、D、H、I练一练3、只用一种试剂就能将NH4Cl、NaCl、(NH4)2SO4、Na2SO4、CuSO4、FeCl3六种物质的溶液鉴别开来,这种试剂是 。练一练Ba(OH)2试一试 1.写出符合条件的反应
有沉淀.气体.水生成_______________________
有两个沉淀生成__________________________
中和反应 _______________________________
2、用CuO、Zn、H2SO4制少量Cu方法
3.过量Fe投入一定量AgNO3、Cu(NO3)2溶液中,得到固体为 ;若将Fe、Cu投入过量AgNO3溶液中 ,得到固体为___________,若Fe有剩 余,滤液中溶质为 。Ag2CO3+2HCl=2AgCl↓+H2O+CO2↑Fe Cu AgAgFe(NO3)2放飞想象对于第七章的复习,你有什么新的收获?对未来你有什么"梦想"呢?
同课章节目录
