质量守恒定律
图片预览





文档简介
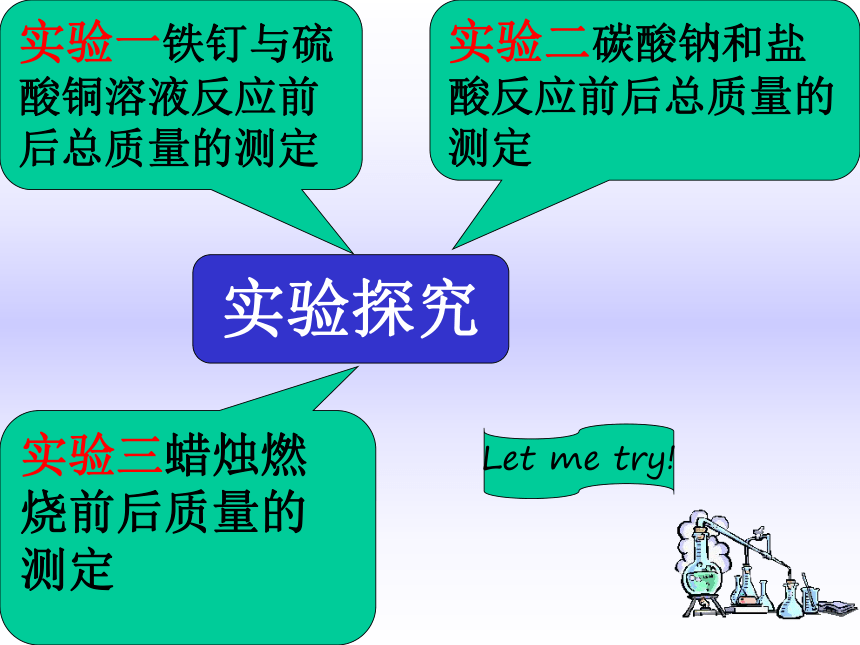
课件22张PPT。5.1 质量守恒定律实验探究实验一铁钉与硫酸铜溶液反应前后总质量的测定
实验二碳酸钠和盐酸反应前后总质量的测定
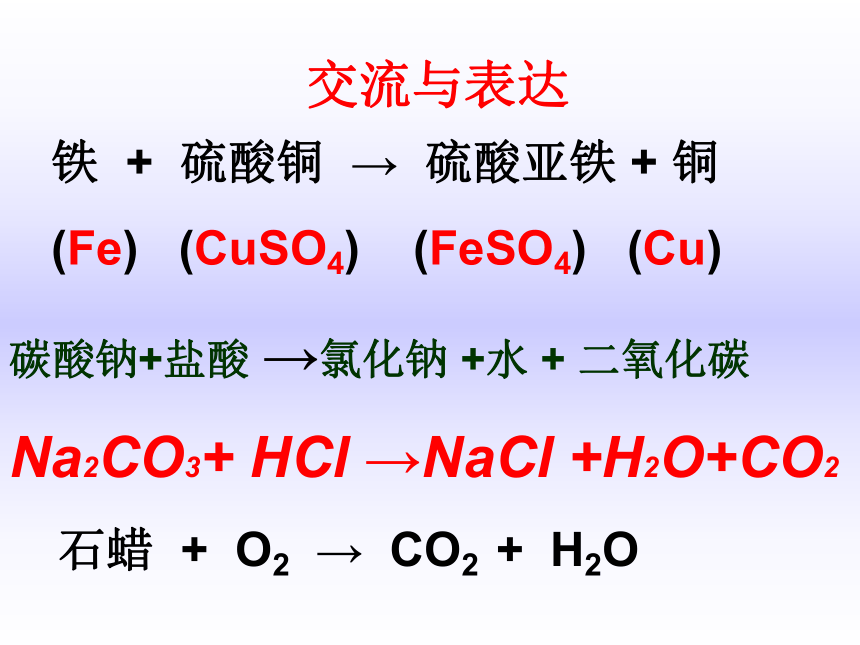
实验三蜡烛燃烧前后质量的测定Let me try!交流与表达铁 + 硫酸铜 → 硫酸亚铁 + 铜
(Fe) (CuSO4) (FeSO4) (Cu)石蜡 + O2 → CO2 + H2O碳酸钠+盐酸 →氯化钠 +水 + 二氧化碳
Na2CO3+ HCl →NaCl +H2O+CO2质量守恒定律:
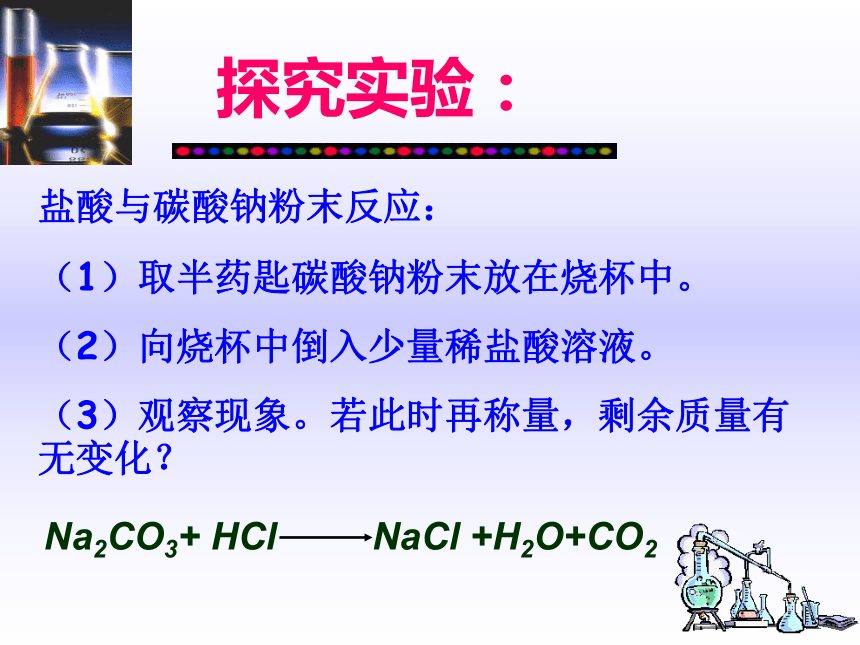
参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和,这个规律就叫质量守恒定律这是从上面实验得出的结果! 证据1 查阅资料拉瓦锡使用的实验仪器法国伟大的科学家拉瓦锡早在18世纪就围绕这个问题进行了研究,并做出了科学结论探究实验:盐酸与碳酸钠粉末反应:
(1)取半药匙碳酸钠粉末放在烧杯中。
(2)向烧杯中倒入少量稀盐酸溶液。
(3)观察现象。若此时再称量,剩余质量有无变化?Na2CO3+ HCl NaCl +H2O+CO2探究实验:请你设计一个实验装置,使盐酸与碳酸钠粉末的反应能验证质量守恒定律,即让反应后天平继续保持平衡。
先按分组讨论出方案,再画出实验装置图。
实验装置可选择实验台左上角的一些仪器来组装,也可任选实验室中其它仪器或生活中的所有器具。
探究实验:可选仪器探究实验:装置:探究实验:蜡烛燃烧装置:化学反应中为什么质量守恒呢通电2H2O O2 2H2证据2 理论解释1.广告中宣传的水加入催化剂即可变成汽油,即
H2O C8H18 可行吗?
2.光合作用的过程为:
H2O + CO2 淀粉 + O2
则淀粉中一定含有 元素
催化剂 光 照C 、H3、KMnO4 受热分解后,剩余固体质量与反应前KMnO4 的质量相比是否改变?请用质量守恒定律解释。
加热KMnO4 K2MnO4 +MnO2+O24、 将79克KMnO4 受热完全分解后,剩余
固体为71克,则同时生成氧气的质量
为 g。
5、铁在O2中燃烧,生成物质量与参加
反应的铁的质量相比较,固体质量是否
发生改变?解释原因。86. 已知:A + B C + D 将10克A物质与足量的B物质充分反应后,生成4克C物质和8克D物质,则参加反应的A和B的质量比为( )
5:1如果设计在密闭容器中进行实验,杜绝反应系统与环境之间的物质交换,天平指针就不会偏转了。无论是密闭还是敞口系统,质量守恒的规律都客观存在。1673年,英国化学家波义耳就是在一只敞口容器中加热金属,结果与质量守恒擦肩而过。 本节总结要求同学们掌握三方面的内容:
质量守恒定律涵义;
能利用分子、原子的观点来解释质量守恒的原因;
质量守恒定律的应用。
谢谢
实验二碳酸钠和盐酸反应前后总质量的测定
实验三蜡烛燃烧前后质量的测定Let me try!交流与表达铁 + 硫酸铜 → 硫酸亚铁 + 铜
(Fe) (CuSO4) (FeSO4) (Cu)石蜡 + O2 → CO2 + H2O碳酸钠+盐酸 →氯化钠 +水 + 二氧化碳
Na2CO3+ HCl →NaCl +H2O+CO2质量守恒定律:
参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和,这个规律就叫质量守恒定律这是从上面实验得出的结果! 证据1 查阅资料拉瓦锡使用的实验仪器法国伟大的科学家拉瓦锡早在18世纪就围绕这个问题进行了研究,并做出了科学结论探究实验:盐酸与碳酸钠粉末反应:
(1)取半药匙碳酸钠粉末放在烧杯中。
(2)向烧杯中倒入少量稀盐酸溶液。
(3)观察现象。若此时再称量,剩余质量有无变化?Na2CO3+ HCl NaCl +H2O+CO2探究实验:请你设计一个实验装置,使盐酸与碳酸钠粉末的反应能验证质量守恒定律,即让反应后天平继续保持平衡。
先按分组讨论出方案,再画出实验装置图。
实验装置可选择实验台左上角的一些仪器来组装,也可任选实验室中其它仪器或生活中的所有器具。
探究实验:可选仪器探究实验:装置:探究实验:蜡烛燃烧装置:化学反应中为什么质量守恒呢通电2H2O O2 2H2证据2 理论解释1.广告中宣传的水加入催化剂即可变成汽油,即
H2O C8H18 可行吗?
2.光合作用的过程为:
H2O + CO2 淀粉 + O2
则淀粉中一定含有 元素
催化剂 光 照C 、H3、KMnO4 受热分解后,剩余固体质量与反应前KMnO4 的质量相比是否改变?请用质量守恒定律解释。
加热KMnO4 K2MnO4 +MnO2+O24、 将79克KMnO4 受热完全分解后,剩余
固体为71克,则同时生成氧气的质量
为 g。
5、铁在O2中燃烧,生成物质量与参加
反应的铁的质量相比较,固体质量是否
发生改变?解释原因。86. 已知:A + B C + D 将10克A物质与足量的B物质充分反应后,生成4克C物质和8克D物质,则参加反应的A和B的质量比为( )
5:1如果设计在密闭容器中进行实验,杜绝反应系统与环境之间的物质交换,天平指针就不会偏转了。无论是密闭还是敞口系统,质量守恒的规律都客观存在。1673年,英国化学家波义耳就是在一只敞口容器中加热金属,结果与质量守恒擦肩而过。 本节总结要求同学们掌握三方面的内容:
质量守恒定律涵义;
能利用分子、原子的观点来解释质量守恒的原因;
质量守恒定律的应用。
谢谢
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
