铝金属材料
图片预览







文档简介
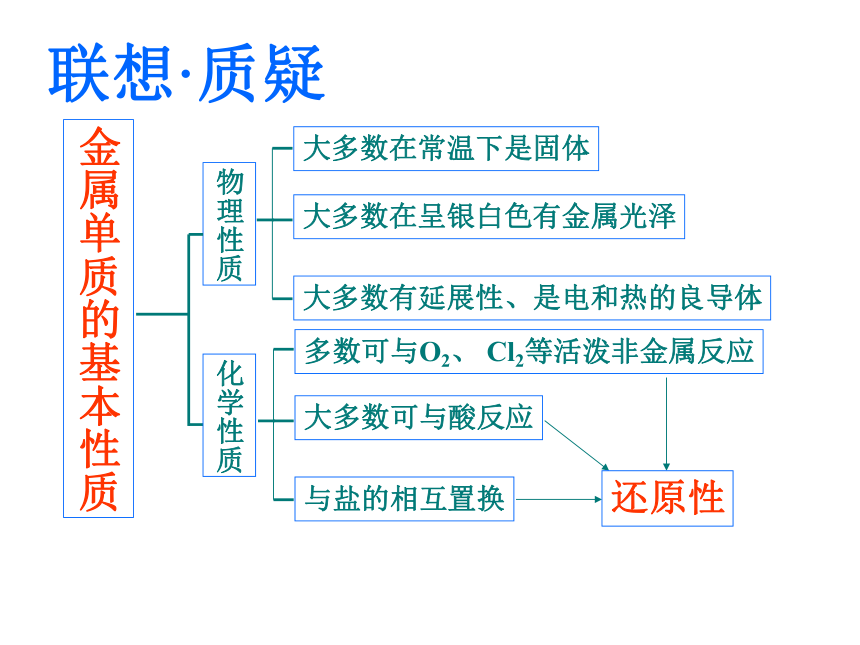
课件29张PPT。普通高中课程标准实验教科书 化学1(必修)第四章第二节 铝 金属材料广饶一中 李佐庆联想·质疑金属单质的基本性质一、铝〖问题探究〗铝的化学性质1、铝与非金属反应表面形成氧化膜,失去
光泽,铝具有搞腐蚀性剧烈反应,发光放热4Al + 3O2 = 2Al2O3 剧烈反应,冒白烟加热反应,生成白色固体2、与酸反应与盐酸、稀硫酸发生置换反应:
2Al +6H+=2Al3++3H2↑
铝在冷的浓硫酸、浓硝酸中发生钝化〖课后思考〗
由铁锌镁铝四金属中的两种组成的混合物10g,与足量
的盐酸反应产生标准状况下的氢气为11.2L,则混合物
中一定含有的金属是 。Al3、铝热反应—— 铝与某些金属氧
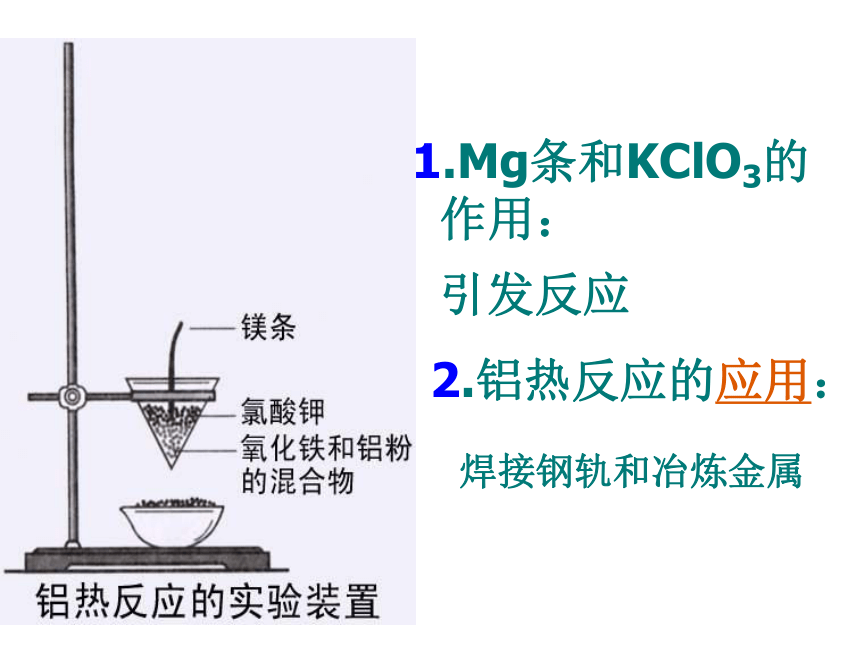
化物的反应[实验]课本116页,实验2铝热反应的实质是什么?铝作还原剂的置换反应1.Mg条和KClO3的
作用:引发反应2.铝热反应的应用:焊接钢轨和冶炼金属(3)铝与碱反应2Al+2NaOH+6H2O===2Na[Al(OH) 4]+3H2↑(还原剂)(氧化剂) 指出上面反应的氧化剂和还原剂?
四羟基合铝酸钠用铝制的器皿盛放或蒸煮酸碱性食物
可以么?身边的化学1.取两份铝粉,一份投入足量浓氢氧化钠溶液中,一份投入足量盐酸中,充分反应,产生等量氢气。则两份铝粉的质量之比为:
A. 1: 2 B. 1: 3
C. 3 : 2 D. 1 : 1你会做吗?2.除去镁粉中混有的少量铝粉,可选
用下列溶液中的:
A 盐酸 B 硝酸
C 浓氢氧化钾溶液 D 氨水3.某无色透明的溶液,放入铝粉后有氢
气产生,则一定可以在该溶液中存在
的离子是:A. Na+ B. Mg2+
C. S2- D.HCO3- A二.铝的化合物
1.氧化铝物理性质:
色 溶于水,熔点很高,故可
做耐高温材料,例如,有氧化铝坩埚。白难氧化铝的化学性质①与酸反应:Al2O3+6HCl=2AlCl3+3H2OAl2O3+6H+=2Al3++3H2O②与强碱反应:Al2O3+2NaOH+3H2O===2Na[Al(OH)4]Al2O3+2OH-+3H2O===2[Al(OH)4]-___两性氧化物2.Al(OH) 3(1)[制备]Al3+ +3 NH 3 · H2O =Al(OH) 3 ↓+ 3 NH 4+ (2)[物理性质]用铝盐溶液与氨水反应:不溶于水的白色胶状物,有吸附性,可作净水剂?(3).氢氧化铝Al(OH)3)的化学性质①与酸反应:Al(OH)3+3HCl=AlCl3+3H2OAl(OH)3+3H+=Al3++3H2O②与强碱反应:Al(OH)3+NaOH=Na[Al(OH)4]Al(OH)3+OH-===[Al(OH)4]-----两性氢氧化物③加热分解:开动脑筋,想一想! 若实验室要制取Al(OH)3,有下列两
种方法,你会选择哪种? 为什么? ①向AlCl3溶液中加NaOH溶液②向AlCl3溶液中加氨水Al2(SO4)3+6NH3?H2O=2Al(OH)3?+3(NH4)2SO4Al3++3NH3?H2O=Al(OH)3?+3NH4+知识拓展1.盐酸滴入Na[Al(OH)4]中2.NaOH溶液滴入AlCl3溶液中有何现象?写出化学方程式有何现象?写出化学方程式能否画出相应的图像很难奥铝三角 Al3+Al(OH)3[Al (OH)4]-3OH-OH-4OH-H+3H+
4H+练习: 1.下列物质既能与NaOH溶液反应,又
能与稀盐酸反应的是:Mg B.Al(OH)3
C.NaHCO3 D.Na2CO3 2. 向50ml 2mol.L-1的AlCl3溶液中
加入一定量的1mol.L-1NaOH溶液,最
终得沉淀质量为3.9g,则加入的NaOH
溶液的体积可能为 。150ml或350ml ①把AlCl3溶液逐滴滴入到NaOH溶液中②把NaOH溶液逐滴滴入到AlCl3 溶液中请问上面两种操作各有什么现象?
你能画出课后思考氧化膜
密度小
氧化膜
三、金属材料铝 铝制品金属 金属材料黑色金属材料 有色金属材料不锈钢 金银铜及其它
有色金属材料钢铁的用途金的用途银的用途铜的用途
光泽,铝具有搞腐蚀性剧烈反应,发光放热4Al + 3O2 = 2Al2O3 剧烈反应,冒白烟加热反应,生成白色固体2、与酸反应与盐酸、稀硫酸发生置换反应:
2Al +6H+=2Al3++3H2↑
铝在冷的浓硫酸、浓硝酸中发生钝化〖课后思考〗
由铁锌镁铝四金属中的两种组成的混合物10g,与足量
的盐酸反应产生标准状况下的氢气为11.2L,则混合物
中一定含有的金属是 。Al3、铝热反应—— 铝与某些金属氧
化物的反应[实验]课本116页,实验2铝热反应的实质是什么?铝作还原剂的置换反应1.Mg条和KClO3的
作用:引发反应2.铝热反应的应用:焊接钢轨和冶炼金属(3)铝与碱反应2Al+2NaOH+6H2O===2Na[Al(OH) 4]+3H2↑(还原剂)(氧化剂) 指出上面反应的氧化剂和还原剂?
四羟基合铝酸钠用铝制的器皿盛放或蒸煮酸碱性食物
可以么?身边的化学1.取两份铝粉,一份投入足量浓氢氧化钠溶液中,一份投入足量盐酸中,充分反应,产生等量氢气。则两份铝粉的质量之比为:
A. 1: 2 B. 1: 3
C. 3 : 2 D. 1 : 1你会做吗?2.除去镁粉中混有的少量铝粉,可选
用下列溶液中的:
A 盐酸 B 硝酸
C 浓氢氧化钾溶液 D 氨水3.某无色透明的溶液,放入铝粉后有氢
气产生,则一定可以在该溶液中存在
的离子是:A. Na+ B. Mg2+
C. S2- D.HCO3- A二.铝的化合物
1.氧化铝物理性质:
色 溶于水,熔点很高,故可
做耐高温材料,例如,有氧化铝坩埚。白难氧化铝的化学性质①与酸反应:Al2O3+6HCl=2AlCl3+3H2OAl2O3+6H+=2Al3++3H2O②与强碱反应:Al2O3+2NaOH+3H2O===2Na[Al(OH)4]Al2O3+2OH-+3H2O===2[Al(OH)4]-___两性氧化物2.Al(OH) 3(1)[制备]Al3+ +3 NH 3 · H2O =Al(OH) 3 ↓+ 3 NH 4+ (2)[物理性质]用铝盐溶液与氨水反应:不溶于水的白色胶状物,有吸附性,可作净水剂?(3).氢氧化铝Al(OH)3)的化学性质①与酸反应:Al(OH)3+3HCl=AlCl3+3H2OAl(OH)3+3H+=Al3++3H2O②与强碱反应:Al(OH)3+NaOH=Na[Al(OH)4]Al(OH)3+OH-===[Al(OH)4]-----两性氢氧化物③加热分解:开动脑筋,想一想! 若实验室要制取Al(OH)3,有下列两
种方法,你会选择哪种? 为什么? ①向AlCl3溶液中加NaOH溶液②向AlCl3溶液中加氨水Al2(SO4)3+6NH3?H2O=2Al(OH)3?+3(NH4)2SO4Al3++3NH3?H2O=Al(OH)3?+3NH4+知识拓展1.盐酸滴入Na[Al(OH)4]中2.NaOH溶液滴入AlCl3溶液中有何现象?写出化学方程式有何现象?写出化学方程式能否画出相应的图像很难奥铝三角 Al3+Al(OH)3[Al (OH)4]-3OH-OH-4OH-H+3H+
4H+练习: 1.下列物质既能与NaOH溶液反应,又
能与稀盐酸反应的是:Mg B.Al(OH)3
C.NaHCO3 D.Na2CO3 2. 向50ml 2mol.L-1的AlCl3溶液中
加入一定量的1mol.L-1NaOH溶液,最
终得沉淀质量为3.9g,则加入的NaOH
溶液的体积可能为 。150ml或350ml ①把AlCl3溶液逐滴滴入到NaOH溶液中②把NaOH溶液逐滴滴入到AlCl3 溶液中请问上面两种操作各有什么现象?
你能画出课后思考氧化膜
密度小
氧化膜
三、金属材料铝 铝制品金属 金属材料黑色金属材料 有色金属材料不锈钢 金银铜及其它
有色金属材料钢铁的用途金的用途银的用途铜的用途
