定量测定实验方案的设计
图片预览



文档简介
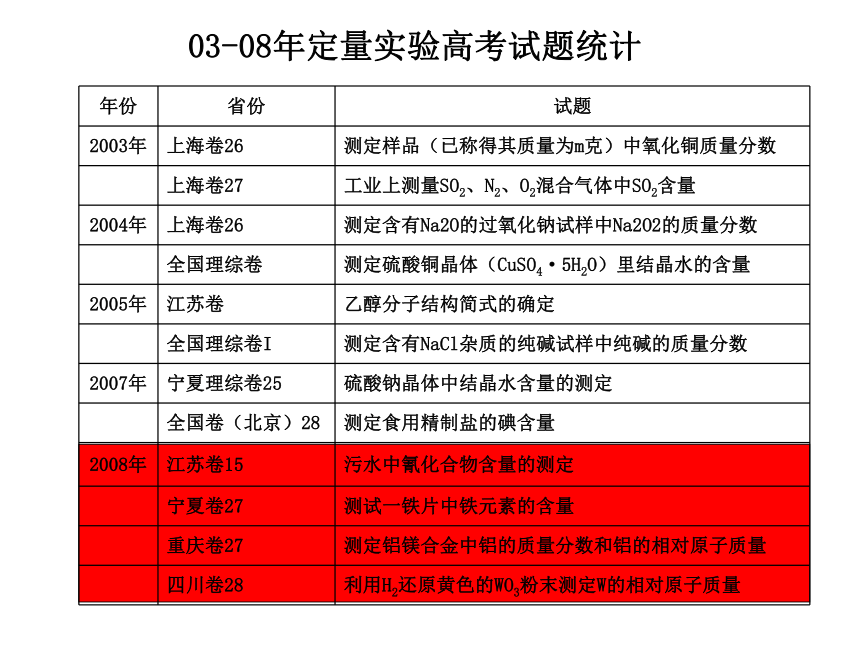
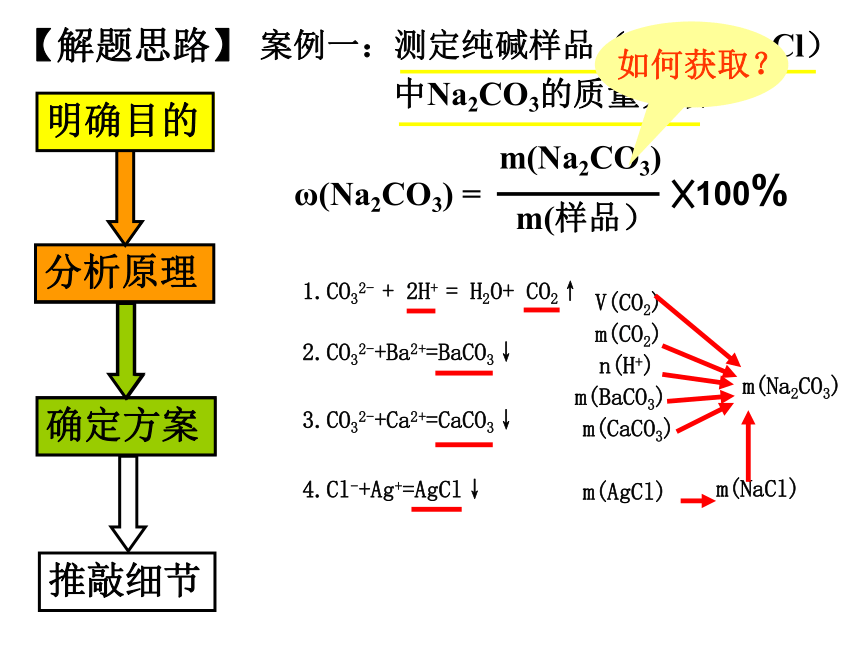
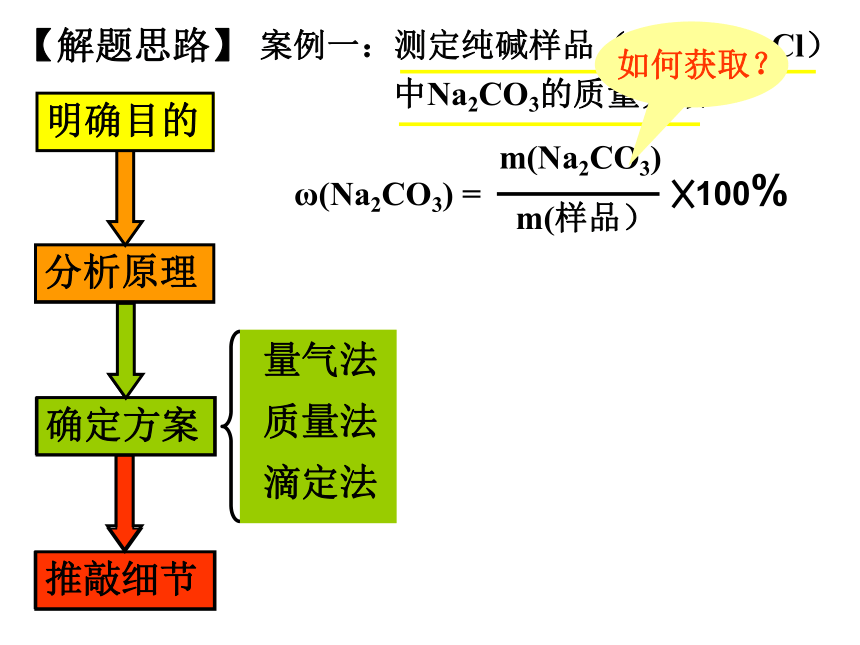
课件20张PPT。定量测定实验方案的设计03-08年定量实验高考试题统计 明确目的【解题思路】案例一:测定纯碱样品(含杂质NaCl)
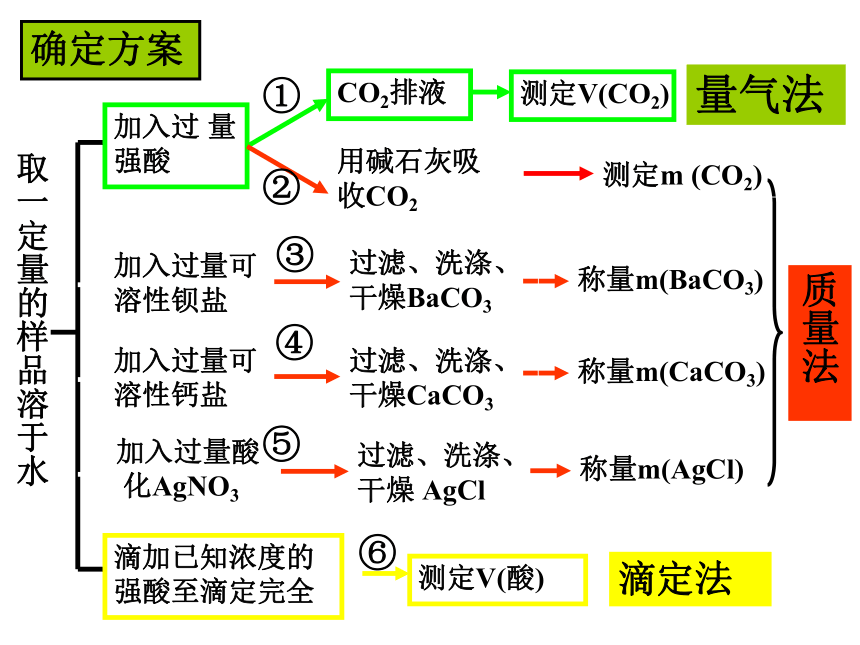
中Na2CO3的质量分数ω(Na2CO3) =3.CO32-+Ca2+=CaCO3↓ 2.CO32-+Ba2+=BaCO3↓1.CO32- + 2H+ = H2O+ CO2↑4.Cl-+Ag+=AgCl↓ 取一定量的样品溶于水加入过 量强酸量气法加入过量可溶性钡盐加入过量可溶性钙盐加入过量酸
化AgNO3滴加已知浓度的强酸至滴定完全滴定法质量法① ② ③ ④ ⑤ ⑥ 确定方案明确目的【解题思路】案例一:测定纯碱样品(含杂质NaCl)
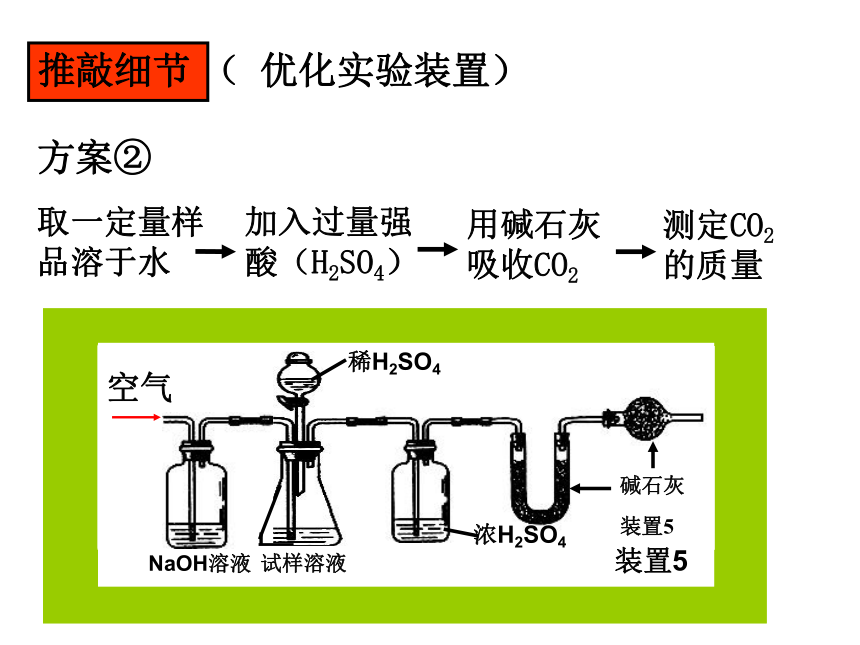
中Na2CO3的质量分数ω(Na2CO3) =推敲细节( 优化实验装置)试样溶液加压空气?主要实验步骤如下:
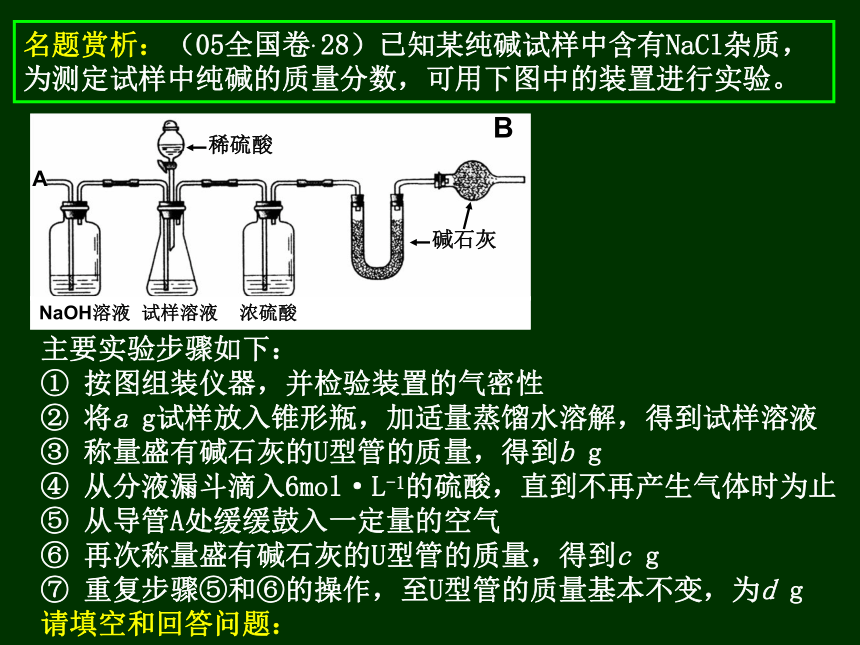
① 按图组装仪器,并检验装置的气密性
② 将a g试样放入锥形瓶,加适量蒸馏水溶解,得到试样溶液
③ 称量盛有碱石灰的U型管的质量,得到b g
④ 从分液漏斗滴入6mol·L-1的硫酸,直到不再产生气体时为止
⑤ 从导管A处缓缓鼓入一定量的空气
⑥ 再次称量盛有碱石灰的U型管的质量,得到c g
⑦ 重复步骤⑤和⑥的操作,至U型管的质量基本不变,为d g
请填空和回答问题: 名题赏析:(05全国卷.28)已知某纯碱试样中含有NaCl杂质,为测定试样中纯碱的质量分数,可用下图中的装置进行实验。B⑺ 还可以用其它实验方法测定试样中纯碱的质量分数。请简述一种不同的实验方法: 取一定量的纯碱试样,溶于适量的蒸馏水中,加入过量的BaCl2溶液,过滤、洗涤、干燥、称量滤渣(BaCO3)。质量法根据原理:Na2CO3 + BaCl2=BaCO3↓+2NaCl
取一定量的纯碱试样,与足量的稀硫酸反应,用排饱和NaHCO3溶液的方法测定生成的CO2体积 。量气法大于偏小将平衡管缓缓下移至左右液面相平读数时,切记“同温、同压、平视”明确目的【解题思路】案例一:测定纯碱样品(含杂质NaCl)
中Na2CO3的质量分数ω(Na2CO3) =案例二:某活动小组欲测定 (NH4)2Fe(SO4)2.xH2O(硫酸亚铁铵晶体)中x的值,经讨论有多种实验测定方案.
可供选用的试剂如下:
① amol.L-1BaCl2 溶液 ② bmol.L-1 NaOH溶液
③ cmol.L-1稀H2SO4溶液 ④ dmol.L-1酸性KMnO4溶液(已知:5Fe2+ + MnO4- + 8H+= 5Fe3++ Mn2+ + 4H2O,当酸性高锰酸钾溶液稍过量,反应后的混合液的颜色立即变成粉红色)
请根据提供的实验试剂,选择简约、可行的实验测定方案,简要写出第二步以后的实验步骤和实验结果。
实验步骤:第一步:称取mg样品,放入锥形瓶中,加适量水溶解得样品溶液
第二步:……
计算样品中x的表达式:____________实验目的明确目的【解题思路】案例二:测定(NH4)2Fe(SO4)2.xH2O
(硫酸亚铁铵晶体)中x的值案例二:某活动小组欲测定 (NH4)2Fe(SO4)2.xH2O(硫酸亚铁铵晶体)中x的值,经讨论有多种实验测定方案.
可供选用的试剂如下:
① amol.L-1BaCl2 溶液 ② bmol.L-1 NaOH溶液
③ cmol.L-1稀H2SO4溶液 ④ dmol.L-1酸性KMnO4溶液(已知:5Fe2+ + MnO4- + 8H+= 5Fe3++ Mn2+ + 4H2O,当酸性高锰酸钾溶液稍过量,反应后的混合液的颜色立即变成粉红色)
请根据提供的实验试剂,选择简约、可行的实验测定方案,简要写出第二步以后的实验步骤和实验结果。
实验步骤:第一步:称取mg样品,放入锥形瓶中,加适量水溶解得样品溶液
第二步:……
计算样品中x的表达式:____________明确目的【解题思路】案例二:测定(NH4)2Fe(SO4)2.xH2O
(硫酸亚铁铵晶体)中x的值⑴ Ba2+ + SO42- = BaSO4↓
⑵ NH4+ + OH- = NH3↑+ H2O
⑶ 5Fe2+ + MnO4- + 8H+ =5Fe3++
Mn2+ + 4H2O? BaSO4NH3MnO4-明确目的【解题思路】案例二:测定(NH4)2Fe(SO4)2.xH2O
(硫酸亚铁铵晶体)中x的值⑴ Ba2+ + SO42- = BaSO4↓
⑵ NH4+ + OH- = NH3↑+ H2O
⑶ 5Fe2+ + MnO4- + 8H+ =5Fe3++
Mn2+ + 4H2O? BaSO4NH3MnO4-往样品溶液中加入过量NaOH溶液,加热并干燥NH3后用c mol.L-1稀H2SO4吸收,测定NH3的质量。样品溶液用dmol/l酸性KMnO4溶液滴定至
滴定终点。消耗酸性KMnO4溶液b mL。案例二:测定(NH4)2Fe(SO4)2.xH2O中x的值方案1:方案2:方案3:从化学实验方案设计的基本要求比较以上三方案,方案3的优点体现在哪里? 实验步骤:
第一步:称取((NH4)2Fe(SO4)2.xH2O)样品mg,放入250ml锥形瓶中,加适量水溶解样品
第二步:
计算样品中x的表达式:____________简要写出第二步以后的实验步骤和实验结果.
可供选用的试剂:
① amol.L-1 BaCl2 溶液 ② bmol. L-1 NaOH溶液 ③ cmol.L-1稀H2SO4溶液
④ dmol.L-1酸性KMnO4溶液 用dmol/l酸性KMnO4溶液滴定至滴定终点。消耗酸性KMnO4溶液b mL。 KMnO4 5Fe2+ 5 (NH4)2Fe(SO4)2.xH2O
1 mol 5(284+18x) g
(d . b. 10-3 )mol n g实验方案设计的基本要求
科学性
安全性
可行性
简约性 常见定量测定实验:
1.混合物质量分数测定
2.结晶水含量的测定
3.一定物质的量浓度溶液的配制
4.酸碱中和滴定
5.镀锌铁皮锌镀层厚度的测定
6.相对分子(原子)质量测定
7.中和热测定课堂小结:明确实验目的 分析实验原理
(根据物质特性与题设条件) 推敲实验细节
(减小偶然误差 ) 确定实验方案
(获得实验数据的途径) 谢谢大家
中Na2CO3的质量分数ω(Na2CO3) =3.CO32-+Ca2+=CaCO3↓ 2.CO32-+Ba2+=BaCO3↓1.CO32- + 2H+ = H2O+ CO2↑4.Cl-+Ag+=AgCl↓ 取一定量的样品溶于水加入过 量强酸量气法加入过量可溶性钡盐加入过量可溶性钙盐加入过量酸
化AgNO3滴加已知浓度的强酸至滴定完全滴定法质量法① ② ③ ④ ⑤ ⑥ 确定方案明确目的【解题思路】案例一:测定纯碱样品(含杂质NaCl)
中Na2CO3的质量分数ω(Na2CO3) =推敲细节( 优化实验装置)试样溶液加压空气?主要实验步骤如下:
① 按图组装仪器,并检验装置的气密性
② 将a g试样放入锥形瓶,加适量蒸馏水溶解,得到试样溶液
③ 称量盛有碱石灰的U型管的质量,得到b g
④ 从分液漏斗滴入6mol·L-1的硫酸,直到不再产生气体时为止
⑤ 从导管A处缓缓鼓入一定量的空气
⑥ 再次称量盛有碱石灰的U型管的质量,得到c g
⑦ 重复步骤⑤和⑥的操作,至U型管的质量基本不变,为d g
请填空和回答问题: 名题赏析:(05全国卷.28)已知某纯碱试样中含有NaCl杂质,为测定试样中纯碱的质量分数,可用下图中的装置进行实验。B⑺ 还可以用其它实验方法测定试样中纯碱的质量分数。请简述一种不同的实验方法: 取一定量的纯碱试样,溶于适量的蒸馏水中,加入过量的BaCl2溶液,过滤、洗涤、干燥、称量滤渣(BaCO3)。质量法根据原理:Na2CO3 + BaCl2=BaCO3↓+2NaCl
取一定量的纯碱试样,与足量的稀硫酸反应,用排饱和NaHCO3溶液的方法测定生成的CO2体积 。量气法大于偏小将平衡管缓缓下移至左右液面相平读数时,切记“同温、同压、平视”明确目的【解题思路】案例一:测定纯碱样品(含杂质NaCl)
中Na2CO3的质量分数ω(Na2CO3) =案例二:某活动小组欲测定 (NH4)2Fe(SO4)2.xH2O(硫酸亚铁铵晶体)中x的值,经讨论有多种实验测定方案.
可供选用的试剂如下:
① amol.L-1BaCl2 溶液 ② bmol.L-1 NaOH溶液
③ cmol.L-1稀H2SO4溶液 ④ dmol.L-1酸性KMnO4溶液(已知:5Fe2+ + MnO4- + 8H+= 5Fe3++ Mn2+ + 4H2O,当酸性高锰酸钾溶液稍过量,反应后的混合液的颜色立即变成粉红色)
请根据提供的实验试剂,选择简约、可行的实验测定方案,简要写出第二步以后的实验步骤和实验结果。
实验步骤:第一步:称取mg样品,放入锥形瓶中,加适量水溶解得样品溶液
第二步:……
计算样品中x的表达式:____________实验目的明确目的【解题思路】案例二:测定(NH4)2Fe(SO4)2.xH2O
(硫酸亚铁铵晶体)中x的值案例二:某活动小组欲测定 (NH4)2Fe(SO4)2.xH2O(硫酸亚铁铵晶体)中x的值,经讨论有多种实验测定方案.
可供选用的试剂如下:
① amol.L-1BaCl2 溶液 ② bmol.L-1 NaOH溶液
③ cmol.L-1稀H2SO4溶液 ④ dmol.L-1酸性KMnO4溶液(已知:5Fe2+ + MnO4- + 8H+= 5Fe3++ Mn2+ + 4H2O,当酸性高锰酸钾溶液稍过量,反应后的混合液的颜色立即变成粉红色)
请根据提供的实验试剂,选择简约、可行的实验测定方案,简要写出第二步以后的实验步骤和实验结果。
实验步骤:第一步:称取mg样品,放入锥形瓶中,加适量水溶解得样品溶液
第二步:……
计算样品中x的表达式:____________明确目的【解题思路】案例二:测定(NH4)2Fe(SO4)2.xH2O
(硫酸亚铁铵晶体)中x的值⑴ Ba2+ + SO42- = BaSO4↓
⑵ NH4+ + OH- = NH3↑+ H2O
⑶ 5Fe2+ + MnO4- + 8H+ =5Fe3++
Mn2+ + 4H2O? BaSO4NH3MnO4-明确目的【解题思路】案例二:测定(NH4)2Fe(SO4)2.xH2O
(硫酸亚铁铵晶体)中x的值⑴ Ba2+ + SO42- = BaSO4↓
⑵ NH4+ + OH- = NH3↑+ H2O
⑶ 5Fe2+ + MnO4- + 8H+ =5Fe3++
Mn2+ + 4H2O? BaSO4NH3MnO4-往样品溶液中加入过量NaOH溶液,加热并干燥NH3后用c mol.L-1稀H2SO4吸收,测定NH3的质量。样品溶液用dmol/l酸性KMnO4溶液滴定至
滴定终点。消耗酸性KMnO4溶液b mL。案例二:测定(NH4)2Fe(SO4)2.xH2O中x的值方案1:方案2:方案3:从化学实验方案设计的基本要求比较以上三方案,方案3的优点体现在哪里? 实验步骤:
第一步:称取((NH4)2Fe(SO4)2.xH2O)样品mg,放入250ml锥形瓶中,加适量水溶解样品
第二步:
计算样品中x的表达式:____________简要写出第二步以后的实验步骤和实验结果.
可供选用的试剂:
① amol.L-1 BaCl2 溶液 ② bmol. L-1 NaOH溶液 ③ cmol.L-1稀H2SO4溶液
④ dmol.L-1酸性KMnO4溶液 用dmol/l酸性KMnO4溶液滴定至滴定终点。消耗酸性KMnO4溶液b mL。 KMnO4 5Fe2+ 5 (NH4)2Fe(SO4)2.xH2O
1 mol 5(284+18x) g
(d . b. 10-3 )mol n g实验方案设计的基本要求
科学性
安全性
可行性
简约性 常见定量测定实验:
1.混合物质量分数测定
2.结晶水含量的测定
3.一定物质的量浓度溶液的配制
4.酸碱中和滴定
5.镀锌铁皮锌镀层厚度的测定
6.相对分子(原子)质量测定
7.中和热测定课堂小结:明确实验目的 分析实验原理
(根据物质特性与题设条件) 推敲实验细节
(减小偶然误差 ) 确定实验方案
(获得实验数据的途径) 谢谢大家
同课章节目录
- 专题一 物质的分离与提纯
- 课题1 海带中碘元素的分离及检验
- 拓展课题1-1 茶叶中某些元素的鉴定
- 课题2 用纸层析法分离铁离子和铜离子
- 拓展课题1-2 菠菜的叶绿体中色素的提取和分离
- 拓展课题1-3 用粉笔进行层析分离
- 课题3 硝酸钾晶体的制备
- 拓展课题1-4 粗盐提纯
- 专题二 物质性质的研究
- 课题1 铝及其化合物的性质
- 拓展课题2-1 铝热反应
- 课题2 乙醇和苯酚的性质
- 拓展课题2-2 苯酚与甲醛的反应
- 专题三 物质的检验与鉴别
- 课题1 牙膏和火柴中某些成分的检验
- 拓展课题3-1 新装修居室内空气中甲醛浓度的检测
- 拓展课题3-2 汽车尾气成分的检验
- 课题2 亚硝酸钠和食盐的鉴别
- 拓展课题3-3 真假碘盐的鉴别
- 专题四 化学反应条件的控制
- 课题1 硫代硫酸钠与酸反应速率的影响因素
- 拓展课题4-1 “蓝瓶子”实验
- 课题2 催化剂对过氧化氢分解反应速率的影响
- 拓展课题4-2 过氧化氢酶的催化作用
- 拓展课题4-3 蔗糖的燃烧
- 课题3 反应条件对化学平衡的影响
- 拓展课题4-4 淀粉与碘显色现象的探究
- 拓展课题4-5 压强对化学平衡的影响
- 专题五 电化学问题研究
- 课题1 原电池
- 拓展课题5-1 干电池模拟实验
- 课题2 电解与电镀
- 拓展课题5-2 阿伏加德罗常数的测定
- 专题六 物质的定量分析
- 课题1 食醋总酸含量的测定
- 拓展课题6-1 配制并标定氢氧化钠溶液
- 课题2 镀锌铁皮锌镀层厚度的测定
- 拓展课题6-2 水果中维生素C含量的测定
- 专题七 物质的制备与合成
- 课题1 硫酸亚铁铵的制备
- 拓展课题7-1 用制氢废液制备硫酸锌晶体
- 课题2 阿司匹林的合成
- 拓展课题7-2 对氨基苯磺酸的合成
