原子的构成
图片预览





文档简介
课件23张PPT。课题1 原子的构成
第四单元
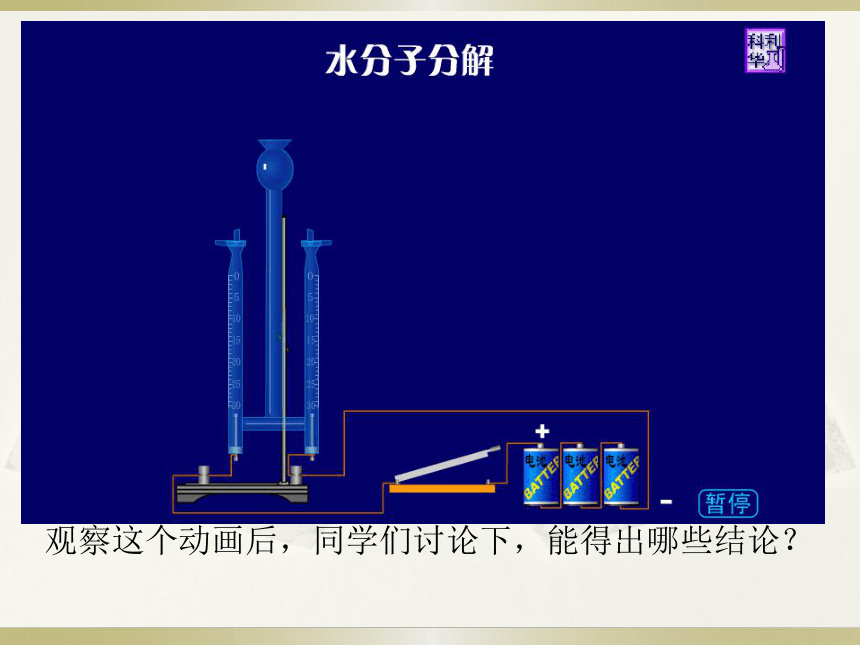
物质构成的奥秘观察这个动画后,同学们讨论下,能得出哪些结论?一、原子的构成讨论题1.原子是由哪几部分构成的?
2.原子核是由哪些粒子构成的?这些粒子有什么不同?
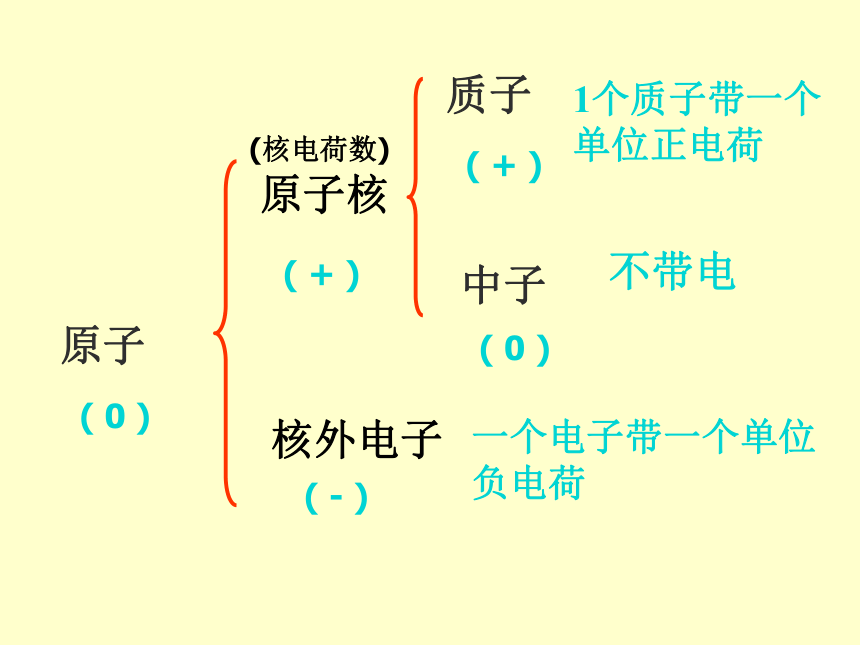
3.原子核和核外电子都带电,为什么整个原子不显电性?原子原子核核外电子质子中子1个质子带一个单位正电荷不带电一个电子带一个单位负电荷( 0 )( + )( - )( + )( 0 )(核电荷数)3. 不同种类的原子,核内质子数不同,核外
电子数也不同2. 核电荷数=质子数=核外电子数
(但不一定等于中子数) 由于质子数等于核外电子数,正电荷总数等于
负电荷总数,所以整个原子不显电性。1. 原子一般都是由质子、中子、核外电子构 成,但并不是所有原子里都有中子 。在原子中
(1)质子数 核外电子总数 核电荷数
(2)由于质子所带的正电荷与电子所带的负电荷电性相反、电量相等.因此:_________________________
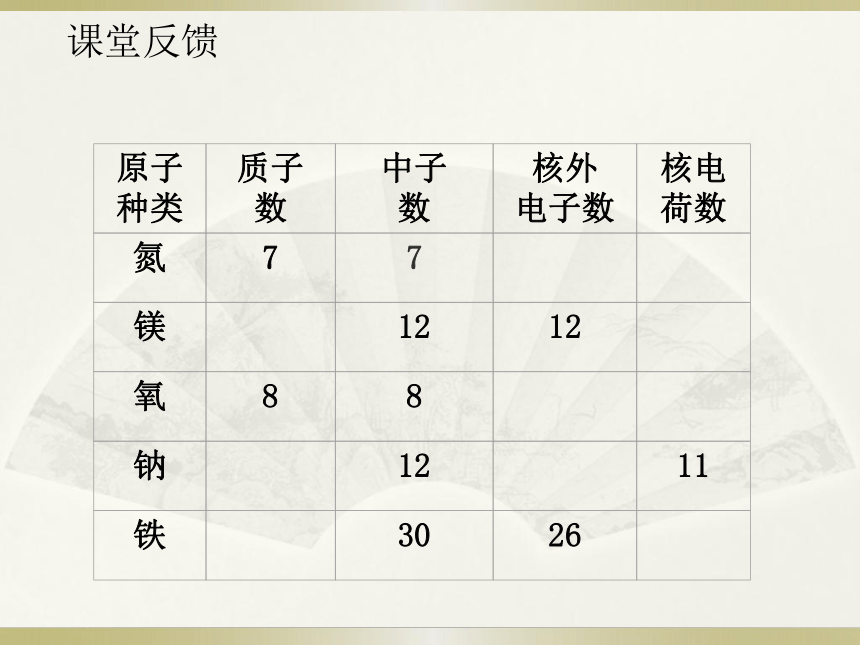
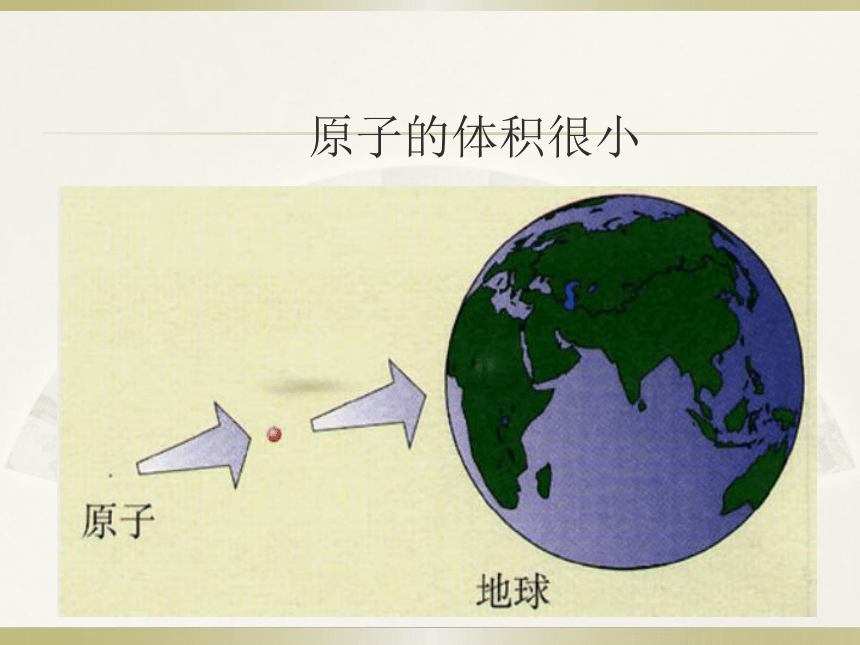
(3) 所有原子都由质子、中子、电子构成这种说法对不对. ____原子不显电性或呈电中性。错==课堂反馈原子的体积很小 约10-10 m10-15 m~10-14 m(5)画龙点睛,人文鼓励近代科学原子论(1803年)一切物质都是由最小的不能再分的粒子——原子构成。
原子模型:原子是坚实的、不可再分的实心球。英国化学家道尔顿
(J.Dalton , 1766~1844)原子并不是构成物质的最小微粒 ——汤姆生发现了电子(1897年)电子是种带负电、有一定质量的微粒,普遍存在于各种原子之中。
汤姆生原子模型:原子是一个平均分布着正电荷的粒子,其中镶嵌着许多电子,中和了电荷,从而形成了中性原子。英国物理学家汤姆生
(J.J.Thomson ,1856~1940)α粒子散射实验(1909年) ——原子有核卢瑟福和他的助手做了著名α粒子散射实验。根据实验,卢瑟福在1911年提出原子有核模型。
卢瑟福原子模型(又称行星原子模型):原子是由居于原子中心的带正电的原子核和核外带负电的电子构成。原子核的质量几乎等于原子的全部质量,电子在原子核外空间绕核做高速运动。英国科学家卢瑟福
(E.Rutherford,1871~1937)玻尔原子模型(1913年)玻尔借助诞生不久的量子理论改进了卢瑟福的模型。
玻尔原子模型(又称分层模型):当原子只有一个电子时,电子沿特定球形轨道运转;当原子有多个电子时,它们将分布在多个球壳中绕核运动。
不同的电子运转轨道是具有一定级差的稳定轨道。
丹麦物理学家玻尔
(N.Bohr,1885~1962)电子云模型 (现代物质结构学说)现代科学家们在实验中发现,电子在原子核周围有的区域出现的次数多,有的区域出现的次数少,就像“云雾”笼罩在原子核周围。因而提出了“电子云模型”。
电子云密度大的地方,表明电子在核外单位体积内出现的机会多,反之,出现的机会少。说明:由于原子的质量数值太小,书写和使用都不方便,所以采用相对原子质量.几种原子的质量:二、相对原子质量1.概念 ------以一种碳原子质量的1/12为标准,其他原子的质量跟它相比较所得到的比,作为这种原子的相对原子质量(符号Ar)
某原子的实际质量碳原子质量 × 1/122.计算公式:某原子的相对原子质量=——————练习: 已知1个碳原子的质量是1.993×10-26Kg,一个氧原子的质量是2.657×10-26Kg,求氧原子的相对原子质量?标准=1.993×10-26Kg×1/12=1.66×10-27Kg氧原子的相对原子质量=1.66×10-27Kg2.657×10-26Kg=16答:氧原子的相对原子质量是16。解:3.相对原子质量与原子实际质量的关系
(1) 相对原子质量________原子的实际质量
(2) 原子实际质量越大,它的相对原子质量数值:
(3)相对原子质量的单位是:
原子实际质量的单位是:
不等于越大“1”千克。(是个比值)4.原子的质量(1) 原子的质量主要集中在原子核里(即由质子和中子决定)(2) 相对原子质量=质子数 + 中子数1. 原子的相对原子质量( )
A.是原子的实际质量
B.可以用千克作单位
C.没有单位
D.是原子间质量之比,单位为1,一般不写
相对原子质量可以从书中P153的附录Ⅱ查到,
下面我们举行一项比赛,看看哪位同学查阅相对
原子质量表既快又准。我们查阅如下几种元素的
相对原子质量: 磷、铝、氮、碳、钠、硫、镁、钙
物质构成的奥秘观察这个动画后,同学们讨论下,能得出哪些结论?一、原子的构成讨论题1.原子是由哪几部分构成的?
2.原子核是由哪些粒子构成的?这些粒子有什么不同?
3.原子核和核外电子都带电,为什么整个原子不显电性?原子原子核核外电子质子中子1个质子带一个单位正电荷不带电一个电子带一个单位负电荷( 0 )( + )( - )( + )( 0 )(核电荷数)3. 不同种类的原子,核内质子数不同,核外
电子数也不同2. 核电荷数=质子数=核外电子数
(但不一定等于中子数) 由于质子数等于核外电子数,正电荷总数等于
负电荷总数,所以整个原子不显电性。1. 原子一般都是由质子、中子、核外电子构 成,但并不是所有原子里都有中子 。在原子中
(1)质子数 核外电子总数 核电荷数
(2)由于质子所带的正电荷与电子所带的负电荷电性相反、电量相等.因此:_________________________
(3) 所有原子都由质子、中子、电子构成这种说法对不对. ____原子不显电性或呈电中性。错==课堂反馈原子的体积很小 约10-10 m10-15 m~10-14 m(5)画龙点睛,人文鼓励近代科学原子论(1803年)一切物质都是由最小的不能再分的粒子——原子构成。
原子模型:原子是坚实的、不可再分的实心球。英国化学家道尔顿
(J.Dalton , 1766~1844)原子并不是构成物质的最小微粒 ——汤姆生发现了电子(1897年)电子是种带负电、有一定质量的微粒,普遍存在于各种原子之中。
汤姆生原子模型:原子是一个平均分布着正电荷的粒子,其中镶嵌着许多电子,中和了电荷,从而形成了中性原子。英国物理学家汤姆生
(J.J.Thomson ,1856~1940)α粒子散射实验(1909年) ——原子有核卢瑟福和他的助手做了著名α粒子散射实验。根据实验,卢瑟福在1911年提出原子有核模型。
卢瑟福原子模型(又称行星原子模型):原子是由居于原子中心的带正电的原子核和核外带负电的电子构成。原子核的质量几乎等于原子的全部质量,电子在原子核外空间绕核做高速运动。英国科学家卢瑟福
(E.Rutherford,1871~1937)玻尔原子模型(1913年)玻尔借助诞生不久的量子理论改进了卢瑟福的模型。
玻尔原子模型(又称分层模型):当原子只有一个电子时,电子沿特定球形轨道运转;当原子有多个电子时,它们将分布在多个球壳中绕核运动。
不同的电子运转轨道是具有一定级差的稳定轨道。
丹麦物理学家玻尔
(N.Bohr,1885~1962)电子云模型 (现代物质结构学说)现代科学家们在实验中发现,电子在原子核周围有的区域出现的次数多,有的区域出现的次数少,就像“云雾”笼罩在原子核周围。因而提出了“电子云模型”。
电子云密度大的地方,表明电子在核外单位体积内出现的机会多,反之,出现的机会少。说明:由于原子的质量数值太小,书写和使用都不方便,所以采用相对原子质量.几种原子的质量:二、相对原子质量1.概念 ------以一种碳原子质量的1/12为标准,其他原子的质量跟它相比较所得到的比,作为这种原子的相对原子质量(符号Ar)
某原子的实际质量碳原子质量 × 1/122.计算公式:某原子的相对原子质量=——————练习: 已知1个碳原子的质量是1.993×10-26Kg,一个氧原子的质量是2.657×10-26Kg,求氧原子的相对原子质量?标准=1.993×10-26Kg×1/12=1.66×10-27Kg氧原子的相对原子质量=1.66×10-27Kg2.657×10-26Kg=16答:氧原子的相对原子质量是16。解:3.相对原子质量与原子实际质量的关系
(1) 相对原子质量________原子的实际质量
(2) 原子实际质量越大,它的相对原子质量数值:
(3)相对原子质量的单位是:
原子实际质量的单位是:
不等于越大“1”千克。(是个比值)4.原子的质量(1) 原子的质量主要集中在原子核里(即由质子和中子决定)(2) 相对原子质量=质子数 + 中子数1. 原子的相对原子质量( )
A.是原子的实际质量
B.可以用千克作单位
C.没有单位
D.是原子间质量之比,单位为1,一般不写
相对原子质量可以从书中P153的附录Ⅱ查到,
下面我们举行一项比赛,看看哪位同学查阅相对
原子质量表既快又准。我们查阅如下几种元素的
相对原子质量: 磷、铝、氮、碳、钠、硫、镁、钙
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
