初三化学下学期酸碱盐的期末复习课件
文档属性
| 名称 | 初三化学下学期酸碱盐的期末复习课件 |  | |
| 格式 | rar | ||
| 文件大小 | 206.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2010-01-24 10:41:00 | ||
图片预览










文档简介
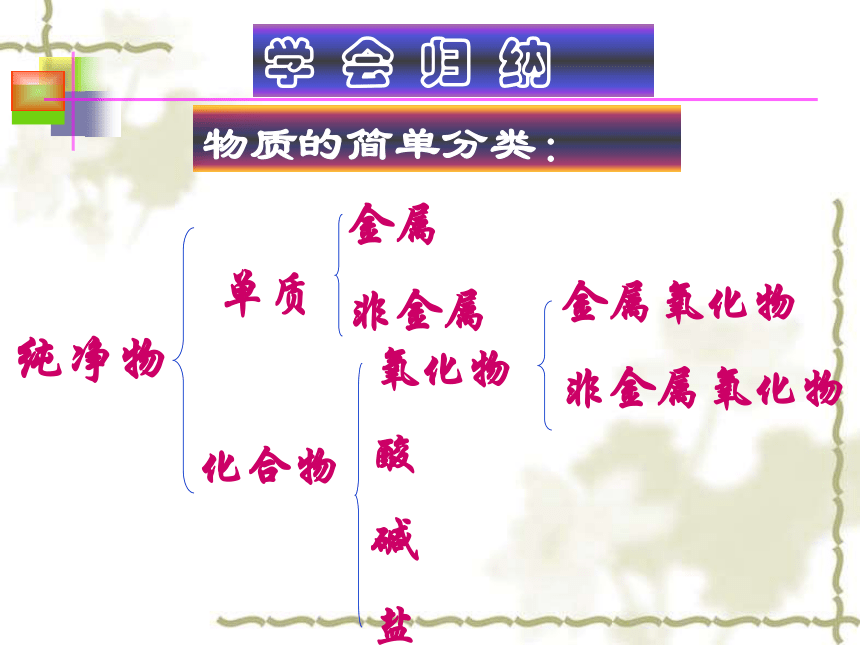
课件50张PPT。复习第五单元学 会 归 纳
单质
化合物
金属
非金属氧化物
酸
碱
盐金属氧化物
非金属氧化物物质的简单分类:纯净物酸在水溶液中电离产生的阳离子
全都是氢离子的化合物碱在水溶液中电离产生的阴离子
全都是氢氧根离子的化合物在水溶液中电离产生金属阳离子
和酸根离子的化合物盐化合物在水溶液中离解成自由
离子的过程电离酸的共性(通性):1、与指示剂反应 酸能使紫色的石蕊变红,无色酚酞不变色。4、酸 + 碱 = 盐 + 水 5、酸 + 盐 = 盐 + 酸3、酸+金属氧化物= 盐 + 水2、酸+金属 = 盐 + 氢气实际应用
1、胃酸过多的病人常服用一种叫“胃舒平”的药片来治疗,药片的主要成份是氢氧化铝,为什么能用它来治疗胃酸过多呢?
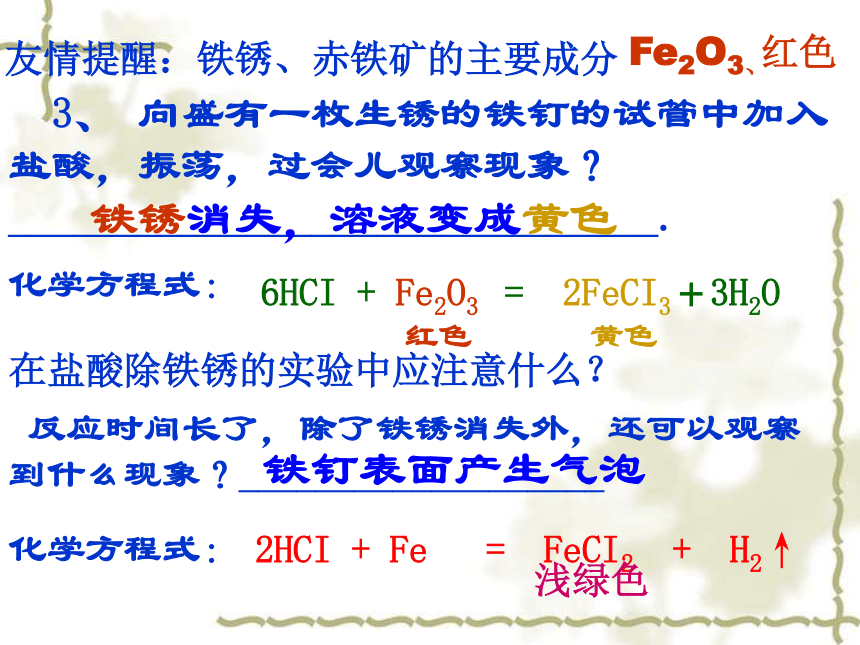
3 HCI + Al(OH)3 〓 AlCI3 + 3H2O 2、大理石、石灰石、汉白玉、水垢、鸡蛋壳(主要成分是碳酸钙)放入盛有盐酸的试管中,将生成的气体通入澄清的石灰水中,可观察到什么现象?2HCI + CaCO3 = CaCI2 + H2O + CO2↑ Ca(OH)2 + CO2 = CaCO3 ↓ + H2O 3、 向盛有一枚生锈的铁钉的试管中加入盐酸,振荡,过会儿观察现象? ______________________________. 铁锈消失,溶液变成黄色 6HCI + Fe2O3 = 2FeCI3+3H2O红色 黄色化学方程式:Fe2O3、红色在盐酸除铁锈的实验中应注意什么? 反应时间长了,除了铁锈消失外,还可以观察到什么现象?___________________ 铁钉表面产生气泡 2HCI + Fe = FeCI2 + H2↑浅绿色化学方程式: 友情提醒:铁锈、赤铁矿的主要成分4、向盛有少量氧化铜粉末的试管中加入盐酸,微微加热,观察现象?
______________________________________ 黑色粉末消失,溶液变成蓝色2HCl + CuO = CuCl2 + H2O黑色 蓝色化学方程式:5、鉴定盐酸用什么试剂?化学方程式:HCl+AgNO3 =AgCl +HNO3滴加AgNO3溶液和稀硝酸,有不溶于稀硝酸的白色沉淀回顾:硫酸有哪些性质?根据酸的共性,按照顺序写出硫酸的化学性质(五个),并写出主要的现象 酸的个性【思考与讨论】
1、三强酸敝口放置,溶液质量增加的是_____,溶液质量减小的是_____,溶质的质量分数怎样变?放置一段时间后这些酸有无变质?2、现有白纸和三种溶液(A)NaOH溶液(B)H2SO4溶液,(C)紫色石蕊试液。试设计趣味实验:先在白纸上用玻璃棒蘸 (填序号,下同) 画上花,再蘸 画上叶。用 向白纸上喷洒即可出现《“雨”落叶出红花开》。 77774、下列能表示人喝大量水时,胃液的PH
变化的曲线图是( )3、下列盐可用金属与盐酸反应制得的是
A、HgCl2 B、FeCl3
C、AlCl3 D、CuCl2
6、在一只倒扣的大烧杯中,正放着两只小烧杯, A杯中盛有足量的浓盐酸, B杯中盛有少量滴有酚酞的氢氧化钠的稀溶液
(1)放置一段时间后,
B杯中会有什么现象?
(2)该现象说明浓盐酸
有哪些性质?AB5、自来水生产中要通入氯气进行杀菌消毒,氯气与水反应的产物之一是盐酸,市场上有些不法商贩为牟取暴利,用自来水冒充纯净水出售,为辨真伪,可用下列一种化学试剂来辨别,该试剂是( )
A、酚酞试液 B、氯化钡溶液
C、氢氧化钠溶液 D、硝酸银溶液
1、一些鸡蛋壳和20%的73克稀盐酸完全反应,(1)可生成气体多少?
(2)若鸡蛋壳是80克,则鸡蛋壳中主要成份的质量分数是多少?
计算:2、铜粉和铁粉的混合物20克,加入足量的20%的硫酸溶液,待完全反应后,得到氢气0.2克,问:
(1)混合物中铁为多少克?
(2)要使混合物中的铁完全反应,至少需20%的硫酸溶液多少克?碱的共性(通性):1、与指示剂反应 碱能使紫色的石蕊变蓝,无色酚酞变红。3、碱+ 酸 = 盐 + 水 4、碱+ 盐 =碱 + 盐2、碱+非金属氧化物= 盐+水检验二氧化碳化学方程式:CO2 + Ca(OH)2 =CaCO3↓+ H2O工业上常用碱溶液来吸收有毒的酸性气体 SO2+2NaOH=Na2SO3+H2O
亚硫酸钠 用什么办法能够知道在稀盐酸和氢氧化钠溶液的中和反应过程中,酸和碱没有剩余,恰好完全反应?使用指示剂请你来叙述CuCI2 + 2NaOH = Cu(OH)2↓ + 2NaCI 蓝色 蓝色沉淀FeCI3 + 3NaOH = Fe(OH)3↓ + 3NaCI黄色 红褐色沉淀 氢氧化钙或氢氧化钠溶液不能敞口放置,为什么? CO2+2NaOH=Na2CO3+H2O什么与碱反应会生成非常好看的两种颜色的沉淀???制法:
CaO+H2O=Ca(OH)2
Na2CO3+Ca(OH)2=2NaOH+CaCO3 应用:氢氧化钠:中和石油中的酸,制肥皂。
氢氧化钙:中和土壤中的酸,制波尔多液。俗名:烧碱、火碱和苛性钠易潮解,可作某些气体的干燥剂。(H2,O2 )氢氧化钠: 碱的个性氢氧化钙:易溶,溶解放热。俗名:熟石灰、消石灰、(加水)石灰浆、石灰乳
微溶。强碱具腐蚀性 溶解时放热 碱的共性:3、下列物质能反应,但无明显现象的是
A、NaOH与HCl B、NaOH与CuSO4
C、HCl与AgNO3 D、FeCl3与NaOH1、盛石灰水的试剂瓶时间久了,内壁常附有一层白膜,要洗去这层白膜最好的方法是:
A、用水洗 B、用氢氧化钠溶液洗
C、用盐酸洗 D、先盐酸再用水洗练习2、下列气体其中能用氢氧化钠干燥的是
A、CO2 B、O2 C、SO3 D、HCl蒸馒头 Na2CO3.10H2O
易风化
CuSO4.5H2O
胆矾、蓝矾
如: CaCO3 CaO + CO2↑ 2、盐+酸→ 盐+酸 3、盐+碱→盐+碱 4、盐+盐→盐+盐5、某些盐加热能分解(NH4)2CO3 2NH3↑ + CO2↑+H2O条件盐的共性(通性): 1、盐+金属→ 盐+金属高温 NaCI+AgNO3 =AgCI↓+ NaNO3思考:收集一些汗液盛放在试管中,滴入几滴
硝酸银溶液,有什么现象产生?白色沉淀 反应方程式: 盐的水溶液的颜色
铜盐 溶液一般 呈 蓝色
铁盐溶液一般 呈 黄色
亚铁盐溶液一般呈浅绿色
高锰酸钾溶液呈紫红色
其它盐溶液一般为无色制取盐的途经:请你写出制ZnSO4的五种方法盐 的 溶解性 规律钾 钠 铵盐 硝酸盐 都可溶
盐酸盐中银不溶(AgCl)
硫酸盐中 钡 不溶(BaSO4)
碳酸盐多数都不溶
碱中钡 钙可溶
常见不溶物:CaCO3BaCO3AgClFe(OH)3Cu(OH)2BaSO4Al(OH)3 Mg(OH)2化学肥料:氮 肥磷 肥钾 肥复合肥微量元素肥NH 4HCO3 ( NH 4)2SO 4 NH 3NO 3 NH 3 ?H 2O CO(NH2)2Ca(H 2PO4)2 Ca 3(PO 4)2KCl K 2SO 4KNO3 NH 4H 2PO 4含Mn Cu Zn Mo等元素化学肥料加NaOH等碱溶液。如果产生使湿润的红色石蕊试纸变蓝的气体,则含有NH4+气体水沉淀沉淀八大沉淀.八大反应 1、AgCl BaSO4 ; BaCO3 CaCO3 ;
Mg(OH) 2 Al(OH)3 Fe(OH)3 Cu(OH) 2 2、酸+金属
盐+金属
4、碱+非金属氧化物复分解反应置换反应什么都不是 3、 酸+碱 酸+金属氧化物 酸+盐
碱+盐 盐+盐
⑴蓝 色 溶 液——
⑵黄 色 溶 液——
⑶蓝色不溶物——
⑷红褐色不溶物——
⑸白色不溶物——
(6)片状白色固体露置在空气中潮解的是——
(7)黑色粉末——
(8)红色粉末——
(9)红色光亮的金属——
(10)溶于水产生大量热——常见物质的颜色及特性
趁热打铁:
1、下列各种物质中全部能溶于水的是:
A 、H2SO4 Na2SO4 NaOH AgNO3
B 、 CuCl2 BaSO4 Mg(OH)2 FeCl2
C 、 KOH CaCO3 KNO3 Na2CO3
D 、Ba(OH)2 ZnSO4 Ca(NO3)2 (NH4)2SO4
2、判断下列各组离子能否共存:
①Cu2+ Na+ SO42- OH-
② Na+ SO42- Cl- Ba2+
③ H+ NO3- CO32- Na+
④ SO42- H+ Na+ OH-
⑤ Na+ NO3- Ba2+ CO32-
⑥Zn2+ SO42- Fe3+ Cl-
⑦Mg2+ NO3- Ba2+ OH-
⑧ k+ NO3- NO3- SO42-
3、判断下列物质能否反应,能反应的写出化学方程式:
① HCl 和 Fe ② H2SO4和Cu
③AgNO3和Cu ④AgCl和 Fe
⑤ ZnSO4和 Fe ⑥ NaOH和KCl
⑦ H2SO4和NaOH ⑧ Fe(OH)3和HCl
⑨ Cu(OH)2和 NaCl
金属的化学性质
金属+氧气=金属氧化物活泼金属+酸=盐+H2↑金属+盐=金属+盐金属的特性
有金属光泽,有导电性,导热性,延展性主要应用:一 判金属跟酸二 金属跟盐 三 金属跟氧气 金属活动性顺序:一 金属跟酸1 反应条件:(1) 排在氢前面的金属才能置换酸中的氢(2) 酸指盐酸和稀硫酸,不能用浓流酸,硝酸。(3) 生成的盐必须是可溶。AC二反应快慢程度Mg > Zn > Fe判断依据:每条曲线中,斜线越陡,说明单位时间内产生氢气多,反应快。MgZnFe2. 反应快慢比较练习3:等质量的A,B,C三种金属分别与质量相同,
质量分数也相同的稀硫酸充分反应放出氢气的情况
如下图所示:反应时间判断:1 活动性最强的金属是2 活动性最弱的金属是3 反应不再发生时,
最先用完的一种物质是()硫酸1.A2.C产生H2
质量二 金属跟盐。 1.单质金属要排在盐中金属元素前面2.盐必须是可溶性 3.K Ca Na除外。BA. Cu+2AgCl=2Ag+CuCl2B. Zn+2AgNO3=2Ag+Zn(NO3)2C. 2Na+CuSO4=Cu+Na2SO4D. 2Fe+3CuCl2=2FeCl3+3Cu练习7:将锌片投入下列盐溶液反应后,
使溶液质量减轻的是A. MgCl2B. CuCl2C. Hg (NO3)2D. Al(NO3)3反应的先后次序是:金属活动性相差越大,
置换反应越易发生。C判断金属跟混合盐溶液反应的次序。铜丝氧化:2Cu+O2====2CuO 点燃点燃加热发出白光表面变黑火星四射铁丝燃烧:镁条燃烧:3Fe+2O2====Fe3O42Mg+O2====2MgO金属铝表面易生成一层致密的氧化铝的保护膜,
它能阻止铝继续被空气氧化,但酸性和碱性物质
会破坏铝的氧化膜三、金属跟氧气 你能用几种办法来鉴别黄铜与黄金? 考考你综合练习1、离子的检验 检验Cl-或SO42-时,为什么要加稀HNO3? 答:目的是除去CO32—等杂质离子的干扰。溶液有可能同时存在Cl-和SO42-时,先检验哪种离子? 应该先检验SO42-??1、取三支试管分别装入三种少量的液体,都滴入 BaCl2溶液,有白色沉淀生成的原溶液是稀硫酸。
2、在余下的两支试管中都加入紫色石蕊试液,变红的原液即为盐酸。反之为水。步骤:鉴别盐酸、硫酸、水?食盐水与稀硫酸
烧碱溶液与石灰水请鉴别下列物质氯化钡或氢氧化钡或石蕊溶液碳酸钠或碳酸钾溶液或通入二氧化碳气体练习:例题:有一包白色粉末,可能是MgCl2、CuSO4、AgCl、BaSO4、K2CO3中的一种或几种,将白色粉末溶于水为无色溶液,当加入BaCl2溶液后有白色沉淀产生, 再加入过量盐酸,白色沉淀溶解,有气泡放出。
原混合物中一定含有______,一定不含有_______。
单质
化合物
金属
非金属氧化物
酸
碱
盐金属氧化物
非金属氧化物物质的简单分类:纯净物酸在水溶液中电离产生的阳离子
全都是氢离子的化合物碱在水溶液中电离产生的阴离子
全都是氢氧根离子的化合物在水溶液中电离产生金属阳离子
和酸根离子的化合物盐化合物在水溶液中离解成自由
离子的过程电离酸的共性(通性):1、与指示剂反应 酸能使紫色的石蕊变红,无色酚酞不变色。4、酸 + 碱 = 盐 + 水 5、酸 + 盐 = 盐 + 酸3、酸+金属氧化物= 盐 + 水2、酸+金属 = 盐 + 氢气实际应用
1、胃酸过多的病人常服用一种叫“胃舒平”的药片来治疗,药片的主要成份是氢氧化铝,为什么能用它来治疗胃酸过多呢?
3 HCI + Al(OH)3 〓 AlCI3 + 3H2O 2、大理石、石灰石、汉白玉、水垢、鸡蛋壳(主要成分是碳酸钙)放入盛有盐酸的试管中,将生成的气体通入澄清的石灰水中,可观察到什么现象?2HCI + CaCO3 = CaCI2 + H2O + CO2↑ Ca(OH)2 + CO2 = CaCO3 ↓ + H2O 3、 向盛有一枚生锈的铁钉的试管中加入盐酸,振荡,过会儿观察现象? ______________________________. 铁锈消失,溶液变成黄色 6HCI + Fe2O3 = 2FeCI3+3H2O红色 黄色化学方程式:Fe2O3、红色在盐酸除铁锈的实验中应注意什么? 反应时间长了,除了铁锈消失外,还可以观察到什么现象?___________________ 铁钉表面产生气泡 2HCI + Fe = FeCI2 + H2↑浅绿色化学方程式: 友情提醒:铁锈、赤铁矿的主要成分4、向盛有少量氧化铜粉末的试管中加入盐酸,微微加热,观察现象?
______________________________________ 黑色粉末消失,溶液变成蓝色2HCl + CuO = CuCl2 + H2O黑色 蓝色化学方程式:5、鉴定盐酸用什么试剂?化学方程式:HCl+AgNO3 =AgCl +HNO3滴加AgNO3溶液和稀硝酸,有不溶于稀硝酸的白色沉淀回顾:硫酸有哪些性质?根据酸的共性,按照顺序写出硫酸的化学性质(五个),并写出主要的现象 酸的个性【思考与讨论】
1、三强酸敝口放置,溶液质量增加的是_____,溶液质量减小的是_____,溶质的质量分数怎样变?放置一段时间后这些酸有无变质?2、现有白纸和三种溶液(A)NaOH溶液(B)H2SO4溶液,(C)紫色石蕊试液。试设计趣味实验:先在白纸上用玻璃棒蘸 (填序号,下同) 画上花,再蘸 画上叶。用 向白纸上喷洒即可出现《“雨”落叶出红花开》。 77774、下列能表示人喝大量水时,胃液的PH
变化的曲线图是( )3、下列盐可用金属与盐酸反应制得的是
A、HgCl2 B、FeCl3
C、AlCl3 D、CuCl2
6、在一只倒扣的大烧杯中,正放着两只小烧杯, A杯中盛有足量的浓盐酸, B杯中盛有少量滴有酚酞的氢氧化钠的稀溶液
(1)放置一段时间后,
B杯中会有什么现象?
(2)该现象说明浓盐酸
有哪些性质?AB5、自来水生产中要通入氯气进行杀菌消毒,氯气与水反应的产物之一是盐酸,市场上有些不法商贩为牟取暴利,用自来水冒充纯净水出售,为辨真伪,可用下列一种化学试剂来辨别,该试剂是( )
A、酚酞试液 B、氯化钡溶液
C、氢氧化钠溶液 D、硝酸银溶液
1、一些鸡蛋壳和20%的73克稀盐酸完全反应,(1)可生成气体多少?
(2)若鸡蛋壳是80克,则鸡蛋壳中主要成份的质量分数是多少?
计算:2、铜粉和铁粉的混合物20克,加入足量的20%的硫酸溶液,待完全反应后,得到氢气0.2克,问:
(1)混合物中铁为多少克?
(2)要使混合物中的铁完全反应,至少需20%的硫酸溶液多少克?碱的共性(通性):1、与指示剂反应 碱能使紫色的石蕊变蓝,无色酚酞变红。3、碱+ 酸 = 盐 + 水 4、碱+ 盐 =碱 + 盐2、碱+非金属氧化物= 盐+水检验二氧化碳化学方程式:CO2 + Ca(OH)2 =CaCO3↓+ H2O工业上常用碱溶液来吸收有毒的酸性气体 SO2+2NaOH=Na2SO3+H2O
亚硫酸钠 用什么办法能够知道在稀盐酸和氢氧化钠溶液的中和反应过程中,酸和碱没有剩余,恰好完全反应?使用指示剂请你来叙述CuCI2 + 2NaOH = Cu(OH)2↓ + 2NaCI 蓝色 蓝色沉淀FeCI3 + 3NaOH = Fe(OH)3↓ + 3NaCI黄色 红褐色沉淀 氢氧化钙或氢氧化钠溶液不能敞口放置,为什么? CO2+2NaOH=Na2CO3+H2O什么与碱反应会生成非常好看的两种颜色的沉淀???制法:
CaO+H2O=Ca(OH)2
Na2CO3+Ca(OH)2=2NaOH+CaCO3 应用:氢氧化钠:中和石油中的酸,制肥皂。
氢氧化钙:中和土壤中的酸,制波尔多液。俗名:烧碱、火碱和苛性钠易潮解,可作某些气体的干燥剂。(H2,O2 )氢氧化钠: 碱的个性氢氧化钙:易溶,溶解放热。俗名:熟石灰、消石灰、(加水)石灰浆、石灰乳
微溶。强碱具腐蚀性 溶解时放热 碱的共性:3、下列物质能反应,但无明显现象的是
A、NaOH与HCl B、NaOH与CuSO4
C、HCl与AgNO3 D、FeCl3与NaOH1、盛石灰水的试剂瓶时间久了,内壁常附有一层白膜,要洗去这层白膜最好的方法是:
A、用水洗 B、用氢氧化钠溶液洗
C、用盐酸洗 D、先盐酸再用水洗练习2、下列气体其中能用氢氧化钠干燥的是
A、CO2 B、O2 C、SO3 D、HCl蒸馒头 Na2CO3.10H2O
易风化
CuSO4.5H2O
胆矾、蓝矾
如: CaCO3 CaO + CO2↑ 2、盐+酸→ 盐+酸 3、盐+碱→盐+碱 4、盐+盐→盐+盐5、某些盐加热能分解(NH4)2CO3 2NH3↑ + CO2↑+H2O条件盐的共性(通性): 1、盐+金属→ 盐+金属高温 NaCI+AgNO3 =AgCI↓+ NaNO3思考:收集一些汗液盛放在试管中,滴入几滴
硝酸银溶液,有什么现象产生?白色沉淀 反应方程式: 盐的水溶液的颜色
铜盐 溶液一般 呈 蓝色
铁盐溶液一般 呈 黄色
亚铁盐溶液一般呈浅绿色
高锰酸钾溶液呈紫红色
其它盐溶液一般为无色制取盐的途经:请你写出制ZnSO4的五种方法盐 的 溶解性 规律钾 钠 铵盐 硝酸盐 都可溶
盐酸盐中银不溶(AgCl)
硫酸盐中 钡 不溶(BaSO4)
碳酸盐多数都不溶
碱中钡 钙可溶
常见不溶物:CaCO3BaCO3AgClFe(OH)3Cu(OH)2BaSO4Al(OH)3 Mg(OH)2化学肥料:氮 肥磷 肥钾 肥复合肥微量元素肥NH 4HCO3 ( NH 4)2SO 4 NH 3NO 3 NH 3 ?H 2O CO(NH2)2Ca(H 2PO4)2 Ca 3(PO 4)2KCl K 2SO 4KNO3 NH 4H 2PO 4含Mn Cu Zn Mo等元素化学肥料加NaOH等碱溶液。如果产生使湿润的红色石蕊试纸变蓝的气体,则含有NH4+气体水沉淀沉淀八大沉淀.八大反应 1、AgCl BaSO4 ; BaCO3 CaCO3 ;
Mg(OH) 2 Al(OH)3 Fe(OH)3 Cu(OH) 2 2、酸+金属
盐+金属
4、碱+非金属氧化物复分解反应置换反应什么都不是 3、 酸+碱 酸+金属氧化物 酸+盐
碱+盐 盐+盐
⑴蓝 色 溶 液——
⑵黄 色 溶 液——
⑶蓝色不溶物——
⑷红褐色不溶物——
⑸白色不溶物——
(6)片状白色固体露置在空气中潮解的是——
(7)黑色粉末——
(8)红色粉末——
(9)红色光亮的金属——
(10)溶于水产生大量热——常见物质的颜色及特性
趁热打铁:
1、下列各种物质中全部能溶于水的是:
A 、H2SO4 Na2SO4 NaOH AgNO3
B 、 CuCl2 BaSO4 Mg(OH)2 FeCl2
C 、 KOH CaCO3 KNO3 Na2CO3
D 、Ba(OH)2 ZnSO4 Ca(NO3)2 (NH4)2SO4
2、判断下列各组离子能否共存:
①Cu2+ Na+ SO42- OH-
② Na+ SO42- Cl- Ba2+
③ H+ NO3- CO32- Na+
④ SO42- H+ Na+ OH-
⑤ Na+ NO3- Ba2+ CO32-
⑥Zn2+ SO42- Fe3+ Cl-
⑦Mg2+ NO3- Ba2+ OH-
⑧ k+ NO3- NO3- SO42-
3、判断下列物质能否反应,能反应的写出化学方程式:
① HCl 和 Fe ② H2SO4和Cu
③AgNO3和Cu ④AgCl和 Fe
⑤ ZnSO4和 Fe ⑥ NaOH和KCl
⑦ H2SO4和NaOH ⑧ Fe(OH)3和HCl
⑨ Cu(OH)2和 NaCl
金属的化学性质
金属+氧气=金属氧化物活泼金属+酸=盐+H2↑金属+盐=金属+盐金属的特性
有金属光泽,有导电性,导热性,延展性主要应用:一 判金属跟酸二 金属跟盐 三 金属跟氧气 金属活动性顺序:一 金属跟酸1 反应条件:(1) 排在氢前面的金属才能置换酸中的氢(2) 酸指盐酸和稀硫酸,不能用浓流酸,硝酸。(3) 生成的盐必须是可溶。AC二反应快慢程度Mg > Zn > Fe判断依据:每条曲线中,斜线越陡,说明单位时间内产生氢气多,反应快。MgZnFe2. 反应快慢比较练习3:等质量的A,B,C三种金属分别与质量相同,
质量分数也相同的稀硫酸充分反应放出氢气的情况
如下图所示:反应时间判断:1 活动性最强的金属是2 活动性最弱的金属是3 反应不再发生时,
最先用完的一种物质是()硫酸1.A2.C产生H2
质量二 金属跟盐。 1.单质金属要排在盐中金属元素前面2.盐必须是可溶性 3.K Ca Na除外。BA. Cu+2AgCl=2Ag+CuCl2B. Zn+2AgNO3=2Ag+Zn(NO3)2C. 2Na+CuSO4=Cu+Na2SO4D. 2Fe+3CuCl2=2FeCl3+3Cu练习7:将锌片投入下列盐溶液反应后,
使溶液质量减轻的是A. MgCl2B. CuCl2C. Hg (NO3)2D. Al(NO3)3反应的先后次序是:金属活动性相差越大,
置换反应越易发生。C判断金属跟混合盐溶液反应的次序。铜丝氧化:2Cu+O2====2CuO 点燃点燃加热发出白光表面变黑火星四射铁丝燃烧:镁条燃烧:3Fe+2O2====Fe3O42Mg+O2====2MgO金属铝表面易生成一层致密的氧化铝的保护膜,
它能阻止铝继续被空气氧化,但酸性和碱性物质
会破坏铝的氧化膜三、金属跟氧气 你能用几种办法来鉴别黄铜与黄金? 考考你综合练习1、离子的检验 检验Cl-或SO42-时,为什么要加稀HNO3? 答:目的是除去CO32—等杂质离子的干扰。溶液有可能同时存在Cl-和SO42-时,先检验哪种离子? 应该先检验SO42-??1、取三支试管分别装入三种少量的液体,都滴入 BaCl2溶液,有白色沉淀生成的原溶液是稀硫酸。
2、在余下的两支试管中都加入紫色石蕊试液,变红的原液即为盐酸。反之为水。步骤:鉴别盐酸、硫酸、水?食盐水与稀硫酸
烧碱溶液与石灰水请鉴别下列物质氯化钡或氢氧化钡或石蕊溶液碳酸钠或碳酸钾溶液或通入二氧化碳气体练习:例题:有一包白色粉末,可能是MgCl2、CuSO4、AgCl、BaSO4、K2CO3中的一种或几种,将白色粉末溶于水为无色溶液,当加入BaCl2溶液后有白色沉淀产生, 再加入过量盐酸,白色沉淀溶解,有气泡放出。
原混合物中一定含有______,一定不含有_______。
同课章节目录
- 第一单元 溶液
- 1 溶液的形成
- 2 溶液组成的定量表示
- 3物质的溶解性
- 到实验室去:配制一定溶质质量分数的溶液
- 第二单元 常见的酸和碱
- 1 酸及其性质
- 2 碱及其性质
- 3 溶液的酸碱性
- 4 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 到图书馆去:分子变成离子
- 第三单元 海水中的化学
- 1 海洋化学资源
- 2 海水“晒盐”
- 3 海水“制碱”
- 到实验室去:粗盐中难溶性杂质的去除
- 第四单元 金属
- 1 常见的金属材料
- 2 金属的化学性质
- 3 钢铁的锈蚀与防护
- 到实验室去:探究金属的性质
- 第五单元 化学与健康
- 1 食物中的有机物
- 2 化学元素与人体健康
- 3 远离有毒物质
- 第六单元 化学与社会发展
- 1 化学与能源开发
- 2 化学与材料研制
- 3 化学与农业生产
- 4 化学与环境保护
