物质的量
图片预览



文档简介
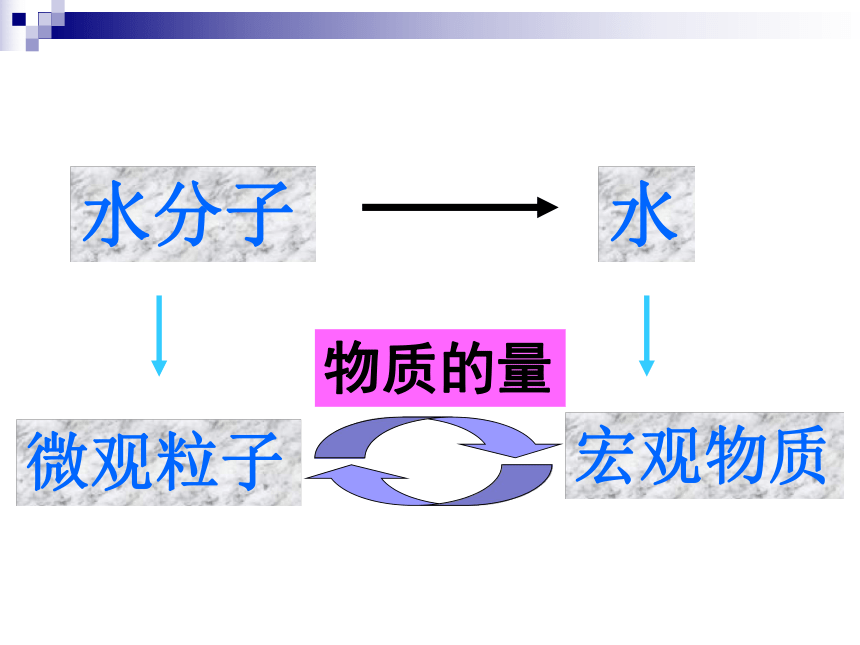
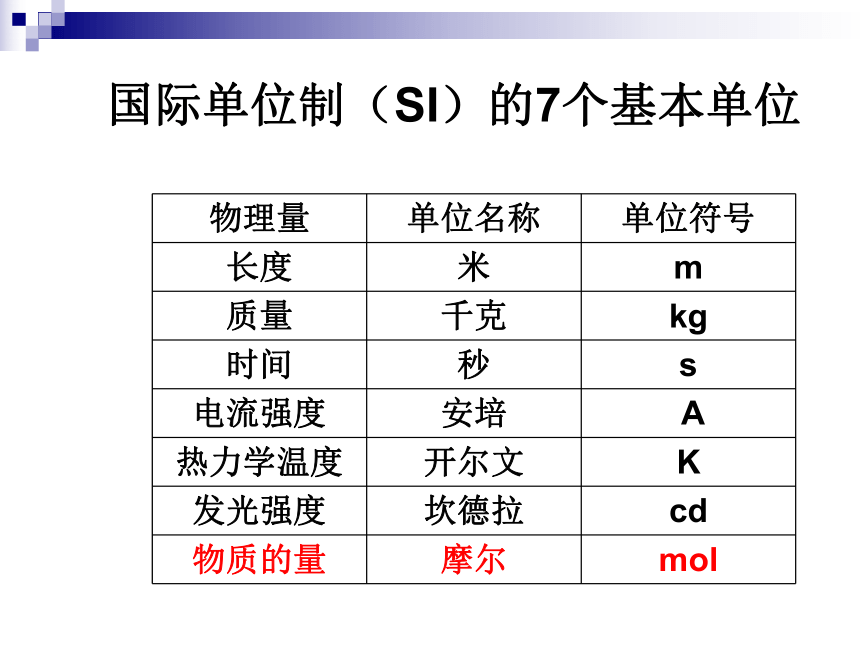
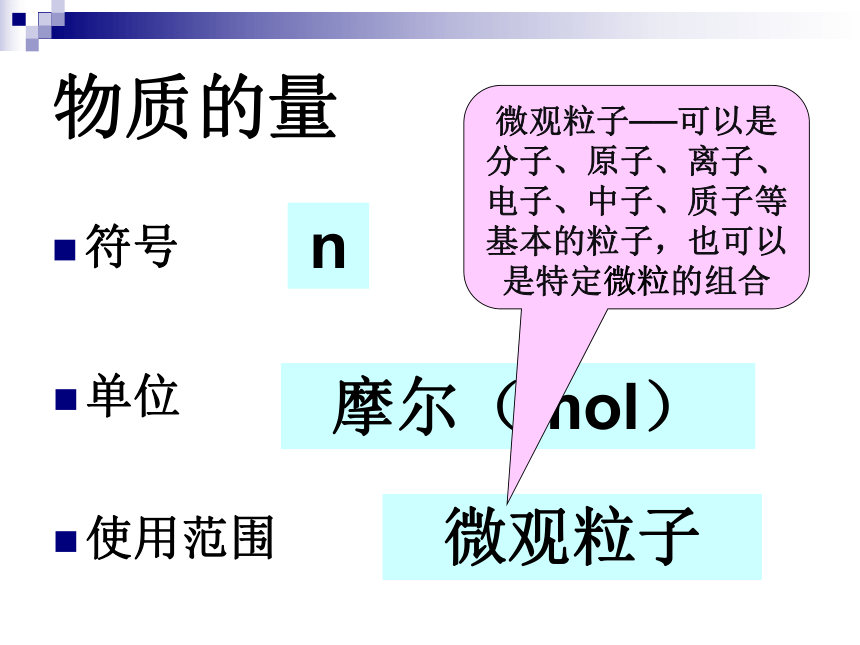
课件13张PPT。物质的量第一章第二节 化学计量在实验中的应用思考水是由水分子构成的,那18g水含有多少个水分子呢??水分子微观粒子宏观物质水物质的量国际单位制(SI)的7个基本单位物质的量含义物质的量是一个物理量,表示含有一定数目粒子的集合体是一个整体,不是“物质量”,也不是“物质的质量”物质的量符号n摩尔(mol)单位使用范围微观粒子微观粒子──可以是分子、原子、离子、电子、中子、质子等基本的粒子,也可以是特定微粒的组合练习判断下列说法是否正确,并说明理由
1 mol 氧
0.25 mol CO2
摩尔为7个基本物理量之一
3 mol NH3中含有3 mol N原子和9 mol H原子使用摩尔作单位时,应用化学式(符号)指明粒子种类,而不能使用中文名称。
摩尔—物质的量的单位生活中将12个表示成一打科学上,物质的量用约6.02×1023个微观粒子看成一个整体,表示成1mol宏观微观12g12C中所含的碳原子数目:摩尔—物质的量的单位为什么要用6.02×1023?阿伏加德罗常数定义:1mol任何粒子的粒子数叫做阿伏加 德罗常数。符号:NA近似值: 6.02×1023单位:mol-16.02×1023练习1mol是( )个粒子的集合体
1 mol O中约含有( )个O;
3 mol H2SO4 中约有( )个H2SO4 ,可以电离出( ) mol H+;
4 mol O2含有( ) mol O原子, ( )mol质子;
10 mol Na+中约含有( )个Na+6.02×10233×6.02×1023686410×6.02×1023约6.02×1023n、N、NA的关系物质的量(n)、粒子数(N)、阿伏加德罗常数(NA)之间的关系:
1 mol 氧
0.25 mol CO2
摩尔为7个基本物理量之一
3 mol NH3中含有3 mol N原子和9 mol H原子使用摩尔作单位时,应用化学式(符号)指明粒子种类,而不能使用中文名称。
摩尔—物质的量的单位生活中将12个表示成一打科学上,物质的量用约6.02×1023个微观粒子看成一个整体,表示成1mol宏观微观12g12C中所含的碳原子数目:摩尔—物质的量的单位为什么要用6.02×1023?阿伏加德罗常数定义:1mol任何粒子的粒子数叫做阿伏加 德罗常数。符号:NA近似值: 6.02×1023单位:mol-16.02×1023练习1mol是( )个粒子的集合体
1 mol O中约含有( )个O;
3 mol H2SO4 中约有( )个H2SO4 ,可以电离出( ) mol H+;
4 mol O2含有( ) mol O原子, ( )mol质子;
10 mol Na+中约含有( )个Na+6.02×10233×6.02×1023686410×6.02×1023约6.02×1023n、N、NA的关系物质的量(n)、粒子数(N)、阿伏加德罗常数(NA)之间的关系:
