第二章第一节 脂肪烃
图片预览




文档简介
本资料来自于资源最齐全的21世纪教育网www.21cnjy.com
教 案
课题:第二章 第一节 脂肪烃(1) 授课班级
课 时
教学目的 知识与技能 了解烷烃、烯烃和炔烃的物理性质的规律性变化了解烷烃、烯烃、炔烃的结构特点
过程与方法 注意不同类型脂肪烃的结构和性质的对比善于运用形象生动的实物、模型、计算机课件等手段帮助学生理解概念、掌握概念、学会方法、形成能力
情感态度价值观 根据有机物的结果和性质,培养学习有机物的基本方法“结构决定性质、性质反映结构”的思想
重 点 烯烃的结构特点和化学性质
难 点 烯烃的顺反异构
知识结构与板书设计 第二章 烃和卤代烃 第一节 脂肪烃一、烷烃(alkane)和烯烃(alkene)1、结构特点和通式:(1) 烷烃:仅含C—C键和C—H键的饱和链烃,又叫烷烃。(若C—C连成环状,称为环烷烃。)通式:CnH2n+2 (n≥1)(2) 烯烃:分子里含有一个碳碳双键的不饱和链烃叫做烯烃。(分子里含有两个双键的链烃叫做二烯烃)通式:CnH2n (n≥2)2、物理性质(1) 物理性质随着分子中碳原子数的递增,呈规律性变化,沸点逐渐升高,相对密度逐渐增大;(2) 碳原子数相同时,支链越多,熔沸点越低。(3) 常温下的存在状态,也由气态(n≤4)逐渐过渡到液态(5≤n≤16)、固态(17≤n)。(4) 烃的密度比水小,不溶于水,易溶于有机溶剂。3、基本反应类型(1) 取代反应(substitution reaction):有机物分子里的某些原子或原子团被其他原子或原子团所取代的反应。如烃的卤代反应。(2) 加成反应(addition reaction):有机物分子中双键(叁键)两端的碳原子与其他原子或原子团所直接结合生成新的化合物的反应。如不饱和碳原子与H2、X2、H2O的加成。(3) 聚合反应(polymerization reaction):由相对分子质量小的化合物分子结合成相对分子质量较大的高分子化合物的反应。如加聚反应、缩聚反应。4、烷烃化学性质(与甲烷相似)烷烃不能使酸性高锰酸钾溶液和溴水褪色(1)取代反应:CH3CH3 + Cl2 →CH3CH2Cl + HCl(2)氧化反应:CnH2n+2 + — O2 → nCO2 +(n+1)H2O5、烯烃的化学性质(与乙烯相似)(1)加成反应(2)氧化反应 燃烧:CnH2n+O2n CO2 + n H2O 使酸性KMnO4 溶液褪色:R—CH=CH2R—COOH + CO2 + R3—COOH 催化氧化:2R—CH=CH2 + O2 2RCH3 在臭氧和锌粉的作用下, + (3) 加聚反应6、二烯烃的化学性质(1)二烯烃的加成反应:(1,4一加成反应是主要的)(2) 加聚反应: n CH2=CHCH=CH2 (顺丁橡胶)n (聚异戊二烯)CH2=CHCH=CH2 +2Br2 CH2BrCHBrCHBrCH2Br
教学过程
教学步骤、内容 教学方法、手段、师生活动
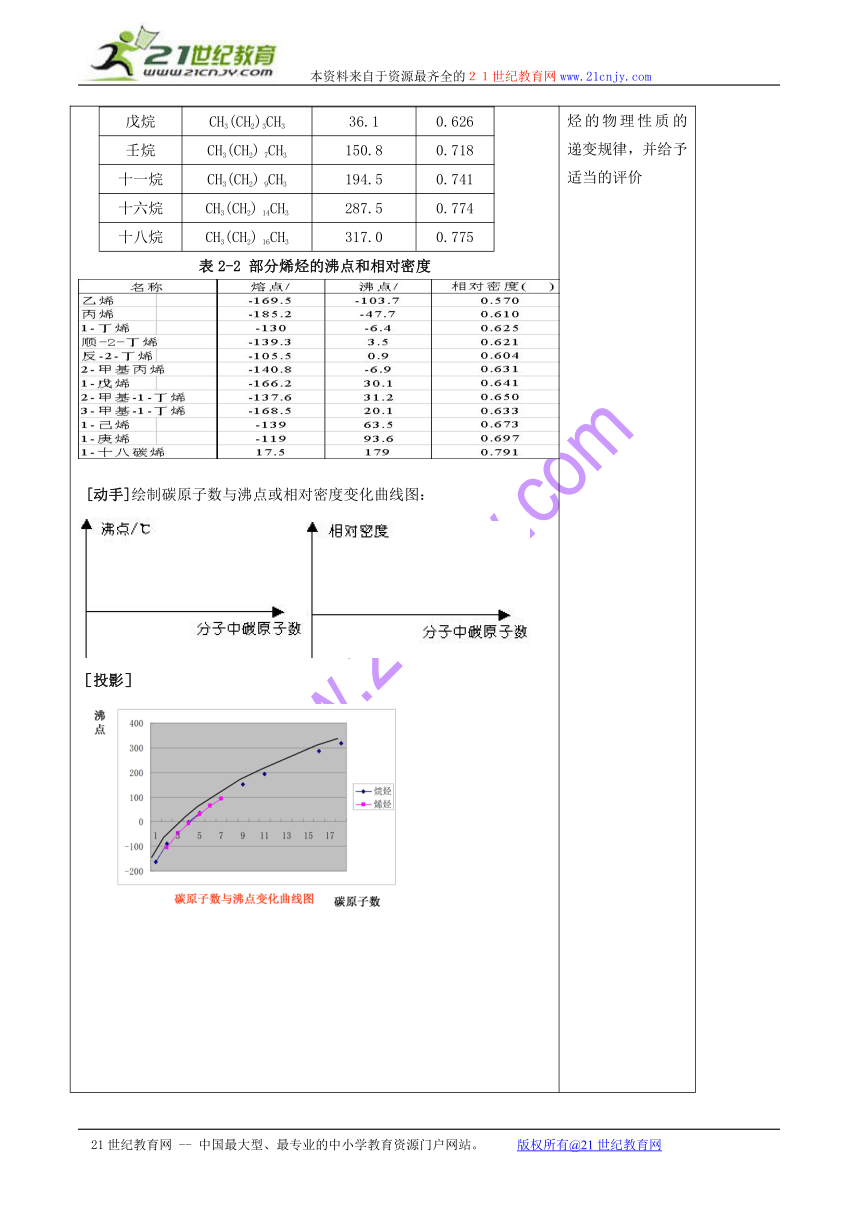
[引入]同学们,从这节课开始我们来学习第二章的内容——烃和卤代烃。在高一的时候我们接触过几种烃,大家能否举出一些例子? 甲烷、乙烯、苯。[讲]甲烷、乙烯、苯这三种有机物都仅含碳和氢两种元素,它们都是碳氢化合物,又称烃。根据结构的不同,烃可分为烷烃、烯烃、炔烃和芳香烃等。而卤代烃则是从结构上可以看成是烃分子中的氢原子被卤原子取代的产物,是烃的衍生物的一种。我们先来学习第一节——脂肪烃。[板书]第二章 烃和卤代烃第一节 脂肪烃[问]什么样的烃是烷烃呢?请大家回忆一下。[板书]一、烷烃(alkane)和烯烃(alkene)1、结构特点和通式:(1) 烷烃:仅含C—C键和C—H键的饱和链烃,又叫烷烃。(若C—C连成环状,称为环烷烃。)通式:CnH2n+2 (n≥1)(2) 烯烃:分子里含有一个碳碳双键的不饱和链烃叫做烯烃。(分子里含有两个双键的链烃叫做二烯烃)通式:CnH2n (n≥2)[讲]接下来大家通过下表中给出的数据,仔细观察、思考、总结,看自己能得到什么信息?[思考与交流] 表2—1和表2—2:分别列举了部分烷烃与烯烃的沸点和相对密度。请你根据表中给出的数据,以分子中碳原子数为横坐标,以沸点或相对密度为纵坐标,制作分子中碳原子数与沸点或相对密度变化的曲线图。通过所绘制的曲线图你能得到什么信息 [投影]表2—1 部分烷烃的沸点和相对密度名称结构简式沸点/ C相对密度甲烷CH4-1640.466乙烷CH3CH3-88.60.572丁烷CH3(CH2) 2CH3-0.50.578戊烷CH3(CH2)3CH336.10.626壬烷CH3(CH2) 7CH3150.80.718十一烷CH3(CH2) 9CH3194.50.741十六烷CH3(CH2) 14CH3287.50.774十八烷CH3(CH2) 16CH3317.00.775表2-2 部分烯烃的沸点和相对密度 [动手]绘制碳原子数与沸点或相对密度变化曲线图:[投影][总结]烷烃和烯烃溶沸点变化规律:原子数相同时,支链越多,沸点越低。沸点的高低与分子间引力--范德华引力(包括静电引力、诱导力和色散力)有关。烃的碳原子数目越多,分子间的力就越大。支链增多时,使分子间的距离增大,分子间的力减弱,因而沸点降低。[板书]2、物理性质(1) 物理性质随着分子中碳原子数的递增,呈规律性变化,沸点逐渐升高,相对密度逐渐增大;(2) 碳原子数相同时,支链越多,熔沸点越低。(3) 常温下的存在状态,也由气态(n≤4)逐渐过渡到液态(5≤n≤16)、固态(17≤n)。(4) 烃的密度比水小,不溶于水,易溶于有机溶剂。[思考与交流]对化学反应进行分类是学习化学的重要方法之一。如我们学过的无机化学反应有两种主要的分类方法:(1) 根据反应前后物质的变化分为化合反应、分解反应、置换反应和复分解反应;(2) 根据化学反应中是否有电子转移,分为氧化还原反应和非氧化还原反应。下面是我们已经学过的烷烃和烯烃的化学反应,请写出其反应的化学方程式,指出反应类型并说说你的分类依据[投影](1)乙烷与氯气生成一氯乙烷的反应:_________;(2)乙烯与溴的反应:_________________;(3)乙烯与水的反应:_________________;(4)乙烯生成聚乙烯的反应:_________________[板书]3、基本反应类型(1) 取代反应(substitution reaction):有机物分子里的某些原子或原子团被其他原子或原子团所取代的反应。如烃的卤代反应。[投影][板书](2) 加成反应(addition reaction):有机物分子中双键(叁键)两端的碳原子与其他原子或原子团所直接结合生成新的化合物的反应。如不饱和碳原子与H2、X2、H2O的加成。[投影][板书](3) 聚合反应(polymerization reaction):由相对分子质量小的化合物分子结合成相对分子质量较大的高分子化合物的反应。如加聚反应、缩聚反应。[投影] [过]下面我们来回忆一下甲烷、乙烯的结构和性质[投影][过]我们知道同系物的结构相似,相似的结构决定了其他烷烃具有与甲烷相似的化学性质。[板书]4、烷烃化学性质(与甲烷相似)烷烃不能使酸性高锰酸钾溶液和溴水褪色(1)取代反应:CH3CH3 + Cl2 →CH3CH2Cl + HCl(2)氧化反应CnH2n+2 + — O2 → nCO2 +(n+1)H2O(3) 分解反应[讲]烷烃的化学性质一般稳定。在通常状况下,烷烃跟酸、碱及氧化剂都不发生反应,也难与其他物质化合。但在特定条件下烷烃也能发生上述反应。[讲]烯烃的化学性质与其代表物乙烯相似,容易发生加成反应、氧化反应和加聚反应。烯烃能使酸性KMnO4溶液和溴水褪色。[板书]5、烯烃的化学性质(与乙烯相似)(1)加成反应:(以丙烯为例。要求学生练习)[投影];1,2 一二溴丙烷;丙烷 2——卤丙烷[讲]大量实验事实表明:凡是不对称结构的烯烃和酸(HX)加成时,酸的负基(X-)主要加到含氢原子较少的双键碳原子上,这称为马尔科夫尼科夫规则,也就是马氏规则。[板书](2)氧化反应 燃烧:CnH2n+O2n CO2 + n H2O 使酸性KMnO4 溶液褪色:R—CH=CH2R—COOH + CO2 + R3—COOH 催化氧化2R—CH=CH2 + O2 2RCH3 在臭氧和锌粉的作用下, + (3) 加聚反应[投影]请以丙烯和2-丁烯为例来书写上述三各反应方程式 聚丙烯 聚丁烯[板书]6、二烯烃的化学性质[讲]二烯烃跟烯烃性质相似,由于含有双键,也能发生加成反应、氧化反应和加聚反应。这里我们主要介绍1,3-丁二烯与溴发生的两种加成反应。[讲]当两个双键一起断裂,同时又生成一个新的双键,溴原子连接在1、4两个碳原子上,即1、4加成反应[板书](1)二烯烃的加成反应:(1,4一加成反应是主要的)[讲]若两个双键中的一个比较活泼的键断裂,溴原子连接在1、2两个碳原子上,即1、2加成反应[板书][讲]以上两种加成是二烯烃与溴等物质的量加成,若要完全发生加成反应,1 mol 的二烯烃需要2 mol 的溴,[板书]CH2=CHCH=CH2 +2Br2 CH2BrCHBrCHBrCH2Br[讲]二烯烃可发生加聚反应,如[板书](2) 加聚反应 n CH2=CHCH=CH2 (顺丁橡胶)n (聚异戊二烯)[讲]聚异戊二烯是直线型高分子化合物,是天然橡胶的主要成分。由于聚异戊二烯分子里含有C=C双键,所以能跟HCl、X2等起加成反应而变质。如果长期受空气、日光的作用,就会逐渐被氧化而变硬、变脆,这叫做老化。工业上采用硫化的措施(硫化剂主要用硫),以改善橡胶的性能。经过硫化的橡胶,叫做硫化橡胶。橡胶硫化以后,橡胶的直线型分子间经过单硫键或双硫键发生了交联,成为网状结构,因而硫化橡胶具有较高的强度和韧性,且具有良好的弹性,化学稳定性,耐蚀性等。[小结]烷烃和烯烃的结构和性质 [课后练习]1、由沸点数据:甲烷-146℃,乙烷-89℃,丁烷-0.5℃,戊烷36℃,可以判断丙烷的沸点可能是( ) A.高于-0.5℃ B.约是+30℃ C.约是-40℃ D.低于-89℃ 2、下列烷烃沸点最高的是( ) A.CH3CH2CH3 B.CH3CH2CH2CH3 C.CH3(CH2)3CH3 D.(CH3)2CHCH2CH33、下列液体混合物可以用分液的方法分离的是( )A.苯和溴苯 B.汽油和辛烷C.己烷和水 D.戊烷和庚烷 (学生回答,教师给予评价)教师引导学生根据上表总结出烷烃的物理性质的递变规律,并给予适当的评价引导学生讨论甲烷、乙烯的结构和性质的相似点和不同点,列表小结。简单介绍不对称加称规则
教学回顾:
教 案
课题:第二章 第一节 脂肪烃(2) 授课班级
课 时
教学目的 知识与技能 掌握烯烃、炔烃的结构特点和主要化学性质 乙炔的实验室制法
过程与方法 要注意充分发挥学生的主体性培养学生的观察能力、实验能力和探究能力
情感态度价值观 在实践活动中,体会有机化合物在日常生活中的重要应用,同时关注有机物的合理使用
重 点 炔烃的结构特点和化学性质
难 点 乙炔的实验室制法
知识结构与板书设计 二、烯烃的顺反异构1、由于碳碳双键不能旋转而导致分子中原子或原子团在空间的排列方式不同所产生的异构现象,称为顺反异构。2、形成条件:(1)具有碳碳双键(2)组成双键的每个碳原子必须连接两个不同的原子或原子团.三、炔烃(alkyne):分子里含有碳碳三键的一类脂肪烃称为炔烃。1、乙炔(ethyne)的结构:分子式:C2H2,实验式:CH,电子式: 结构式:H-C≡C-H,分子构型:直线型,键角:180°2、乙炔的实验室制取(1)反应原理:CaC2+2H2O→CH≡CH↑+Ca(OH)2(2)装置:固-液不加热制气装置。(3)收集方法:排水法。(4)注意事项:①为有效地控制产生气体的速度,可用饱和食盐水代替水。②点燃乙炔前必须检验其纯度。3、乙炔的性质:乙炔是无色、无味的气体,微溶于水。(1)氧化反应:①可燃性(明亮带黑烟)2C2H2 +5O2 4CO2 +2H2O ②易被KMnO4酸性溶液氧化(叁键断裂)(2)加成反应:乙炔与溴发生加成反应四、脂肪烃的来源及其应用
教学过程
教学步骤、内容 教学方法、手段、师生活动
[练习]写出戊烯的同分异构体:[思考]以下两种结构是否相同?[板书]二、烯烃的顺反异构[讲]在烯烃中,由于双键的存在,使得烯烃的同分异构体的数目要比含有相同数目碳原子的烷烃的同分异构体多。除因双键位置不同而产生的同分异构体外,在烯烃中还有一种称为顺反异构(也称几何异构)的现象。当C=C双键上的两个碳原子所连接的原子或原子团不相同时,就会有两种不同的排列方式。这是由于与双键相连接的两个碳原子不能围绕它们之间的σ键键轴自由旋转的缘故(除了由于双键的关系以外,还有其他原因,在这里就不赘述了)。[板书]1、由于碳碳双键不能旋转而导致分子中原子或原子团在空间的排列方式不同所产生的异构现象,称为顺反异构。2、形成条件:(1)具有碳碳双键(2)组成双键的每个碳原子必须连接两个不同的原子或原子团.[讲]如果用a、b、c表示双键碳原子上的原子或原子团,那么,因双键所引起的顺反异构如下所示:[投影][讲]两个相同的原子或原子团居于同一边的为顺式(cis-),分居两边的为反式(trans-)。例如,在2-丁烯中,两个甲基可能同时位于分子的一侧,也可能分别位于分子的两侧。[投影] [板书]三、炔烃(alkyne)分子里含有碳碳三键的一类脂肪烃称为炔烃。[自学讨论]在学生自学教材的基础上,教师与学生一起讨论乙炔的分子结构特征,并推测乙炔可能的化学性质[小结]乙炔的组成和结构[板书]1、乙炔(ethyne)的结构分子式:C2H2,实验式:CH,电子式: 结构式:H-C≡C-H,分子构型:直线型,键角:180°[投影][板书] 2、乙炔的实验室制取(1)反应原理:CaC2+2H2O→CH≡CH↑+Ca(OH)2(2)装置:固-液不加热制气装置。[投影][思考]实验室制取乙炔气体能不能用启普发生器?为什么?[讲]看上去电石与水的反应不需要加热,产生的乙炔气体也可以用排水法收集,似乎可以使用启普发生器制取乙炔气体。其实不然,这是因为:①电石跟水极易反应,启普发生器长期不用时,其中的电石也会跟挥发出的水蒸气反应而消耗,且产生的乙炔气体排出后可能发生危险;②电石跟水作用产生的熟石灰不易溶于水,呈糊状物附着在电石的表面,会积存一部分水分,致使关闭启普发生器开关后一段时间内,反应并不能及时停止;③反应生成的氢氧化钙落入启普发生器底部,可能堵塞长颈漏斗下口;④电石与水的反应是放热反应,短时间内放出大量的热,可能使启普发生器炸裂。[板书] (3)收集方法:排水法。[思考]用电石与水反应制得的乙炔气体常常有一股难闻的气味,这是因为其中混有H2S,PH3等杂质的缘故。试通过实验证明纯净的乙炔是没有臭味的(提示:PH3可以被硫酸铜溶液吸收)。[讲]使电石与水反应所得气体通过盛有硫酸铜溶液的洗气瓶后,再闻其气味。H2S和PH3都被硫酸铜溶液吸收,不会干扰闻乙炔的气味。[板书] (4)注意事项:①为有效地控制产生气体的速度,可用饱和食盐水代替水。②点燃乙炔前必须检验其纯度。[思考]为什么用饱和食盐水代替水可以有效控制此反应的速率?[讲]饱和食盐水滴到电石的表面上后,水迅速跟电石作用,使原来溶于其中的食盐析出,附着在电石表面,能从一定程度上阻碍后边的水与电石表面的接触,从而降低反应的速率。[思考]试根据乙炔的分子结构特征推测乙炔可能具有的化学性质。[讲]乙炔分子中含有一个碳碳三键,碳原子远没有达到饱和。因此,乙炔应有与乙烯极为相似的性质。可以被高锰酸钾溶液氧化,可以在一定条件下发生加成反应,也应该能够在一定条件下发生聚合反应。当然,作为烃,它也能够燃烧。由于其含碳的质量分数比乙烯还大,所以燃烧时必然有黑烟产生。[板书]3、乙炔的性质乙炔是无色、无味的气体,微溶于水。(1)氧化反应①可燃性(明亮带黑烟)2C2H2 +5O2 4CO2 +2H2O [演示]点燃乙炔(验纯后再点燃)[投影]现象;燃烧,火焰明亮并伴有浓烈的黑烟。推知:乙炔含碳量比乙烯高。[板书]②易被KMnO4酸性溶液氧化(叁键断裂)[演示]将乙炔通入KMnO4酸性溶液[投影]现象:溶液的紫色褪去,但比乙烯慢。[讲]乙炔易被KMnO4酸性溶液所氧化,具有不饱和烃的性质。碳碳三键比碳碳双键稳定(根据学生情况可说明这一推理)。[板书](2)加成反应[演示]将乙炔通入溴的四氯化碳溶液[投影]现象:颜色逐渐褪去,但比乙烯慢。证明:乙炔属于不饱和烃,能发生加成反应。[板书]乙炔与溴发生加成反应[随堂练习]以乙炔为原料制备聚氯乙烯[讲]炔烃的化学性质与乙炔相似,容易发生加成反应、氧化反应等,能使溴的四氯化碳溶液及KMnO4溶液褪色。值得注意的是,炔烃在一定条件下既可与X2、H2、HX等按物质的量之比1:1加成,也可按物质的量之比1:2加成,其加成程度是可以控制的。 [学与问]1、哪些脂肪烃能被高锰酸钾酸性溶液氧化,它们有什么结构特点 烯烃、炔烃,含有不饱和键[学与问]2、在烯烃分子中如果双键碳上连接了两个不同的原子或原子团,将可以出现顺反异构。请问在炔烃分子中是否也存在顺反异构现象 不存在,因为三键两端只连有一个原子或原子团。 [板书]四、脂肪烃的来源及其应用[复习]石油成分、常压分馏、减压分馏、催化裂化、裂解等石油化工名词及相关产品。[思考与交流] 图2—12形象地表示出了通过原油所制得的主要产品和它们的用途。请利用图中所显示的信息,并查阅资料、调查身边使用石油制品的情况,与同学交流脂肪烃的主要来源及其应用。[投影]图2-12原油分馏及裂化产品用途示意图[练习]试举例说明天然气在人民生活、工农业生产中的作用。[复习]煤干馏及其产品,说明“煤变油”的重要意义。[学与问] 石油化学工业是国民经济重要支柱之一,在石油化工中有分馏、催化裂化与裂解、催化重整等工艺。请比较这三种化学工艺的不同。 [讲] 石油分馏是利用石油中各组分的沸点不同而加以分离的技术。分为常压分馏和减压分馏,常压分馏得到石油气、汽油、煤油、柴油和重油;重油再进行减压分馏得到润滑油、凡士林、石蜡等。减压分馏是利用低压时液体的沸点降低的原理,使重油中各成分的沸点降低而进行分馏,避免了高温下有机物的炭化。石油催化裂化是将重油成分(如石蜡)在催化剂存在下,在460~520 ℃及100 kPa~200 kPa的压强下,长链烷烃断裂成短链的烷烃和烯烃,从而大大提高汽油的产量。如C16H34→C8H18+C8H16。石油裂解是深度的裂化,使短链的烷烃进一步分解生成乙烯、丙烯、丁烯等重要石油化工原料。石油的催化重整的目的有两个:提高汽油的辛烷值和制取芳香烃。[小结][课后练习]1、下列分子中不存在顺反异构现象的是( )A、CH3CH=CHCH3 B、CH2=CH(CH2)3CH3C、CH3CH=CH(CH2)2CH3 D、 CH3CH2CH=CHCH2CH3 通过实验验证有关乙炔性质的推论。有条件的学校可采用边讲边做实验的方法,要求学生注意观察实验现象,分析实验结果(要在通风橱或通风状况良好的环境中进行以下各项实验)。
教学回顾:
点燃
3n+1
2
光照
点燃
3n+1
2
21世纪教育网 -- 中国最大型、最专业的中小学教育资源门户网站。 版权所有@21世纪教育网
教 案
课题:第二章 第一节 脂肪烃(1) 授课班级
课 时
教学目的 知识与技能 了解烷烃、烯烃和炔烃的物理性质的规律性变化了解烷烃、烯烃、炔烃的结构特点
过程与方法 注意不同类型脂肪烃的结构和性质的对比善于运用形象生动的实物、模型、计算机课件等手段帮助学生理解概念、掌握概念、学会方法、形成能力
情感态度价值观 根据有机物的结果和性质,培养学习有机物的基本方法“结构决定性质、性质反映结构”的思想
重 点 烯烃的结构特点和化学性质
难 点 烯烃的顺反异构
知识结构与板书设计 第二章 烃和卤代烃 第一节 脂肪烃一、烷烃(alkane)和烯烃(alkene)1、结构特点和通式:(1) 烷烃:仅含C—C键和C—H键的饱和链烃,又叫烷烃。(若C—C连成环状,称为环烷烃。)通式:CnH2n+2 (n≥1)(2) 烯烃:分子里含有一个碳碳双键的不饱和链烃叫做烯烃。(分子里含有两个双键的链烃叫做二烯烃)通式:CnH2n (n≥2)2、物理性质(1) 物理性质随着分子中碳原子数的递增,呈规律性变化,沸点逐渐升高,相对密度逐渐增大;(2) 碳原子数相同时,支链越多,熔沸点越低。(3) 常温下的存在状态,也由气态(n≤4)逐渐过渡到液态(5≤n≤16)、固态(17≤n)。(4) 烃的密度比水小,不溶于水,易溶于有机溶剂。3、基本反应类型(1) 取代反应(substitution reaction):有机物分子里的某些原子或原子团被其他原子或原子团所取代的反应。如烃的卤代反应。(2) 加成反应(addition reaction):有机物分子中双键(叁键)两端的碳原子与其他原子或原子团所直接结合生成新的化合物的反应。如不饱和碳原子与H2、X2、H2O的加成。(3) 聚合反应(polymerization reaction):由相对分子质量小的化合物分子结合成相对分子质量较大的高分子化合物的反应。如加聚反应、缩聚反应。4、烷烃化学性质(与甲烷相似)烷烃不能使酸性高锰酸钾溶液和溴水褪色(1)取代反应:CH3CH3 + Cl2 →CH3CH2Cl + HCl(2)氧化反应:CnH2n+2 + — O2 → nCO2 +(n+1)H2O5、烯烃的化学性质(与乙烯相似)(1)加成反应(2)氧化反应 燃烧:CnH2n+O2n CO2 + n H2O 使酸性KMnO4 溶液褪色:R—CH=CH2R—COOH + CO2 + R3—COOH 催化氧化:2R—CH=CH2 + O2 2RCH3 在臭氧和锌粉的作用下, + (3) 加聚反应6、二烯烃的化学性质(1)二烯烃的加成反应:(1,4一加成反应是主要的)(2) 加聚反应: n CH2=CHCH=CH2 (顺丁橡胶)n (聚异戊二烯)CH2=CHCH=CH2 +2Br2 CH2BrCHBrCHBrCH2Br
教学过程
教学步骤、内容 教学方法、手段、师生活动
[引入]同学们,从这节课开始我们来学习第二章的内容——烃和卤代烃。在高一的时候我们接触过几种烃,大家能否举出一些例子? 甲烷、乙烯、苯。[讲]甲烷、乙烯、苯这三种有机物都仅含碳和氢两种元素,它们都是碳氢化合物,又称烃。根据结构的不同,烃可分为烷烃、烯烃、炔烃和芳香烃等。而卤代烃则是从结构上可以看成是烃分子中的氢原子被卤原子取代的产物,是烃的衍生物的一种。我们先来学习第一节——脂肪烃。[板书]第二章 烃和卤代烃第一节 脂肪烃[问]什么样的烃是烷烃呢?请大家回忆一下。[板书]一、烷烃(alkane)和烯烃(alkene)1、结构特点和通式:(1) 烷烃:仅含C—C键和C—H键的饱和链烃,又叫烷烃。(若C—C连成环状,称为环烷烃。)通式:CnH2n+2 (n≥1)(2) 烯烃:分子里含有一个碳碳双键的不饱和链烃叫做烯烃。(分子里含有两个双键的链烃叫做二烯烃)通式:CnH2n (n≥2)[讲]接下来大家通过下表中给出的数据,仔细观察、思考、总结,看自己能得到什么信息?[思考与交流] 表2—1和表2—2:分别列举了部分烷烃与烯烃的沸点和相对密度。请你根据表中给出的数据,以分子中碳原子数为横坐标,以沸点或相对密度为纵坐标,制作分子中碳原子数与沸点或相对密度变化的曲线图。通过所绘制的曲线图你能得到什么信息 [投影]表2—1 部分烷烃的沸点和相对密度名称结构简式沸点/ C相对密度甲烷CH4-1640.466乙烷CH3CH3-88.60.572丁烷CH3(CH2) 2CH3-0.50.578戊烷CH3(CH2)3CH336.10.626壬烷CH3(CH2) 7CH3150.80.718十一烷CH3(CH2) 9CH3194.50.741十六烷CH3(CH2) 14CH3287.50.774十八烷CH3(CH2) 16CH3317.00.775表2-2 部分烯烃的沸点和相对密度 [动手]绘制碳原子数与沸点或相对密度变化曲线图:[投影][总结]烷烃和烯烃溶沸点变化规律:原子数相同时,支链越多,沸点越低。沸点的高低与分子间引力--范德华引力(包括静电引力、诱导力和色散力)有关。烃的碳原子数目越多,分子间的力就越大。支链增多时,使分子间的距离增大,分子间的力减弱,因而沸点降低。[板书]2、物理性质(1) 物理性质随着分子中碳原子数的递增,呈规律性变化,沸点逐渐升高,相对密度逐渐增大;(2) 碳原子数相同时,支链越多,熔沸点越低。(3) 常温下的存在状态,也由气态(n≤4)逐渐过渡到液态(5≤n≤16)、固态(17≤n)。(4) 烃的密度比水小,不溶于水,易溶于有机溶剂。[思考与交流]对化学反应进行分类是学习化学的重要方法之一。如我们学过的无机化学反应有两种主要的分类方法:(1) 根据反应前后物质的变化分为化合反应、分解反应、置换反应和复分解反应;(2) 根据化学反应中是否有电子转移,分为氧化还原反应和非氧化还原反应。下面是我们已经学过的烷烃和烯烃的化学反应,请写出其反应的化学方程式,指出反应类型并说说你的分类依据[投影](1)乙烷与氯气生成一氯乙烷的反应:_________;(2)乙烯与溴的反应:_________________;(3)乙烯与水的反应:_________________;(4)乙烯生成聚乙烯的反应:_________________[板书]3、基本反应类型(1) 取代反应(substitution reaction):有机物分子里的某些原子或原子团被其他原子或原子团所取代的反应。如烃的卤代反应。[投影][板书](2) 加成反应(addition reaction):有机物分子中双键(叁键)两端的碳原子与其他原子或原子团所直接结合生成新的化合物的反应。如不饱和碳原子与H2、X2、H2O的加成。[投影][板书](3) 聚合反应(polymerization reaction):由相对分子质量小的化合物分子结合成相对分子质量较大的高分子化合物的反应。如加聚反应、缩聚反应。[投影] [过]下面我们来回忆一下甲烷、乙烯的结构和性质[投影][过]我们知道同系物的结构相似,相似的结构决定了其他烷烃具有与甲烷相似的化学性质。[板书]4、烷烃化学性质(与甲烷相似)烷烃不能使酸性高锰酸钾溶液和溴水褪色(1)取代反应:CH3CH3 + Cl2 →CH3CH2Cl + HCl(2)氧化反应CnH2n+2 + — O2 → nCO2 +(n+1)H2O(3) 分解反应[讲]烷烃的化学性质一般稳定。在通常状况下,烷烃跟酸、碱及氧化剂都不发生反应,也难与其他物质化合。但在特定条件下烷烃也能发生上述反应。[讲]烯烃的化学性质与其代表物乙烯相似,容易发生加成反应、氧化反应和加聚反应。烯烃能使酸性KMnO4溶液和溴水褪色。[板书]5、烯烃的化学性质(与乙烯相似)(1)加成反应:(以丙烯为例。要求学生练习)[投影];1,2 一二溴丙烷;丙烷 2——卤丙烷[讲]大量实验事实表明:凡是不对称结构的烯烃和酸(HX)加成时,酸的负基(X-)主要加到含氢原子较少的双键碳原子上,这称为马尔科夫尼科夫规则,也就是马氏规则。[板书](2)氧化反应 燃烧:CnH2n+O2n CO2 + n H2O 使酸性KMnO4 溶液褪色:R—CH=CH2R—COOH + CO2 + R3—COOH 催化氧化2R—CH=CH2 + O2 2RCH3 在臭氧和锌粉的作用下, + (3) 加聚反应[投影]请以丙烯和2-丁烯为例来书写上述三各反应方程式 聚丙烯 聚丁烯[板书]6、二烯烃的化学性质[讲]二烯烃跟烯烃性质相似,由于含有双键,也能发生加成反应、氧化反应和加聚反应。这里我们主要介绍1,3-丁二烯与溴发生的两种加成反应。[讲]当两个双键一起断裂,同时又生成一个新的双键,溴原子连接在1、4两个碳原子上,即1、4加成反应[板书](1)二烯烃的加成反应:(1,4一加成反应是主要的)[讲]若两个双键中的一个比较活泼的键断裂,溴原子连接在1、2两个碳原子上,即1、2加成反应[板书][讲]以上两种加成是二烯烃与溴等物质的量加成,若要完全发生加成反应,1 mol 的二烯烃需要2 mol 的溴,[板书]CH2=CHCH=CH2 +2Br2 CH2BrCHBrCHBrCH2Br[讲]二烯烃可发生加聚反应,如[板书](2) 加聚反应 n CH2=CHCH=CH2 (顺丁橡胶)n (聚异戊二烯)[讲]聚异戊二烯是直线型高分子化合物,是天然橡胶的主要成分。由于聚异戊二烯分子里含有C=C双键,所以能跟HCl、X2等起加成反应而变质。如果长期受空气、日光的作用,就会逐渐被氧化而变硬、变脆,这叫做老化。工业上采用硫化的措施(硫化剂主要用硫),以改善橡胶的性能。经过硫化的橡胶,叫做硫化橡胶。橡胶硫化以后,橡胶的直线型分子间经过单硫键或双硫键发生了交联,成为网状结构,因而硫化橡胶具有较高的强度和韧性,且具有良好的弹性,化学稳定性,耐蚀性等。[小结]烷烃和烯烃的结构和性质 [课后练习]1、由沸点数据:甲烷-146℃,乙烷-89℃,丁烷-0.5℃,戊烷36℃,可以判断丙烷的沸点可能是( ) A.高于-0.5℃ B.约是+30℃ C.约是-40℃ D.低于-89℃ 2、下列烷烃沸点最高的是( ) A.CH3CH2CH3 B.CH3CH2CH2CH3 C.CH3(CH2)3CH3 D.(CH3)2CHCH2CH33、下列液体混合物可以用分液的方法分离的是( )A.苯和溴苯 B.汽油和辛烷C.己烷和水 D.戊烷和庚烷 (学生回答,教师给予评价)教师引导学生根据上表总结出烷烃的物理性质的递变规律,并给予适当的评价引导学生讨论甲烷、乙烯的结构和性质的相似点和不同点,列表小结。简单介绍不对称加称规则
教学回顾:
教 案
课题:第二章 第一节 脂肪烃(2) 授课班级
课 时
教学目的 知识与技能 掌握烯烃、炔烃的结构特点和主要化学性质 乙炔的实验室制法
过程与方法 要注意充分发挥学生的主体性培养学生的观察能力、实验能力和探究能力
情感态度价值观 在实践活动中,体会有机化合物在日常生活中的重要应用,同时关注有机物的合理使用
重 点 炔烃的结构特点和化学性质
难 点 乙炔的实验室制法
知识结构与板书设计 二、烯烃的顺反异构1、由于碳碳双键不能旋转而导致分子中原子或原子团在空间的排列方式不同所产生的异构现象,称为顺反异构。2、形成条件:(1)具有碳碳双键(2)组成双键的每个碳原子必须连接两个不同的原子或原子团.三、炔烃(alkyne):分子里含有碳碳三键的一类脂肪烃称为炔烃。1、乙炔(ethyne)的结构:分子式:C2H2,实验式:CH,电子式: 结构式:H-C≡C-H,分子构型:直线型,键角:180°2、乙炔的实验室制取(1)反应原理:CaC2+2H2O→CH≡CH↑+Ca(OH)2(2)装置:固-液不加热制气装置。(3)收集方法:排水法。(4)注意事项:①为有效地控制产生气体的速度,可用饱和食盐水代替水。②点燃乙炔前必须检验其纯度。3、乙炔的性质:乙炔是无色、无味的气体,微溶于水。(1)氧化反应:①可燃性(明亮带黑烟)2C2H2 +5O2 4CO2 +2H2O ②易被KMnO4酸性溶液氧化(叁键断裂)(2)加成反应:乙炔与溴发生加成反应四、脂肪烃的来源及其应用
教学过程
教学步骤、内容 教学方法、手段、师生活动
[练习]写出戊烯的同分异构体:[思考]以下两种结构是否相同?[板书]二、烯烃的顺反异构[讲]在烯烃中,由于双键的存在,使得烯烃的同分异构体的数目要比含有相同数目碳原子的烷烃的同分异构体多。除因双键位置不同而产生的同分异构体外,在烯烃中还有一种称为顺反异构(也称几何异构)的现象。当C=C双键上的两个碳原子所连接的原子或原子团不相同时,就会有两种不同的排列方式。这是由于与双键相连接的两个碳原子不能围绕它们之间的σ键键轴自由旋转的缘故(除了由于双键的关系以外,还有其他原因,在这里就不赘述了)。[板书]1、由于碳碳双键不能旋转而导致分子中原子或原子团在空间的排列方式不同所产生的异构现象,称为顺反异构。2、形成条件:(1)具有碳碳双键(2)组成双键的每个碳原子必须连接两个不同的原子或原子团.[讲]如果用a、b、c表示双键碳原子上的原子或原子团,那么,因双键所引起的顺反异构如下所示:[投影][讲]两个相同的原子或原子团居于同一边的为顺式(cis-),分居两边的为反式(trans-)。例如,在2-丁烯中,两个甲基可能同时位于分子的一侧,也可能分别位于分子的两侧。[投影] [板书]三、炔烃(alkyne)分子里含有碳碳三键的一类脂肪烃称为炔烃。[自学讨论]在学生自学教材的基础上,教师与学生一起讨论乙炔的分子结构特征,并推测乙炔可能的化学性质[小结]乙炔的组成和结构[板书]1、乙炔(ethyne)的结构分子式:C2H2,实验式:CH,电子式: 结构式:H-C≡C-H,分子构型:直线型,键角:180°[投影][板书] 2、乙炔的实验室制取(1)反应原理:CaC2+2H2O→CH≡CH↑+Ca(OH)2(2)装置:固-液不加热制气装置。[投影][思考]实验室制取乙炔气体能不能用启普发生器?为什么?[讲]看上去电石与水的反应不需要加热,产生的乙炔气体也可以用排水法收集,似乎可以使用启普发生器制取乙炔气体。其实不然,这是因为:①电石跟水极易反应,启普发生器长期不用时,其中的电石也会跟挥发出的水蒸气反应而消耗,且产生的乙炔气体排出后可能发生危险;②电石跟水作用产生的熟石灰不易溶于水,呈糊状物附着在电石的表面,会积存一部分水分,致使关闭启普发生器开关后一段时间内,反应并不能及时停止;③反应生成的氢氧化钙落入启普发生器底部,可能堵塞长颈漏斗下口;④电石与水的反应是放热反应,短时间内放出大量的热,可能使启普发生器炸裂。[板书] (3)收集方法:排水法。[思考]用电石与水反应制得的乙炔气体常常有一股难闻的气味,这是因为其中混有H2S,PH3等杂质的缘故。试通过实验证明纯净的乙炔是没有臭味的(提示:PH3可以被硫酸铜溶液吸收)。[讲]使电石与水反应所得气体通过盛有硫酸铜溶液的洗气瓶后,再闻其气味。H2S和PH3都被硫酸铜溶液吸收,不会干扰闻乙炔的气味。[板书] (4)注意事项:①为有效地控制产生气体的速度,可用饱和食盐水代替水。②点燃乙炔前必须检验其纯度。[思考]为什么用饱和食盐水代替水可以有效控制此反应的速率?[讲]饱和食盐水滴到电石的表面上后,水迅速跟电石作用,使原来溶于其中的食盐析出,附着在电石表面,能从一定程度上阻碍后边的水与电石表面的接触,从而降低反应的速率。[思考]试根据乙炔的分子结构特征推测乙炔可能具有的化学性质。[讲]乙炔分子中含有一个碳碳三键,碳原子远没有达到饱和。因此,乙炔应有与乙烯极为相似的性质。可以被高锰酸钾溶液氧化,可以在一定条件下发生加成反应,也应该能够在一定条件下发生聚合反应。当然,作为烃,它也能够燃烧。由于其含碳的质量分数比乙烯还大,所以燃烧时必然有黑烟产生。[板书]3、乙炔的性质乙炔是无色、无味的气体,微溶于水。(1)氧化反应①可燃性(明亮带黑烟)2C2H2 +5O2 4CO2 +2H2O [演示]点燃乙炔(验纯后再点燃)[投影]现象;燃烧,火焰明亮并伴有浓烈的黑烟。推知:乙炔含碳量比乙烯高。[板书]②易被KMnO4酸性溶液氧化(叁键断裂)[演示]将乙炔通入KMnO4酸性溶液[投影]现象:溶液的紫色褪去,但比乙烯慢。[讲]乙炔易被KMnO4酸性溶液所氧化,具有不饱和烃的性质。碳碳三键比碳碳双键稳定(根据学生情况可说明这一推理)。[板书](2)加成反应[演示]将乙炔通入溴的四氯化碳溶液[投影]现象:颜色逐渐褪去,但比乙烯慢。证明:乙炔属于不饱和烃,能发生加成反应。[板书]乙炔与溴发生加成反应[随堂练习]以乙炔为原料制备聚氯乙烯[讲]炔烃的化学性质与乙炔相似,容易发生加成反应、氧化反应等,能使溴的四氯化碳溶液及KMnO4溶液褪色。值得注意的是,炔烃在一定条件下既可与X2、H2、HX等按物质的量之比1:1加成,也可按物质的量之比1:2加成,其加成程度是可以控制的。 [学与问]1、哪些脂肪烃能被高锰酸钾酸性溶液氧化,它们有什么结构特点 烯烃、炔烃,含有不饱和键[学与问]2、在烯烃分子中如果双键碳上连接了两个不同的原子或原子团,将可以出现顺反异构。请问在炔烃分子中是否也存在顺反异构现象 不存在,因为三键两端只连有一个原子或原子团。 [板书]四、脂肪烃的来源及其应用[复习]石油成分、常压分馏、减压分馏、催化裂化、裂解等石油化工名词及相关产品。[思考与交流] 图2—12形象地表示出了通过原油所制得的主要产品和它们的用途。请利用图中所显示的信息,并查阅资料、调查身边使用石油制品的情况,与同学交流脂肪烃的主要来源及其应用。[投影]图2-12原油分馏及裂化产品用途示意图[练习]试举例说明天然气在人民生活、工农业生产中的作用。[复习]煤干馏及其产品,说明“煤变油”的重要意义。[学与问] 石油化学工业是国民经济重要支柱之一,在石油化工中有分馏、催化裂化与裂解、催化重整等工艺。请比较这三种化学工艺的不同。 [讲] 石油分馏是利用石油中各组分的沸点不同而加以分离的技术。分为常压分馏和减压分馏,常压分馏得到石油气、汽油、煤油、柴油和重油;重油再进行减压分馏得到润滑油、凡士林、石蜡等。减压分馏是利用低压时液体的沸点降低的原理,使重油中各成分的沸点降低而进行分馏,避免了高温下有机物的炭化。石油催化裂化是将重油成分(如石蜡)在催化剂存在下,在460~520 ℃及100 kPa~200 kPa的压强下,长链烷烃断裂成短链的烷烃和烯烃,从而大大提高汽油的产量。如C16H34→C8H18+C8H16。石油裂解是深度的裂化,使短链的烷烃进一步分解生成乙烯、丙烯、丁烯等重要石油化工原料。石油的催化重整的目的有两个:提高汽油的辛烷值和制取芳香烃。[小结][课后练习]1、下列分子中不存在顺反异构现象的是( )A、CH3CH=CHCH3 B、CH2=CH(CH2)3CH3C、CH3CH=CH(CH2)2CH3 D、 CH3CH2CH=CHCH2CH3 通过实验验证有关乙炔性质的推论。有条件的学校可采用边讲边做实验的方法,要求学生注意观察实验现象,分析实验结果(要在通风橱或通风状况良好的环境中进行以下各项实验)。
教学回顾:
点燃
3n+1
2
光照
点燃
3n+1
2
21世纪教育网 -- 中国最大型、最专业的中小学教育资源门户网站。 版权所有@21世纪教育网
