燃料燃烧释放的热量
图片预览






文档简介
课件25张PPT。燃料燃烧
释放的热量
判断下列反应是放热反应还是吸热反应:
1.高温煅烧石灰石
2.氧化钙与水的反应
3.HCl与NaOH溶液反应
4.高温下C+CO2 CO
5.Ca(OH)2和NH4Cl的反应
6.炽热的碳与H2O的反应
7.甲烷在氧气中的燃烧放热放热吸热吸热吸热吸热放热例1: 写出下列反应的热化学方程式:1、常温下,1g 碳在氧气中完全燃烧放出33kJ的热量。
。2、常温下,1g甲烷在氧气中完全燃烧生成水和二氧化碳并放出56kJ热量。
。
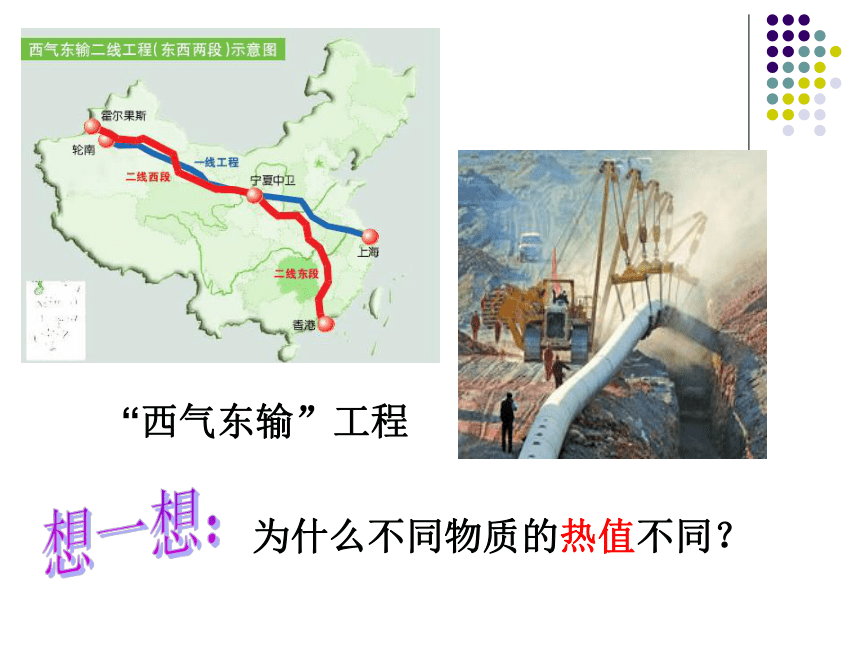
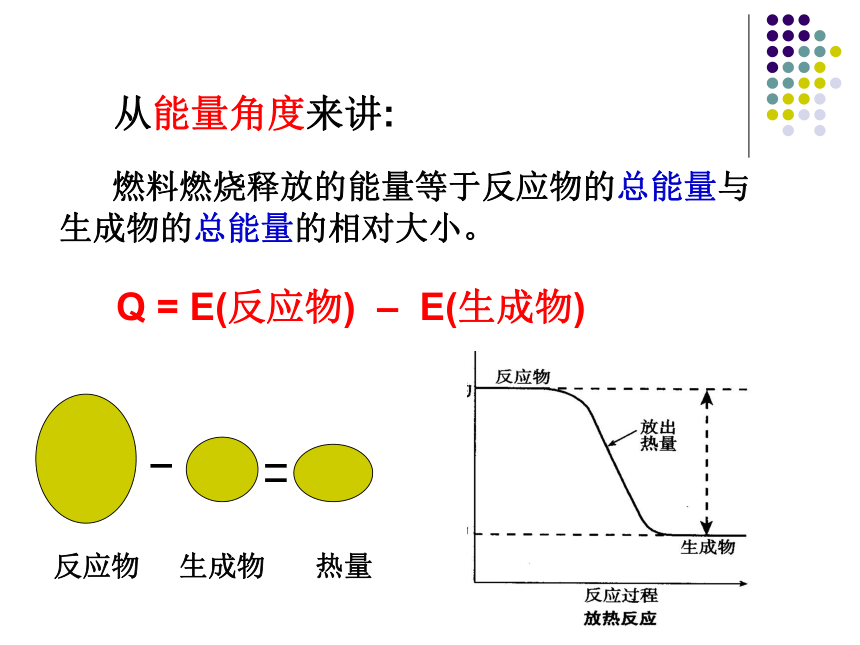
C(s)+O2(g) = CO2(g) △ H=-396kJ/mol例2: 为什么等质量的碳和甲烷完全燃烧之后释放的热量不同的?热值不同热值:在一定的条件下单位质量的物质完全燃烧所放出的热量。几种常见燃料的热值单位:KJ/g“西气东输”工程 为什么不同物质的热值不同?想一想: 燃料燃烧释放的能量等于反应物的总能量与生成物的总能量的相对大小。
从能量角度来讲:Q = E(反应物) – E(生成物)
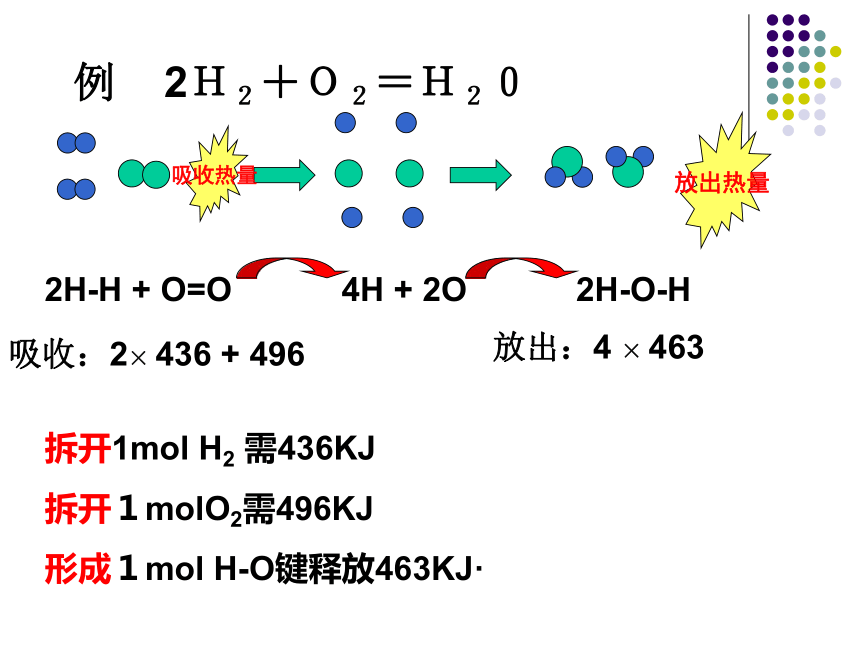
反应物生成物热量吸收热量放出热量例 2H2+O2=H20拆开1mol H2 需436KJ
拆开1molO2需496KJ
形成1mol H-O键释放463KJ·2H-H + O=O4H + 2O2H-O-H吸收:2× 436 + 496放出:4 × 463 4H﹢2O 程过应反能量2H2﹢O22H2O 交流与讨论:吸收能量 KJ1368放出能量 KJ1852放出 KJ484 燃料燃烧释放的能量等于形成生成物分子中化学键释放的能量与断裂反应物分子中化学键所吸收的能量之差。 Q = E(形成化学键)–E(断裂化学键)从化学键角度来讲:例:氢气在氧气中燃烧产生蓝色火焰,在反应中,
破坏1molH-H键消耗的能量为Q1kJ,
破坏1molO = O键消耗的能量为Q2kJ,
形成1molH-O键释放的能量为Q3kJ。
下列关系式中正确的是( )
A. 2Q1 + Q2 > 4Q3 B. 2Q1 + Q2 < 4Q3
C. Q1 + Q2 < Q3 D. Q1 + Q2 = Q3B二、燃料的燃烧可燃物与氧气发生的发光、 发热的剧烈的化学反应。1、可燃物
2、温度达到着火点
3、有氧气的存在燃烧:2、条件: 1、定义: 实例:煤、石油、天然气的燃烧。燃料完全燃烧的条件1.燃烧时要充足的氧气2.燃料与氧气要有充足的接触面积(1)将固体燃料粉碎
(2)液体燃料汽化练习:简要说明使煤炉中的煤完全燃烧所应采取的措施。打开炉门在煤饼上打孔或将煤做成蜂窝状燃烧时要有充足的氧气燃料与氧气要有充足的接触面将焦炭在高温下与水蒸气反应,则得到CO和H2高效清洁利用煤炭的重要途径【问题】:
某居民原先使用液化石油气燃料(C3H8),自从“西气东输”工程建起后,家里开始使用天然气(CH4),那么他家的炉具应该做怎样的调整?
答:应减少 或增大 。CH4进入的量氧气进入的的量分析: C3H8 + 5O2 = 3CO2 + 4H2O
CH4 + 2O2 = CO2 + 2H2O
(1)我国的能源结构图:
(2)我国与世界能源结构的对比 【自主讨论】
我国能源结构的缺点和应对方法(环保、防止能源危机)。 化石燃料存在的不足 1、化石燃料为不可再生燃料,用一次少一次;4、化石燃料燃烧常发生不完全燃烧,释放CO和大量烟尘污染环境,危害人体健康2、化石燃料存在着燃烧率不高,利用率较低等等问题;3、某些化石燃料燃烧释放的废气中有SO2和氮氧化物,污染空气并形成酸雨;采取的措施 1、改变燃料状态,增大燃料与空气的接触面积,提高燃烧率,减少有害气体的排放。2、对煤进行脱硫处理,减少SO2 产生形成酸雨。3、用化学手法处理燃料,提高燃料燃烧率 。 4、采取核能、氢能、太阳能等高能无污染的新能源。【课堂小结】:
1、下列燃料不属于化石燃料的是( )
A、煤 B.石油 C、水煤气 D、天然气
2、为了更好的解决能源问题,人们一方面研究如何提高燃料的燃烧效率,另一方面寻找新能源。以下做法不能提高燃料效率的是( )
A、煤的汽化与液化 B、液体燃料呈雾状喷出
C、通入大大过量的空气 D、将煤块粉碎
CC3、为了迎接2008年北京奥运会的到来,北京市的公交车及部分出租车已采用LPG(液化石油气)作为汽车的燃料,其主要目的在于( )
A、防止石油短缺 B、减少尾气对大气的污染
C、降低成本 D、加大发动机的动力
B4、已知下列热化学方程式:
C( s ) + O2 ( g ) = CO2 ( g ) △H =- 393.5 kJ ?mol-1
CO(g) + 1/2O2 (g) = CO2 (g) △H =- 283.0 kJ ?mol-1
计算 1 mol 固态碳粉燃烧生成CO ( g )放出的热量,并写出相应的热化学方程式。C( s ) + 1/2O2 ( g ) = CO ( g ) △H =- 110.5 kJ ?mol-15、在一定条件下,氢气和丙烷燃烧的化学方程式为:
2H2( g ) + O2 ( g ) = 2H2O ( l ) ; △H =- 571.6 kJ ?mol-1
C3H8(g) +5O2 (g) = 3CO2 (g) +4H2O (l) ;△H =- 2220 kJ ?mol-1
5mol 氢气和丙烷的混合气完全燃烧时放热3847kJ,则
氢气和甲烷的体积比为 ( )
(A) 1:3 (B) 3:1 (C) 1:4 (D) 1:1B解:设H2、C3H8的物质的量分别为x,y x + y = 5 (571.6/2)(x) + 2220y = 3847 x = 3.75 moly = 1.25 mol V(H2):V(C3H8) =n(H2):n(C3H8) = 3.75:1.25 = 3:1答:氢气和丙烷的体积比为 3:1氧气不足:
燃烧就不完全,浪费资源,产生的大量CO等危害人体健康;
氧气过量:
过量的空气会带走部分热量,同样造成浪费
1.高温煅烧石灰石
2.氧化钙与水的反应
3.HCl与NaOH溶液反应
4.高温下C+CO2 CO
5.Ca(OH)2和NH4Cl的反应
6.炽热的碳与H2O的反应
7.甲烷在氧气中的燃烧放热放热吸热吸热吸热吸热放热例1: 写出下列反应的热化学方程式:1、常温下,1g 碳在氧气中完全燃烧放出33kJ的热量。
。2、常温下,1g甲烷在氧气中完全燃烧生成水和二氧化碳并放出56kJ热量。
。
C(s)+O2(g) = CO2(g) △ H=-396kJ/mol例2: 为什么等质量的碳和甲烷完全燃烧之后释放的热量不同的?热值不同热值:在一定的条件下单位质量的物质完全燃烧所放出的热量。几种常见燃料的热值单位:KJ/g“西气东输”工程 为什么不同物质的热值不同?想一想: 燃料燃烧释放的能量等于反应物的总能量与生成物的总能量的相对大小。
从能量角度来讲:Q = E(反应物) – E(生成物)
反应物生成物热量吸收热量放出热量例 2H2+O2=H20拆开1mol H2 需436KJ
拆开1molO2需496KJ
形成1mol H-O键释放463KJ·2H-H + O=O4H + 2O2H-O-H吸收:2× 436 + 496放出:4 × 463 4H﹢2O 程过应反能量2H2﹢O22H2O 交流与讨论:吸收能量 KJ1368放出能量 KJ1852放出 KJ484 燃料燃烧释放的能量等于形成生成物分子中化学键释放的能量与断裂反应物分子中化学键所吸收的能量之差。 Q = E(形成化学键)–E(断裂化学键)从化学键角度来讲:例:氢气在氧气中燃烧产生蓝色火焰,在反应中,
破坏1molH-H键消耗的能量为Q1kJ,
破坏1molO = O键消耗的能量为Q2kJ,
形成1molH-O键释放的能量为Q3kJ。
下列关系式中正确的是( )
A. 2Q1 + Q2 > 4Q3 B. 2Q1 + Q2 < 4Q3
C. Q1 + Q2 < Q3 D. Q1 + Q2 = Q3B二、燃料的燃烧可燃物与氧气发生的发光、 发热的剧烈的化学反应。1、可燃物
2、温度达到着火点
3、有氧气的存在燃烧:2、条件: 1、定义: 实例:煤、石油、天然气的燃烧。燃料完全燃烧的条件1.燃烧时要充足的氧气2.燃料与氧气要有充足的接触面积(1)将固体燃料粉碎
(2)液体燃料汽化练习:简要说明使煤炉中的煤完全燃烧所应采取的措施。打开炉门在煤饼上打孔或将煤做成蜂窝状燃烧时要有充足的氧气燃料与氧气要有充足的接触面将焦炭在高温下与水蒸气反应,则得到CO和H2高效清洁利用煤炭的重要途径【问题】:
某居民原先使用液化石油气燃料(C3H8),自从“西气东输”工程建起后,家里开始使用天然气(CH4),那么他家的炉具应该做怎样的调整?
答:应减少 或增大 。CH4进入的量氧气进入的的量分析: C3H8 + 5O2 = 3CO2 + 4H2O
CH4 + 2O2 = CO2 + 2H2O
(1)我国的能源结构图:
(2)我国与世界能源结构的对比 【自主讨论】
我国能源结构的缺点和应对方法(环保、防止能源危机)。 化石燃料存在的不足 1、化石燃料为不可再生燃料,用一次少一次;4、化石燃料燃烧常发生不完全燃烧,释放CO和大量烟尘污染环境,危害人体健康2、化石燃料存在着燃烧率不高,利用率较低等等问题;3、某些化石燃料燃烧释放的废气中有SO2和氮氧化物,污染空气并形成酸雨;采取的措施 1、改变燃料状态,增大燃料与空气的接触面积,提高燃烧率,减少有害气体的排放。2、对煤进行脱硫处理,减少SO2 产生形成酸雨。3、用化学手法处理燃料,提高燃料燃烧率 。 4、采取核能、氢能、太阳能等高能无污染的新能源。【课堂小结】:
1、下列燃料不属于化石燃料的是( )
A、煤 B.石油 C、水煤气 D、天然气
2、为了更好的解决能源问题,人们一方面研究如何提高燃料的燃烧效率,另一方面寻找新能源。以下做法不能提高燃料效率的是( )
A、煤的汽化与液化 B、液体燃料呈雾状喷出
C、通入大大过量的空气 D、将煤块粉碎
CC3、为了迎接2008年北京奥运会的到来,北京市的公交车及部分出租车已采用LPG(液化石油气)作为汽车的燃料,其主要目的在于( )
A、防止石油短缺 B、减少尾气对大气的污染
C、降低成本 D、加大发动机的动力
B4、已知下列热化学方程式:
C( s ) + O2 ( g ) = CO2 ( g ) △H =- 393.5 kJ ?mol-1
CO(g) + 1/2O2 (g) = CO2 (g) △H =- 283.0 kJ ?mol-1
计算 1 mol 固态碳粉燃烧生成CO ( g )放出的热量,并写出相应的热化学方程式。C( s ) + 1/2O2 ( g ) = CO ( g ) △H =- 110.5 kJ ?mol-15、在一定条件下,氢气和丙烷燃烧的化学方程式为:
2H2( g ) + O2 ( g ) = 2H2O ( l ) ; △H =- 571.6 kJ ?mol-1
C3H8(g) +5O2 (g) = 3CO2 (g) +4H2O (l) ;△H =- 2220 kJ ?mol-1
5mol 氢气和丙烷的混合气完全燃烧时放热3847kJ,则
氢气和甲烷的体积比为 ( )
(A) 1:3 (B) 3:1 (C) 1:4 (D) 1:1B解:设H2、C3H8的物质的量分别为x,y x + y = 5 (571.6/2)(x) + 2220y = 3847 x = 3.75 moly = 1.25 mol V(H2):V(C3H8) =n(H2):n(C3H8) = 3.75:1.25 = 3:1答:氢气和丙烷的体积比为 3:1氧气不足:
燃烧就不完全,浪费资源,产生的大量CO等危害人体健康;
氧气过量:
过量的空气会带走部分热量,同样造成浪费
