元素周期表学案及练习
图片预览



文档简介
第一章《物质结构 元素周期律》
第一节 元素周期表学案(1)
班级: 姓名:
基本要求:
1、能描述元素周期表的结构(周期、族),知道元素在周期表中的位置;
2、了解1-18号元素原子核外电子的排布;
3、掌握元素周期表中周期序数与原子电子层数的关系,以及元素周期表中主族序数与原子最外层电子数的关系;
发展要求:核外电子排布的规律。
新知学习:
[学生活动]:画出元素周期表的前18号元素的原子结构示意图,找出现代元素周期表的具体编排原则?
前18号元素的原子结构示意图
1. 元素周期表的编排原则:原子序数= = =
(1)将_______________________的元素按______________________的顺序从左到右排成横行
(2)把_______________________的元素按______________________的顺序从上到下排成纵行
2. 周期表的结构
(1)周期:元素周期表共有 个横行,每一横行称为一个 ,故元素周期表共有 个周期。
①周期序数与电子层数的关系:
②周期的分类:元素周期表中我们把 周期称为短周期,其他周期称为长周期,完成下表。
类别 周期序数 起止元素 包括元素种数 核外电子层数
短周期 1
2
3
长周期 4
5
6
7
[思考]: 如果第七周期排满后,应有几种元素?__________________
镧系元素 57La~71Lu 15种元素 属于 周期元素;
锕系元素 89Ac~103Lr 15种元素 属于 周期元素。
(2)族:元素周期表共有 个纵行,除了 三个纵行称为Ⅷ外,其余的每一个纵行称为一个 ,故元素周期表共有 个族。族的序号一般用罗马数字表示。
①族的分类
元素周期表中,我们把 个纵行共分为 个族,其中 个主族, 个副族,一个 族,一个 族。
a、主族:由 元素和 元素共同构成的族,用A表示:如:ⅠA、ⅡA、ⅢA、
ⅣA、ⅤA、ⅥA、ⅦA
b、副族:完全由 元素构成的族,用B表示:ⅠB、ⅡB、ⅢB、ⅣB、ⅤB、ⅥB、ⅦB
c、第Ⅷ族: 三个纵行 (注意: 第Ⅷ族既不是主族也不是副族)
d、零族:第 __ _ 纵行,即稀有气体元素
②主族序数与最外层电子数的关系:
③族的别称
如 ⅠA称为 元素 ⅦA称为 元素 零族称为 元素
填写下表(注意:主族的族序数=元素原子的最外层电子数)
族类 A B Ⅷ 0
列序号 1、2、13、14、15、16、17 3、4、5、6、7、11、12 8、9、10 18
族序号
[思考]:为什么将第18列元素称为0族元素?
如果将来发现了119号元素,请你推测它所在周期表中的位置: 周期, 族。
课堂练习:
1、已知某主族元素的原子结构示意图如下,判断其位于第几周期,第几族?你能判断它们分别是什么元素吗?可对照元素周期表。
第一节 元素周期表练习(1)
班级: 姓名:
1.同周期元素,其原子结构相同之处是( ),同主族元素,其原子结构相同之处是( )
A.最外层电子数 B.核电荷数 C.电子层数 D.核外电子数
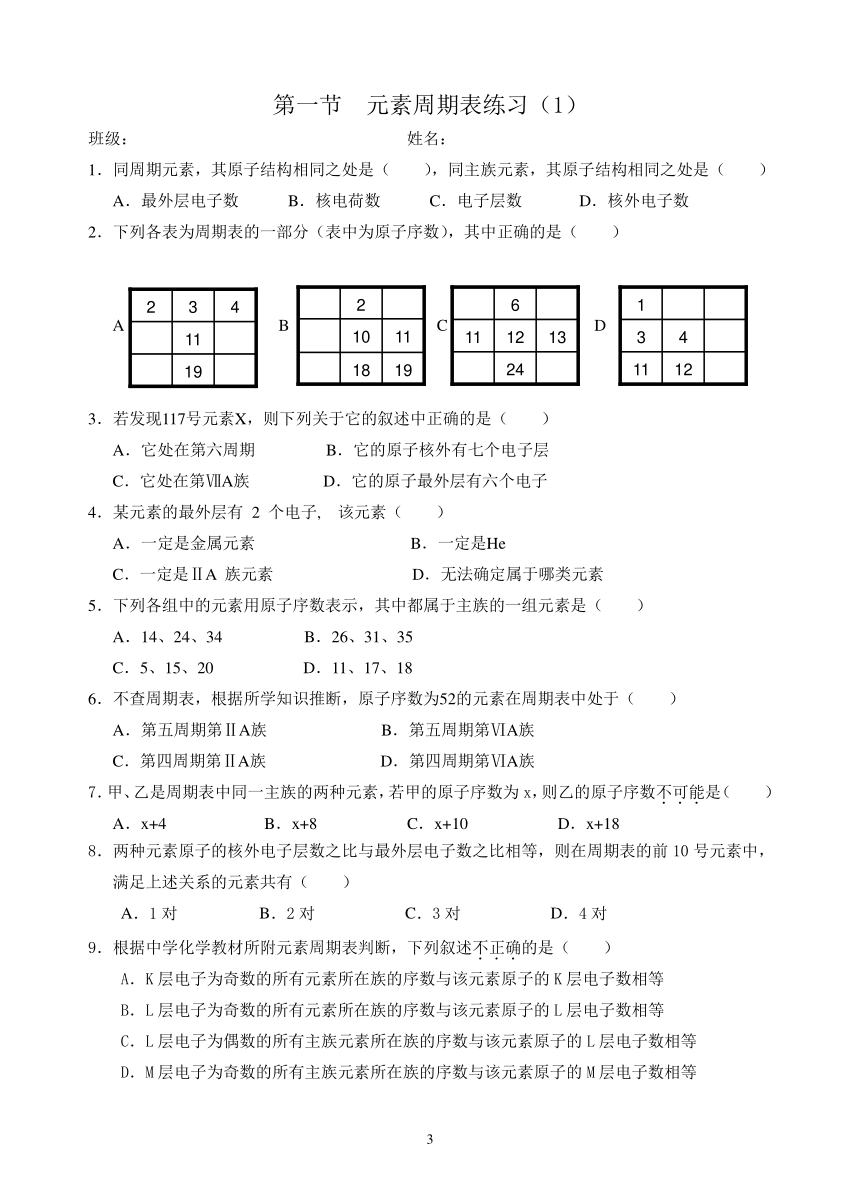
2.下列各表为周期表的一部分(表中为原子序数),其中正确的是( )
A B C D
3.若发现117号元素X,则下列关于它的叙述中正确的是( )
A.它处在第六周期 B.它的原子核外有七个电子层
C.它处在第ⅦA族 D.它的原子最外层有六个电子
4.某元素的最外层有 2 个电子, 该元素( )
A.一定是金属元素 B.一定是He
C.一定是ⅡA 族元素 D.无法确定属于哪类元素
5.下列各组中的元素用原子序数表示,其中都属于主族的一组元素是( )
A.14、24、34 B.26、31、35
C.5、15、20 D.11、17、18
6.不查周期表,根据所学知识推断,原子序数为52的元素在周期表中处于( )
A.第五周期第ⅡA族 B.第五周期第ⅥA族
C.第四周期第ⅡA族 D.第四周期第ⅥA族
7.甲、乙是周期表中同一主族的两种元素,若甲的原子序数为x,则乙的原子序数不可能是( )
A.x+4 B.x+8 C.x+10 D.x+18
8.两种元素原子的核外电子层数之比与最外层电子数之比相等,则在周期表的前10号元素中,满足上述关系的元素共有( )
A.1对 B.2对 C.3对 D.4对
9.根据中学化学教材所附元素周期表判断,下列叙述不正确的是( )
A.K层电子为奇数的所有元素所在族的序数与该元素原子的K层电子数相等
B.L层电子为奇数的所有元素所在族的序数与该元素原子的L层电子数相等
C.L层电子为偶数的所有主族元素所在族的序数与该元素原子的L层电子数相等
D.M层电子为奇数的所有主族元素所在族的序数与该元素原子的M层电子数相等
10.A、B、C均为短周期元素,它们在周期表中的位置如下图所示。已知:B、C两元素原子最外层电子数之和等于A元素原子最外层电子数的2倍;B、C两元素的核电荷数之和是A元素原子序数的4倍。则A、B、C分别是 ( )
A.C、Al、P B.N、Si、S
C.O、P、Cl D.F、S、Ar
11. 已知元素砷(As)的原子序数为33,下列叙述不正确的是( )
A.砷元素的最外层有3个电子 B. 砷元素是第四周期的主族元素
C.砷原子的第3电子层含有18个电子 D.砷的氧化物可能是As2O3或As2O5
12. 甲、乙、丙、丁四种元素的原子序数如表中所示,从周期表中找出这四种元素
(1)填写下表
元素 甲 乙 丙 丁
原子序数 6 8 11 13
元素符号
周期
族
(2)写出这几种元素的单质间反应的化学方程式
甲与乙_______________________________________
乙与丙_______________________________________
乙与丁_______________________________________
13.A、B、C、D均为短周期元素,A、B可形成两种液态化合物,其分子式分别为B2A2和B2A。A与D可形成气态化合物DA、DA2,DA2和水反应会生成DA。B与D可形成一种极易溶于水的碱性气体X,B与C可能形成极易溶于水的酸性气体Y,已知X分子与B2A分子中的电子数相等,Y分子中的电子数与为B2A2的电子数相等,X与Y相遇会产生白烟W,W受热分解又生成X和Y。请回答:
(1)写出四种元素的符号:A B C D
(2)写出下列反应的化学方程式:
①DA2+H2O→DA:
②X+Y→W:
C2+B2A2→A2:
C2+X→D2:
第一节 元素周期表学案(2)
班级: 姓名:
基本要求:
1、 以IA 和VIIA 族为例,掌握同一主族元素性质递变规律与原子结构的关系。
2、 元素在周期表中的位置及其性质的递变规律。
发展要求:了解元素的金属性和非金属非金属性强弱的比较方法。
新知学习:
二、元素的性质与原子结构的关系
1、碱金属元素:位于 族,包括 6种元素。
(1)结构:查阅元素周期表中的有关信息,填写下表。
元素名称 元素符号 核电荷数 原子结构示意图 最外层电子数 电子层数 原子半径递变规律
碱金属元素
(2)化学性质
与氧气反应 与水反应
金属 化学方程式
Li
Na
K
碱金属 钾 钠
实验现象 共同点 金属浮在水面上,B、 C、 D、 E、反应后的溶液滴入酚酞呈现 色。
不同点 与水反应更剧烈。
化学方程式
注意:比较元素金属性强弱可以从其单质与水(或酸)反应置换出氢的难易程度,以及它们的最高价氧化物的水化物(氢氧化物)的碱性强弱来比较。
结论:碱金属元素原子的最外层都只有 个电子,因此它们的化学性质相似,在化合物中化合价都为 。随着核电荷数的增加,碱金属元素原子的电子层数逐渐 ,原子半径逐渐 ,原子核对最外层电子的引力逐渐 。原子失电子的能力逐渐 。元素的金属性逐渐 。
(3)物理性质:阅读课本第7页表1-1总结规律:
相似性: 除Cs略带金属光泽外,其余的都是_________色,它们都比较________,有________性。密度都比较_________,点也都比较________ ,导电性和导热性也都_____________。
递变性:随核电荷数的增多,碱金属的密度逐渐________(ρNa>ρK),熔、沸点逐渐________。
思考:锂和钾的保存方法?______________________________________________________
2、 卤族元素:位于 族,包括 5种元素。
[学与问]画出F、Cl、Br、I元素的原子结构示意图。根据卤素的原子结构,请你试着推测一下氟、氯、溴、碘在化学性质上所表现的相似性和递变性。
(1) 物理性质:
颜色及状态:F2 Cl2 Br2 I2
密度及熔、沸点:随着核电荷数的递增,密度依次 ,熔、沸点依次 。
(2) 化学性质
单质 反应条件 氢化物的稳定性 化学方程式
F2
Cl2
Br2
I2
卤素单质与氢气反应:
规律:从F2到I2,与氢气反应的剧烈程度依次 ,生成氢化物的稳定性依次 。
卤素单质间的置换反应:
实验 现象 化学方程式
1、氯水加入NaBr溶液,后加CCl4
2、氯水加入KI溶液,后加CCl4
3、溴水加入KI溶液,后加CCl4
结论:随着核电荷数增加,卤素单质的氧化性逐渐 。
3、 同主族元素的性质与原子结构的关系:
元素性质的影响因素:元素性质与原子结构有密切的关系,特别是 有关。
同主族元素性质的递变规律:同主族元素从上到下原子核外电子层数依次 ,原子半径逐渐 ,失电子能力逐渐 ,得电子能力逐渐 。所以,金属性逐渐 ,非金属性逐渐 。
第一节 元素周期表练习(2)
班级: 姓名:
1. 下列金属与水反应最剧烈的是( )
A. Li B. K C. Rb D. Cs
2. 钠和铯都是碱金属元素,下列关于铯及其化合物的叙述中不正确的是( )
A. 硫酸铯的化学式为Cs2SO4 B. 氢氧化铯是一种强碱
C. 铯的熔沸点比钠的低 D. 碳酸铯受热易分解成氧化铯和二氧化碳
3.下列金属中密度最小、熔沸点最高的是( )
A. Rb B. K C. Na D. Li
4. 下列对碱金属性质的叙述中,不正确的是( )
A.单质都比较软 B. 单质都能跟氯气发生剧烈反应
C. 氢氧化物都能使酚酞试液变红色 D. 锂和钠一样可以保存在煤油里
5. 按Li、Na、K、Rb、Cs顺序递增的性质是( )
A. 单质的还原性 B. 单质的密度
C. 原子半径 D. 单质的熔、沸点
6.钾的金属活动性比钠强,根本原因是( )
A. 钾的密度比钠的小 B. 钾原子的电子层比钠原子多一层
C. 钾与水反应比钠与水反应更剧烈 D. 加热时,钾比钠更易液化
7.下列叙述中正确的是( )
A.在碱金属元素中,所有碱金属的氧化物均属于碱性氧化物
B.由于活泼性NaC.碱金属在自然界中都以化合态存在.
D.碱金属元素的单质在空气中燃烧生成的都是过氧化物
8. 下列对碱金属铷的性质预测正确的是( )
A. 灼烧氯化铷时,火焰有特殊颜色 B. 它只存在一种氧化物
C. 它的碳酸盐易溶于水 D. 在钠、钾、铷中,铷的熔点最高
9.钾有以下性质①钾比水轻 ② 钾的熔点低 ③ 钾与水反应要放出热量 ④钾与水反应后的溶液呈碱性. 某学生将一小块钾投入滴有酚酞的水中,该实验能证明上述四点性质的有( )
A. ①④ B. ①②④ C. ①③④ D. ①②③④
10.已知溴易挥发,碘易升华,向含有NaBr和KI的混合溶液中通入过量的氯气,充分反应后将溶液蒸干,并灼烧所得物质,最后剩余的固体是( )
A.NaCl 和KI B.NaCl、KCl和I2 C.KCl和 NaBr D.KCl和 NaCl
11. 由单质直接合成HX的方法,对于下列哪一种HX的制备有实用价值( )
A.HBr B.HF C.HCl D. HI
12.关于卤族元素的下列叙述中正确的是( )
A.卤族元素是典型的非金属元素,因此不能与其他非金属元素反应
B.卤族元素单质越活泼,其熔点和沸点就越高
C.卤族元素单质都能和NaOH溶液反应
D.卤族元素的单质都能和氢气反应,且生成的气态氢化物的稳定性随原子序数的增加而增强
13.甲、乙、丙三种溶液中各含有一种X(X为Cl-、Br-、I-),向甲中加淀粉溶液和氯水,溶液变为橙色,再加丙溶液颜色无明显变化,则甲、乙、丙依次含有( )
A.Br-、Cl-、I- B. Br-、I- 、Cl- C.I-、Br-、Cl- D.Cl-、I- 、Br-
14. 一定质量的钠、钾投入一定量的稀盐酸中,产生气体随时间变化的曲线如下图所示,则下列说法中正确的是 ( )
A.曲线a为K,b为Na
B.投入的Na的质量大于K的质量
C.投入的Na、K一定等质量
D.稀盐酸的量一定是不足量的
15. 、_______、_______、_______、_______等五种碱金属元素(填元素符号,Fr除外)其中密度最小的是_______,熔点最低的是______,金属性最强的是_______,氧化物对应的水化物碱性最强的是_______,等质量的金属与水反应最剧烈的是_______,生成氢气最多的是_________.
16.某学生往一支试管里管按一定顺序分别加入下列几种物质:A.KI溶液,B.淀粉溶液,C.NaOH溶液,D.氯水,发现溶液颜色按下面次序变化:无色→棕黄色→蓝色→无色
依据溶液颜色的变化回答下列问题:
(1)加入以上药品的顺序是:
(2)→的离子反应方程式,若为氧化还原反应,请标明电子转移的方向和数目:
(3)写出→的化学反应方程式:
17.元素X的原子获得3个电子或元素Y的原子失去2个电子后,它们的电子层结构与氖原子的电子层结构相同。X、Y两种元素的单质在点燃条件下得到的化合物的化学式为 ,元素X在周期表中是第 族。元素Y在周期表中位于第 周期。
18. X、Y、Z是相邻的三种短周期元素,X和Y同周期,Y和Z同主族,三种元素原子的最外层电子数之和为17,核内质子数之和为31,则X 、Y 、Z (填元素符号)。
1
3
4
11
12
6
11
12
13
24
2
10
11
18
19
2
3
4
11
19
PAGE
8
第一节 元素周期表学案(1)
班级: 姓名:
基本要求:
1、能描述元素周期表的结构(周期、族),知道元素在周期表中的位置;
2、了解1-18号元素原子核外电子的排布;
3、掌握元素周期表中周期序数与原子电子层数的关系,以及元素周期表中主族序数与原子最外层电子数的关系;
发展要求:核外电子排布的规律。
新知学习:
[学生活动]:画出元素周期表的前18号元素的原子结构示意图,找出现代元素周期表的具体编排原则?
前18号元素的原子结构示意图
1. 元素周期表的编排原则:原子序数= = =
(1)将_______________________的元素按______________________的顺序从左到右排成横行
(2)把_______________________的元素按______________________的顺序从上到下排成纵行
2. 周期表的结构
(1)周期:元素周期表共有 个横行,每一横行称为一个 ,故元素周期表共有 个周期。
①周期序数与电子层数的关系:
②周期的分类:元素周期表中我们把 周期称为短周期,其他周期称为长周期,完成下表。
类别 周期序数 起止元素 包括元素种数 核外电子层数
短周期 1
2
3
长周期 4
5
6
7
[思考]: 如果第七周期排满后,应有几种元素?__________________
镧系元素 57La~71Lu 15种元素 属于 周期元素;
锕系元素 89Ac~103Lr 15种元素 属于 周期元素。
(2)族:元素周期表共有 个纵行,除了 三个纵行称为Ⅷ外,其余的每一个纵行称为一个 ,故元素周期表共有 个族。族的序号一般用罗马数字表示。
①族的分类
元素周期表中,我们把 个纵行共分为 个族,其中 个主族, 个副族,一个 族,一个 族。
a、主族:由 元素和 元素共同构成的族,用A表示:如:ⅠA、ⅡA、ⅢA、
ⅣA、ⅤA、ⅥA、ⅦA
b、副族:完全由 元素构成的族,用B表示:ⅠB、ⅡB、ⅢB、ⅣB、ⅤB、ⅥB、ⅦB
c、第Ⅷ族: 三个纵行 (注意: 第Ⅷ族既不是主族也不是副族)
d、零族:第 __ _ 纵行,即稀有气体元素
②主族序数与最外层电子数的关系:
③族的别称
如 ⅠA称为 元素 ⅦA称为 元素 零族称为 元素
填写下表(注意:主族的族序数=元素原子的最外层电子数)
族类 A B Ⅷ 0
列序号 1、2、13、14、15、16、17 3、4、5、6、7、11、12 8、9、10 18
族序号
[思考]:为什么将第18列元素称为0族元素?
如果将来发现了119号元素,请你推测它所在周期表中的位置: 周期, 族。
课堂练习:
1、已知某主族元素的原子结构示意图如下,判断其位于第几周期,第几族?你能判断它们分别是什么元素吗?可对照元素周期表。
第一节 元素周期表练习(1)
班级: 姓名:
1.同周期元素,其原子结构相同之处是( ),同主族元素,其原子结构相同之处是( )
A.最外层电子数 B.核电荷数 C.电子层数 D.核外电子数
2.下列各表为周期表的一部分(表中为原子序数),其中正确的是( )
A B C D
3.若发现117号元素X,则下列关于它的叙述中正确的是( )
A.它处在第六周期 B.它的原子核外有七个电子层
C.它处在第ⅦA族 D.它的原子最外层有六个电子
4.某元素的最外层有 2 个电子, 该元素( )
A.一定是金属元素 B.一定是He
C.一定是ⅡA 族元素 D.无法确定属于哪类元素
5.下列各组中的元素用原子序数表示,其中都属于主族的一组元素是( )
A.14、24、34 B.26、31、35
C.5、15、20 D.11、17、18
6.不查周期表,根据所学知识推断,原子序数为52的元素在周期表中处于( )
A.第五周期第ⅡA族 B.第五周期第ⅥA族
C.第四周期第ⅡA族 D.第四周期第ⅥA族
7.甲、乙是周期表中同一主族的两种元素,若甲的原子序数为x,则乙的原子序数不可能是( )
A.x+4 B.x+8 C.x+10 D.x+18
8.两种元素原子的核外电子层数之比与最外层电子数之比相等,则在周期表的前10号元素中,满足上述关系的元素共有( )
A.1对 B.2对 C.3对 D.4对
9.根据中学化学教材所附元素周期表判断,下列叙述不正确的是( )
A.K层电子为奇数的所有元素所在族的序数与该元素原子的K层电子数相等
B.L层电子为奇数的所有元素所在族的序数与该元素原子的L层电子数相等
C.L层电子为偶数的所有主族元素所在族的序数与该元素原子的L层电子数相等
D.M层电子为奇数的所有主族元素所在族的序数与该元素原子的M层电子数相等
10.A、B、C均为短周期元素,它们在周期表中的位置如下图所示。已知:B、C两元素原子最外层电子数之和等于A元素原子最外层电子数的2倍;B、C两元素的核电荷数之和是A元素原子序数的4倍。则A、B、C分别是 ( )
A.C、Al、P B.N、Si、S
C.O、P、Cl D.F、S、Ar
11. 已知元素砷(As)的原子序数为33,下列叙述不正确的是( )
A.砷元素的最外层有3个电子 B. 砷元素是第四周期的主族元素
C.砷原子的第3电子层含有18个电子 D.砷的氧化物可能是As2O3或As2O5
12. 甲、乙、丙、丁四种元素的原子序数如表中所示,从周期表中找出这四种元素
(1)填写下表
元素 甲 乙 丙 丁
原子序数 6 8 11 13
元素符号
周期
族
(2)写出这几种元素的单质间反应的化学方程式
甲与乙_______________________________________
乙与丙_______________________________________
乙与丁_______________________________________
13.A、B、C、D均为短周期元素,A、B可形成两种液态化合物,其分子式分别为B2A2和B2A。A与D可形成气态化合物DA、DA2,DA2和水反应会生成DA。B与D可形成一种极易溶于水的碱性气体X,B与C可能形成极易溶于水的酸性气体Y,已知X分子与B2A分子中的电子数相等,Y分子中的电子数与为B2A2的电子数相等,X与Y相遇会产生白烟W,W受热分解又生成X和Y。请回答:
(1)写出四种元素的符号:A B C D
(2)写出下列反应的化学方程式:
①DA2+H2O→DA:
②X+Y→W:
C2+B2A2→A2:
C2+X→D2:
第一节 元素周期表学案(2)
班级: 姓名:
基本要求:
1、 以IA 和VIIA 族为例,掌握同一主族元素性质递变规律与原子结构的关系。
2、 元素在周期表中的位置及其性质的递变规律。
发展要求:了解元素的金属性和非金属非金属性强弱的比较方法。
新知学习:
二、元素的性质与原子结构的关系
1、碱金属元素:位于 族,包括 6种元素。
(1)结构:查阅元素周期表中的有关信息,填写下表。
元素名称 元素符号 核电荷数 原子结构示意图 最外层电子数 电子层数 原子半径递变规律
碱金属元素
(2)化学性质
与氧气反应 与水反应
金属 化学方程式
Li
Na
K
碱金属 钾 钠
实验现象 共同点 金属浮在水面上,B、 C、 D、 E、反应后的溶液滴入酚酞呈现 色。
不同点 与水反应更剧烈。
化学方程式
注意:比较元素金属性强弱可以从其单质与水(或酸)反应置换出氢的难易程度,以及它们的最高价氧化物的水化物(氢氧化物)的碱性强弱来比较。
结论:碱金属元素原子的最外层都只有 个电子,因此它们的化学性质相似,在化合物中化合价都为 。随着核电荷数的增加,碱金属元素原子的电子层数逐渐 ,原子半径逐渐 ,原子核对最外层电子的引力逐渐 。原子失电子的能力逐渐 。元素的金属性逐渐 。
(3)物理性质:阅读课本第7页表1-1总结规律:
相似性: 除Cs略带金属光泽外,其余的都是_________色,它们都比较________,有________性。密度都比较_________,点也都比较________ ,导电性和导热性也都_____________。
递变性:随核电荷数的增多,碱金属的密度逐渐________(ρNa>ρK),熔、沸点逐渐________。
思考:锂和钾的保存方法?______________________________________________________
2、 卤族元素:位于 族,包括 5种元素。
[学与问]画出F、Cl、Br、I元素的原子结构示意图。根据卤素的原子结构,请你试着推测一下氟、氯、溴、碘在化学性质上所表现的相似性和递变性。
(1) 物理性质:
颜色及状态:F2 Cl2 Br2 I2
密度及熔、沸点:随着核电荷数的递增,密度依次 ,熔、沸点依次 。
(2) 化学性质
单质 反应条件 氢化物的稳定性 化学方程式
F2
Cl2
Br2
I2
卤素单质与氢气反应:
规律:从F2到I2,与氢气反应的剧烈程度依次 ,生成氢化物的稳定性依次 。
卤素单质间的置换反应:
实验 现象 化学方程式
1、氯水加入NaBr溶液,后加CCl4
2、氯水加入KI溶液,后加CCl4
3、溴水加入KI溶液,后加CCl4
结论:随着核电荷数增加,卤素单质的氧化性逐渐 。
3、 同主族元素的性质与原子结构的关系:
元素性质的影响因素:元素性质与原子结构有密切的关系,特别是 有关。
同主族元素性质的递变规律:同主族元素从上到下原子核外电子层数依次 ,原子半径逐渐 ,失电子能力逐渐 ,得电子能力逐渐 。所以,金属性逐渐 ,非金属性逐渐 。
第一节 元素周期表练习(2)
班级: 姓名:
1. 下列金属与水反应最剧烈的是( )
A. Li B. K C. Rb D. Cs
2. 钠和铯都是碱金属元素,下列关于铯及其化合物的叙述中不正确的是( )
A. 硫酸铯的化学式为Cs2SO4 B. 氢氧化铯是一种强碱
C. 铯的熔沸点比钠的低 D. 碳酸铯受热易分解成氧化铯和二氧化碳
3.下列金属中密度最小、熔沸点最高的是( )
A. Rb B. K C. Na D. Li
4. 下列对碱金属性质的叙述中,不正确的是( )
A.单质都比较软 B. 单质都能跟氯气发生剧烈反应
C. 氢氧化物都能使酚酞试液变红色 D. 锂和钠一样可以保存在煤油里
5. 按Li、Na、K、Rb、Cs顺序递增的性质是( )
A. 单质的还原性 B. 单质的密度
C. 原子半径 D. 单质的熔、沸点
6.钾的金属活动性比钠强,根本原因是( )
A. 钾的密度比钠的小 B. 钾原子的电子层比钠原子多一层
C. 钾与水反应比钠与水反应更剧烈 D. 加热时,钾比钠更易液化
7.下列叙述中正确的是( )
A.在碱金属元素中,所有碱金属的氧化物均属于碱性氧化物
B.由于活泼性Na
D.碱金属元素的单质在空气中燃烧生成的都是过氧化物
8. 下列对碱金属铷的性质预测正确的是( )
A. 灼烧氯化铷时,火焰有特殊颜色 B. 它只存在一种氧化物
C. 它的碳酸盐易溶于水 D. 在钠、钾、铷中,铷的熔点最高
9.钾有以下性质①钾比水轻 ② 钾的熔点低 ③ 钾与水反应要放出热量 ④钾与水反应后的溶液呈碱性. 某学生将一小块钾投入滴有酚酞的水中,该实验能证明上述四点性质的有( )
A. ①④ B. ①②④ C. ①③④ D. ①②③④
10.已知溴易挥发,碘易升华,向含有NaBr和KI的混合溶液中通入过量的氯气,充分反应后将溶液蒸干,并灼烧所得物质,最后剩余的固体是( )
A.NaCl 和KI B.NaCl、KCl和I2 C.KCl和 NaBr D.KCl和 NaCl
11. 由单质直接合成HX的方法,对于下列哪一种HX的制备有实用价值( )
A.HBr B.HF C.HCl D. HI
12.关于卤族元素的下列叙述中正确的是( )
A.卤族元素是典型的非金属元素,因此不能与其他非金属元素反应
B.卤族元素单质越活泼,其熔点和沸点就越高
C.卤族元素单质都能和NaOH溶液反应
D.卤族元素的单质都能和氢气反应,且生成的气态氢化物的稳定性随原子序数的增加而增强
13.甲、乙、丙三种溶液中各含有一种X(X为Cl-、Br-、I-),向甲中加淀粉溶液和氯水,溶液变为橙色,再加丙溶液颜色无明显变化,则甲、乙、丙依次含有( )
A.Br-、Cl-、I- B. Br-、I- 、Cl- C.I-、Br-、Cl- D.Cl-、I- 、Br-
14. 一定质量的钠、钾投入一定量的稀盐酸中,产生气体随时间变化的曲线如下图所示,则下列说法中正确的是 ( )
A.曲线a为K,b为Na
B.投入的Na的质量大于K的质量
C.投入的Na、K一定等质量
D.稀盐酸的量一定是不足量的
15. 、_______、_______、_______、_______等五种碱金属元素(填元素符号,Fr除外)其中密度最小的是_______,熔点最低的是______,金属性最强的是_______,氧化物对应的水化物碱性最强的是_______,等质量的金属与水反应最剧烈的是_______,生成氢气最多的是_________.
16.某学生往一支试管里管按一定顺序分别加入下列几种物质:A.KI溶液,B.淀粉溶液,C.NaOH溶液,D.氯水,发现溶液颜色按下面次序变化:无色→棕黄色→蓝色→无色
依据溶液颜色的变化回答下列问题:
(1)加入以上药品的顺序是:
(2)→的离子反应方程式,若为氧化还原反应,请标明电子转移的方向和数目:
(3)写出→的化学反应方程式:
17.元素X的原子获得3个电子或元素Y的原子失去2个电子后,它们的电子层结构与氖原子的电子层结构相同。X、Y两种元素的单质在点燃条件下得到的化合物的化学式为 ,元素X在周期表中是第 族。元素Y在周期表中位于第 周期。
18. X、Y、Z是相邻的三种短周期元素,X和Y同周期,Y和Z同主族,三种元素原子的最外层电子数之和为17,核内质子数之和为31,则X 、Y 、Z (填元素符号)。
1
3
4
11
12
6
11
12
13
24
2
10
11
18
19
2
3
4
11
19
PAGE
8
