2010年江苏省普通高中学业水平测试(必修课目)化学模拟试卷
文档属性
| 名称 | 2010年江苏省普通高中学业水平测试(必修课目)化学模拟试卷 |

|
|
| 格式 | rar | ||
| 文件大小 | 197.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2010-03-01 00:00:00 | ||
图片预览

文档简介
2010年江苏省普通高中学业水平测试(必修课目)化学模拟试卷
本卷可能用到的相对原子质量 H:1 C:12 N:14 O:16 Na:23 Mg:24
Al:27 S:32 Cl:35.5 K:39 Fe:56
一、单项选择题:(本部分23题,每题3分,共69分。每题4个选项中,只有1个选项符合要求)。
1.下列污染现象主要与SO2有关的是
A.臭氧空洞 B.酸雨 C.光化学烟雾 D.温室效应
2.以下是一些常用的危险品标志,装运乙醇的包装箱应贴的图标是
A B C D
3.可以用来制半导体材料(如大规模集成电路)的是
A.二氧化硅 B.粗硅 C.高纯硅 D.硅酸盐
4.下列物质与反应的分类不正确的是
A.纯碱、醋酸钠都属于盐 B.氢气、一氧化碳的燃烧都属于放热反应
C.酒精、氧化铁都属于氧化物 D.铝与强酸、强碱的反应都属于氧化还原反应
5.既能与强酸又能与强碱反应的一组物质是
①Al ②Al2O3 ③Al(OH)3 ④NaHCO3
A.只有① B.只有② C.只有③ D.①、②、③、④均可
6.下列过程中发生化学变化的是
A.用四氯化碳萃取溴水中的溴 B.用蒸馏的方法制取蒸馏水
C.用过滤的方法除食盐水中的泥沙 D.用加热的方法除碳酸钠中碳酸氢钠
7.下列实验操作中:①过滤 ②蒸发 ③溶解 ④取液体试剂 ⑤取固体试剂,一定要用到玻璃棒的是
A.①②③ B.④⑤ C.①④ D.①③⑤
8.下列物质中属于共价化合物的是
A.苛性钠 B.氮气 C.氯化氢 D.氧化钠
9.下列关于浓硫酸的叙述正确的是
A.浓硫酸具有吸水性,因而能使蔗糖炭化
B.浓硫酸在常温下能够使铁、铝等金属钝化
C.浓硫酸在常温下可迅速与铜片反应放出二氧化硫气体
D.浓硫酸是一种干燥剂,能够干燥氨气、氢气等气体
10.下列反应不属于氧化还原反应的是
A.2F2 + 2H2O = 4HF + O2 B.Cl2 + H2O = HCl + HClO
C.Al2O3+2NaOH=2NaAlO2+H2O D.2Cl2 + 2Ca(OH)2 = CaCl2 + Ca(ClO)2 + 2H2O
11.下列叙述正确的是
A.CH4的摩尔质量为16g B.摩尔是国际单位制中七个基本物理量之一
C.3.01×1023个SO2分子的质量为32g D.标准状况下,1 mol任何物质体积均为22.4L
12.下列实验操作中有错误的是
A.分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出
B.萃取时,用酒精萃取碘水中的碘
C.蒸馏时,冷却水应从冷凝管的下口通入,上口流出
D.蒸发时,用玻璃棒不断搅拌以防暴沸
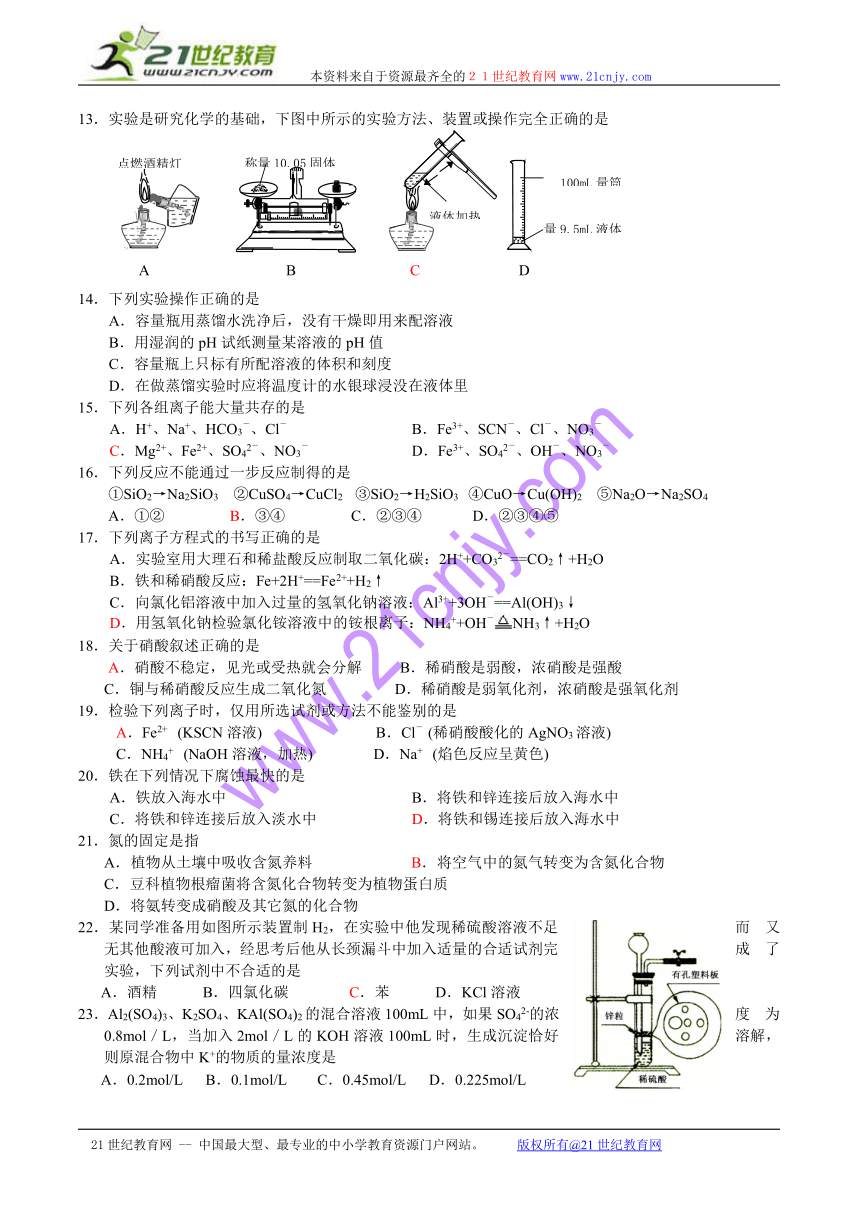
13.实验是研究化学的基础,下图中所示的实验方法、装置或操作完全正确的是
A B C D
14.下列实验操作正确的是
A.容量瓶用蒸馏水洗净后,没有干燥即用来配溶液
B.用湿润的pH试纸测量某溶液的pH值
C.容量瓶上只标有所配溶液的体积和刻度
D.在做蒸馏实验时应将温度计的水银球浸没在液体里
15.下列各组离子能大量共存的是
A.H+、Na+、HCO3-、Cl- B.Fe3+、SCN-、Cl-、NO3-
C.Mg2+、Fe2+、SO42-、NO3- D.Fe3+、SO42-、OH-、NO3-
16.下列反应不能通过一步反应制得的是
①SiO2→Na2SiO3 ②CuSO4→CuCl2 ③SiO2→H2SiO3 ④CuO→Cu(OH)2 ⑤Na2O→Na2SO4
A.①② B.③④ C.②③④ D.②③④⑤
17.下列离子方程式的书写正确的是
A.实验室用大理石和稀盐酸反应制取二氧化碳:2H++CO32-==CO2↑+H2O
B.铁和稀硝酸反应:Fe+2H+==Fe2++H2↑
C.向氯化铝溶液中加入过量的氢氧化钠溶液:Al3++3OH-==Al(OH)3↓
D.用氢氧化钠检验氯化铵溶液中的铵根离子:NH4++OH-NH3↑+H2O
18.关于硝酸叙述正确的是
A.硝酸不稳定,见光或受热就会分解 B.稀硝酸是弱酸,浓硝酸是强酸
C.铜与稀硝酸反应生成二氧化氮 D.稀硝酸是弱氧化剂,浓硝酸是强氧化剂
19.检验下列离子时,仅用所选试剂或方法不能鉴别的是
A.Fe2+ (KSCN溶液) B.Cl- (稀硝酸酸化的AgNO3溶液)
C.NH4+ (NaOH溶液,加热) D.Na+ (焰色反应呈黄色)
20.铁在下列情况下腐蚀最快的是
A.铁放入海水中 B.将铁和锌连接后放入海水中
C.将铁和锌连接后放入淡水中 D.将铁和锡连接后放入海水中
21.氮的固定是指
A.植物从土壤中吸收含氮养料 B.将空气中的氮气转变为含氮化合物
C.豆科植物根瘤菌将含氮化合物转变为植物蛋白质
D.将氨转变成硝酸及其它氮的化合物
22.某同学准备用如图所示装置制H2,在实验中他发现稀硫酸溶液不足而又无其他酸液可加入,经思考后他从长颈漏斗中加入适量的合适试剂完成了实验,下列试剂中不合适的是
A.酒精 B.四氯化碳 C.苯 D.KCl溶液
23.Al2(SO4)3、K2SO4、KAl(SO4)2的混合溶液100mL中,如果SO42-的浓度为0.8mol/L,当加入2mol/L的KOH溶液100mL时,生成沉淀恰好溶解,则原混合物中K+的物质的量浓度是
A.0.2mol/L B.0.1mol/L C.0.45mol/L D.0.225mol/L
2010年江苏省普通高中学业水平测试化学模拟试卷
将选择题的答案填在下表中:
题号
1
2
3
4
5
6
7
8
9
10
11
12
答案
题号
13
14
15
16
17
18
19
20
21
22
23
答案
二、非选择题(本部分3题,共31分)
24.⑴(5分)随着生活水平的提高,人们越来越关注营养平衡和自身的健康。
①有些学生从小偏食,不爱吃水果、蔬菜,结果营养缺乏、发育不良,这主要是由于摄取______________(填“脂肪”、“维生素”或“蛋白质”)不足引起的。
某同学每到傍晚时就看不清东西,可能原因之一是他体内缺乏__________________;
另一同学在刷牙时牙龈经常出血,他体内可能缺乏__________________。
②青霉素是医学上最早使用的天然 素,在体内经酸性水解后得到青霉氨基酸其结构简式为:,请写出青霉氨基酸可能具有的一种化学性质 。
⑵(5分)中国是世界上最早研究和生产合金的国家之一。
①在原子反应堆中得以广泛应用的钠钾合金在常温下呈液态,说明合金的熔点比其成分金属的熔点 。
②铜器表面容易生成一层薄薄的铜绿[主要成份是Cu2(OH)2CO3],请写出铜在潮湿空气与水、氧气、二氧化碳反应生成铜绿的化学方程式 ;铁在潮湿空气中很容易被腐蚀,主要发生的是 (填化学腐蚀或电化学腐蚀)。
③铁制品使用前进行下列处理,其目的与防腐无关的是 (填序号)。
A.镀锌 B.烤蓝 C.油漆 D.贴商标
⑶(5分)①CO2是目前大气中含量最高的一种温室气体,控制和治理CO2是解决温室效应的有效途径。请你写出有利于降低大气中CO2浓度的一项措施 。
②水中含有的悬浮颗粒物等杂质,可以加入 等混凝剂进行净化处理,利用其溶解后形成的 具有吸附作用使水中的悬浮颗粒物沉降。
③某工业废水中含有较多重金属离子Ba2+(剧毒,致死量30 mg),可向其中加入含_________离子的溶液,使Ba2+形成沉淀而除去。经检测,除去Ba2+后废水中的c(H+)=0.01 mol/L,请用离子方程式表示此工业废水排放前还须做何处理:__________________________________。
25.(6分)右图所涉及的物质均为中学化学中的常见物质,其中C为黄绿色气体、A为Fe,D在C中燃烧发生苍白色火焰,生成J,B是J的水溶液,H是红褐色沉淀。它们存在如下转化关系,反应中部分物质已略去。
⑴ 写出有关物质的化学式:C___________________,G___________________。
⑵ 写出A+F→E的离子方程式__________________________________________。
⑶ 写出G→H的化学方程式________________________________________。
26.(10分)某化学研究性学习小组用CO还原Fe2O3,并在实验结束后用磁铁吸出生成的黑色粉末X进行探究。
[探究目的] 分析黑色粉末X的组成,并进行相关实验。
[查阅资料]①CO还原Fe2O3的实验中若温度不同、受热不均时会生成Fe3O4,也能被磁铁吸引。
②Fe3O4+8H+=2Fe3++Fe2++4H2O
③Fe+4HNO3(稀)=Fe(NO3)3+NO↑+2H2O
④3Fe3O4+28HNO3(稀)=9Fe(NO3)3+NO↑+14H2O
[实验探究] I.定性检验
编号
实验操作
实验现象
①
取少量黑色粉末X放入试管1中,注入浓盐酸,微热
黑色粉末逐渐溶解,溶液呈黄绿色;有气泡产生
②
向试管1中滴加几滴KSCN溶液,振荡
溶液出现血红色
③
另取少量黑色粉末X放入试管2中,注入足量硫酸铜溶液,振荡,静置
有极少量红色物质析出,仍有较多黑色固体未溶解
⑴实验③发生的反应的离子方程式为 。
⑵上述实验说明黑色粉末X中含有 。
II.定量测定
根据下图所示的实验方案进行实验并记录数据:
⑴操作Z的名称是 。
⑵通过以上数据,得出13.12g黑色粉末X中各成分的物质的量为 。
⑶若溶液Y的体积仍为200mL,则溶液Y中c(Fe3+)= mol/L。
参考答案
题号
1
2
3
4
5
6
7
8
9
10
11
12
答案
B
D
C
C
D
D
A
C
B
C
C
B
题号
13
14
15
16
17
18
19
20
21
22
23
答案
C
A
C
B
D
A
A
D
B
C
B
24.(15分)
⑴(5分)①维生素 维生素A 维生素C
②抗生 酸性或能发生酯化反应或与酸反应等
⑵(5分)①低 ② 2Cu + O2 + CO2 + H2O =Cu2(OH)2CO3 ③D
⑶(5分)①减少化石燃料的使用、植树造林;少用空调和暖气、少开车、少坐飞机;利用太阳能、风能等
②明矾 Al(OH)3胶体 (或氯化铁 Fe(OH)3胶体)
③硫酸根离子 H+ +OH- = H2O
25.(6分)⑴ Cl2 Fe(OH)2 ⑵ Fe+2 Fe3+=3 Fe2+ ⑶ 4Fe(OH)2+O2+2H2O=4Fe(OH)3
26.(10分)
I.⑴Fe+Cu2+=Fe2++Cu ⑵Fe和Fe3O4
II.⑴过滤 ⑵Fe 0.11mol Fe3O4 0.03mol ⑶1
本卷可能用到的相对原子质量 H:1 C:12 N:14 O:16 Na:23 Mg:24
Al:27 S:32 Cl:35.5 K:39 Fe:56
一、单项选择题:(本部分23题,每题3分,共69分。每题4个选项中,只有1个选项符合要求)。
1.下列污染现象主要与SO2有关的是
A.臭氧空洞 B.酸雨 C.光化学烟雾 D.温室效应
2.以下是一些常用的危险品标志,装运乙醇的包装箱应贴的图标是
A B C D
3.可以用来制半导体材料(如大规模集成电路)的是
A.二氧化硅 B.粗硅 C.高纯硅 D.硅酸盐
4.下列物质与反应的分类不正确的是
A.纯碱、醋酸钠都属于盐 B.氢气、一氧化碳的燃烧都属于放热反应
C.酒精、氧化铁都属于氧化物 D.铝与强酸、强碱的反应都属于氧化还原反应
5.既能与强酸又能与强碱反应的一组物质是
①Al ②Al2O3 ③Al(OH)3 ④NaHCO3
A.只有① B.只有② C.只有③ D.①、②、③、④均可
6.下列过程中发生化学变化的是
A.用四氯化碳萃取溴水中的溴 B.用蒸馏的方法制取蒸馏水
C.用过滤的方法除食盐水中的泥沙 D.用加热的方法除碳酸钠中碳酸氢钠
7.下列实验操作中:①过滤 ②蒸发 ③溶解 ④取液体试剂 ⑤取固体试剂,一定要用到玻璃棒的是
A.①②③ B.④⑤ C.①④ D.①③⑤
8.下列物质中属于共价化合物的是
A.苛性钠 B.氮气 C.氯化氢 D.氧化钠
9.下列关于浓硫酸的叙述正确的是
A.浓硫酸具有吸水性,因而能使蔗糖炭化
B.浓硫酸在常温下能够使铁、铝等金属钝化
C.浓硫酸在常温下可迅速与铜片反应放出二氧化硫气体
D.浓硫酸是一种干燥剂,能够干燥氨气、氢气等气体
10.下列反应不属于氧化还原反应的是
A.2F2 + 2H2O = 4HF + O2 B.Cl2 + H2O = HCl + HClO
C.Al2O3+2NaOH=2NaAlO2+H2O D.2Cl2 + 2Ca(OH)2 = CaCl2 + Ca(ClO)2 + 2H2O
11.下列叙述正确的是
A.CH4的摩尔质量为16g B.摩尔是国际单位制中七个基本物理量之一
C.3.01×1023个SO2分子的质量为32g D.标准状况下,1 mol任何物质体积均为22.4L
12.下列实验操作中有错误的是
A.分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出
B.萃取时,用酒精萃取碘水中的碘
C.蒸馏时,冷却水应从冷凝管的下口通入,上口流出
D.蒸发时,用玻璃棒不断搅拌以防暴沸
13.实验是研究化学的基础,下图中所示的实验方法、装置或操作完全正确的是
A B C D
14.下列实验操作正确的是
A.容量瓶用蒸馏水洗净后,没有干燥即用来配溶液
B.用湿润的pH试纸测量某溶液的pH值
C.容量瓶上只标有所配溶液的体积和刻度
D.在做蒸馏实验时应将温度计的水银球浸没在液体里
15.下列各组离子能大量共存的是
A.H+、Na+、HCO3-、Cl- B.Fe3+、SCN-、Cl-、NO3-
C.Mg2+、Fe2+、SO42-、NO3- D.Fe3+、SO42-、OH-、NO3-
16.下列反应不能通过一步反应制得的是
①SiO2→Na2SiO3 ②CuSO4→CuCl2 ③SiO2→H2SiO3 ④CuO→Cu(OH)2 ⑤Na2O→Na2SO4
A.①② B.③④ C.②③④ D.②③④⑤
17.下列离子方程式的书写正确的是
A.实验室用大理石和稀盐酸反应制取二氧化碳:2H++CO32-==CO2↑+H2O
B.铁和稀硝酸反应:Fe+2H+==Fe2++H2↑
C.向氯化铝溶液中加入过量的氢氧化钠溶液:Al3++3OH-==Al(OH)3↓
D.用氢氧化钠检验氯化铵溶液中的铵根离子:NH4++OH-NH3↑+H2O
18.关于硝酸叙述正确的是
A.硝酸不稳定,见光或受热就会分解 B.稀硝酸是弱酸,浓硝酸是强酸
C.铜与稀硝酸反应生成二氧化氮 D.稀硝酸是弱氧化剂,浓硝酸是强氧化剂
19.检验下列离子时,仅用所选试剂或方法不能鉴别的是
A.Fe2+ (KSCN溶液) B.Cl- (稀硝酸酸化的AgNO3溶液)
C.NH4+ (NaOH溶液,加热) D.Na+ (焰色反应呈黄色)
20.铁在下列情况下腐蚀最快的是
A.铁放入海水中 B.将铁和锌连接后放入海水中
C.将铁和锌连接后放入淡水中 D.将铁和锡连接后放入海水中
21.氮的固定是指
A.植物从土壤中吸收含氮养料 B.将空气中的氮气转变为含氮化合物
C.豆科植物根瘤菌将含氮化合物转变为植物蛋白质
D.将氨转变成硝酸及其它氮的化合物
22.某同学准备用如图所示装置制H2,在实验中他发现稀硫酸溶液不足而又无其他酸液可加入,经思考后他从长颈漏斗中加入适量的合适试剂完成了实验,下列试剂中不合适的是
A.酒精 B.四氯化碳 C.苯 D.KCl溶液
23.Al2(SO4)3、K2SO4、KAl(SO4)2的混合溶液100mL中,如果SO42-的浓度为0.8mol/L,当加入2mol/L的KOH溶液100mL时,生成沉淀恰好溶解,则原混合物中K+的物质的量浓度是
A.0.2mol/L B.0.1mol/L C.0.45mol/L D.0.225mol/L
2010年江苏省普通高中学业水平测试化学模拟试卷
将选择题的答案填在下表中:
题号
1
2
3
4
5
6
7
8
9
10
11
12
答案
题号
13
14
15
16
17
18
19
20
21
22
23
答案
二、非选择题(本部分3题,共31分)
24.⑴(5分)随着生活水平的提高,人们越来越关注营养平衡和自身的健康。
①有些学生从小偏食,不爱吃水果、蔬菜,结果营养缺乏、发育不良,这主要是由于摄取______________(填“脂肪”、“维生素”或“蛋白质”)不足引起的。
某同学每到傍晚时就看不清东西,可能原因之一是他体内缺乏__________________;
另一同学在刷牙时牙龈经常出血,他体内可能缺乏__________________。
②青霉素是医学上最早使用的天然 素,在体内经酸性水解后得到青霉氨基酸其结构简式为:,请写出青霉氨基酸可能具有的一种化学性质 。
⑵(5分)中国是世界上最早研究和生产合金的国家之一。
①在原子反应堆中得以广泛应用的钠钾合金在常温下呈液态,说明合金的熔点比其成分金属的熔点 。
②铜器表面容易生成一层薄薄的铜绿[主要成份是Cu2(OH)2CO3],请写出铜在潮湿空气与水、氧气、二氧化碳反应生成铜绿的化学方程式 ;铁在潮湿空气中很容易被腐蚀,主要发生的是 (填化学腐蚀或电化学腐蚀)。
③铁制品使用前进行下列处理,其目的与防腐无关的是 (填序号)。
A.镀锌 B.烤蓝 C.油漆 D.贴商标
⑶(5分)①CO2是目前大气中含量最高的一种温室气体,控制和治理CO2是解决温室效应的有效途径。请你写出有利于降低大气中CO2浓度的一项措施 。
②水中含有的悬浮颗粒物等杂质,可以加入 等混凝剂进行净化处理,利用其溶解后形成的 具有吸附作用使水中的悬浮颗粒物沉降。
③某工业废水中含有较多重金属离子Ba2+(剧毒,致死量30 mg),可向其中加入含_________离子的溶液,使Ba2+形成沉淀而除去。经检测,除去Ba2+后废水中的c(H+)=0.01 mol/L,请用离子方程式表示此工业废水排放前还须做何处理:__________________________________。
25.(6分)右图所涉及的物质均为中学化学中的常见物质,其中C为黄绿色气体、A为Fe,D在C中燃烧发生苍白色火焰,生成J,B是J的水溶液,H是红褐色沉淀。它们存在如下转化关系,反应中部分物质已略去。
⑴ 写出有关物质的化学式:C___________________,G___________________。
⑵ 写出A+F→E的离子方程式__________________________________________。
⑶ 写出G→H的化学方程式________________________________________。
26.(10分)某化学研究性学习小组用CO还原Fe2O3,并在实验结束后用磁铁吸出生成的黑色粉末X进行探究。
[探究目的] 分析黑色粉末X的组成,并进行相关实验。
[查阅资料]①CO还原Fe2O3的实验中若温度不同、受热不均时会生成Fe3O4,也能被磁铁吸引。
②Fe3O4+8H+=2Fe3++Fe2++4H2O
③Fe+4HNO3(稀)=Fe(NO3)3+NO↑+2H2O
④3Fe3O4+28HNO3(稀)=9Fe(NO3)3+NO↑+14H2O
[实验探究] I.定性检验
编号
实验操作
实验现象
①
取少量黑色粉末X放入试管1中,注入浓盐酸,微热
黑色粉末逐渐溶解,溶液呈黄绿色;有气泡产生
②
向试管1中滴加几滴KSCN溶液,振荡
溶液出现血红色
③
另取少量黑色粉末X放入试管2中,注入足量硫酸铜溶液,振荡,静置
有极少量红色物质析出,仍有较多黑色固体未溶解
⑴实验③发生的反应的离子方程式为 。
⑵上述实验说明黑色粉末X中含有 。
II.定量测定
根据下图所示的实验方案进行实验并记录数据:
⑴操作Z的名称是 。
⑵通过以上数据,得出13.12g黑色粉末X中各成分的物质的量为 。
⑶若溶液Y的体积仍为200mL,则溶液Y中c(Fe3+)= mol/L。
参考答案
题号
1
2
3
4
5
6
7
8
9
10
11
12
答案
B
D
C
C
D
D
A
C
B
C
C
B
题号
13
14
15
16
17
18
19
20
21
22
23
答案
C
A
C
B
D
A
A
D
B
C
B
24.(15分)
⑴(5分)①维生素 维生素A 维生素C
②抗生 酸性或能发生酯化反应或与酸反应等
⑵(5分)①低 ② 2Cu + O2 + CO2 + H2O =Cu2(OH)2CO3 ③D
⑶(5分)①减少化石燃料的使用、植树造林;少用空调和暖气、少开车、少坐飞机;利用太阳能、风能等
②明矾 Al(OH)3胶体 (或氯化铁 Fe(OH)3胶体)
③硫酸根离子 H+ +OH- = H2O
25.(6分)⑴ Cl2 Fe(OH)2 ⑵ Fe+2 Fe3+=3 Fe2+ ⑶ 4Fe(OH)2+O2+2H2O=4Fe(OH)3
26.(10分)
I.⑴Fe+Cu2+=Fe2++Cu ⑵Fe和Fe3O4
II.⑴过滤 ⑵Fe 0.11mol Fe3O4 0.03mol ⑶1
同课章节目录
