四川省威远自强中学09-10学年高一上学期期末考试(化学)
文档属性
| 名称 | 四川省威远自强中学09-10学年高一上学期期末考试(化学) |

|
|
| 格式 | rar | ||
| 文件大小 | 77.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2010-03-01 00:00:00 | ||
图片预览



文档简介
威远自强中学高2012届高一上期期末考试
化学试卷 2010-1-27
班级 学号 姓名
说明:1、本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,全卷共120分,考试时间为120分钟。
2、答题前,考生务必将本人的班级、姓名、学号填在第Ⅱ卷的密封线内相应的位置。
3、请将第Ⅰ卷上每小题所选答案前的字母标号填写在第Ⅱ卷卷首相应的答题栏内。在第Ⅰ卷上答题无效。
4、主要考试范围: 第一册第1~4章、第5章(一、二节)
可能用到的相对原子质量:H—1 C—12 O—16 N—14 Na—23 Al—27
S—32 Cl—35.5 Cu—64 Fe—56
第Ⅰ卷(选择题 共51分)
一、选择题(本题包括17小题,每小题3分,共51分,每小题只有一个正确答案)
1.放射性同位素可用于治疗肿瘤。该同位素原子核内的中子数是 ( ) A.19 B.72 C.53 D.125
2.下列物质中属于强电解质的是 ( )
A.SO2 B.Na2SO4 C.Cl2 D.CH3COOH
3.下列叙述中不正确的是 ( )
A.钠离子与钠原子有相同的质子数
B.钠原子易失一个电子,单质表现强氧化性
C.化学反应中的能量变化通常表现为热量的变化
D.氧化还原反应的实质是电子的转移
4.向溴化钠、碘化钾的混合溶液中通入过量氯气充分反应,将溶液蒸上,并灼烧所得物质,最后残留的固体物质是( )21世纪教育网 ☆
A.NaCl、KCl和I2 B.NaCl和KI
C.NaBr和KCl D.NaCl和KCl
5.下列反应属于氧化还原反应,且水既不是氧化剂又不是还原剂的是 ( )
A.2Na+2H2O=2NaOH+H2↑ B.2F2+2H2O=4HF+O2↑☆考♂资♀源?网 ☆
C.CaO+H2O=Ca(OH)2 D.Cl2+H2O=HCl+HClO
6.下列溶液中,Na+物质的量浓度最大的是 ( )
A.1mL 0.5mol·L-1的NaNO3溶液 B.100mL 0.01mol·L-1的NaCl溶液
C.10mL 0.1mol·L-1的NaOH溶液 D.100mL 0.1mol·L-1的Na2SO4溶液
7.下列有关氯水的叙述,正确的是 ( )☆考♂资♀源?网 ☆
A.新制氯水只含有氯分子和次氯酸分子
B.新制氯水可使紫色石蕊试液先变红后褪色
C.氯水光照时有气泡逸出,该气体的主要成分是氯气
D.氯水放置数天后,其酸性逐渐减弱
8. 向一小烧杯中分别加入等体积的水和煤油,片刻后再向该烧杯中轻轻地加入一绿豆大小的金属钠,可能观察到的现象符合下图中的 ( )☆考♂资♀源?网 ☆
9.下列叙述正确的是 ( )
A. H2SO4的摩尔质量是98
B.钠钾合金常用作核反应堆的导热剂☆考♂资♀源?网 ☆
C. 1mol物质的质量等于该物质的相对分子质量
D.含碘食盐中加入的是碘化钾
10.下列保存物质或试剂的方法不正确的是 ( )
A.实验室保存溴时,常在保存液溴的试剂瓶中加入少量水来防止溴挥发
B.常将钠保存在煤油中☆考♂资♀源?网 ☆
C.新制氯水应密封保存在棕色试剂瓶中
D.取碘水于试管中,加入CCl4,振荡后静置,溶液分层,上层呈紫红色
11.某澄清溶液,可能含有Ca2+、Na+、Cl-、CO32-、I-中的一种或几种,现做如下实验:
①通入足量氯气,溶液变为棕黄色,滴加淀粉溶液后溶液显蓝色。☆考♂资♀源?网 ☆
②加入BaCl2有白色沉淀生成,再加入足量盐酸后,沉淀完全溶解,并有气体生成。
下列关于该澄清溶液的说法中错误的是 ( )
A.一定含有I- B.一定含有CO32-
C.可能含有Cl- D.一定含有Ca2+
12.下列各组离子在酸性溶液中能大量共存的是 ( )
A.Na+ Cu2+ Cl- NO B.K+ Cu2+ SO HCO☆考♂资♀源?网 ☆
C.Ag+ Na+ NO Cl- D.Mg2+ Fe2+ Cl- OH-
13.相同物质的量的两种气体的体积如果不相同,其主要原因是 ( )
A.气体的分子大小不同 B.气体分子间的平均距离不同
C.气体的性质不同 D.气体分子中原子个数不同
14.下列递变规律正确的是 ( )
A. 卤族元素的单质熔沸点均随核电荷数的增大而降低 ☆考♂资♀源?网 ☆
B.稳定性:HF< HCl <HBr< HI
C. 还原性:F- <Cl- <Br- <I-
D. 碱金属都有焰色反应,且都呈黄色
15.下列说法正确的是 ( )
①22.4L氧气中一定含有6.02×1023个氧分子☆考♂资♀源?网 ☆
②将80gNaOH溶于1L水中,所得溶液中NaOH的物质的量浓度是2mol/L
③18g水在标准状况下的体积为22.4L
④在常温常压下,20mLNH3和60mL氧气所含分子数之比为1:3
A.①②③④ B.①②④ C.②③ D.④
16.如图所示:若关闭Ⅰ阀,打开Ⅱ阀,让潮湿的氯气经过甲瓶后,通入乙瓶,布条不褪色;若关闭Ⅱ阀打开Ⅰ阀,再通入这种气体,布条褪色。甲瓶中所盛的试剂不可能是 ( )☆考♂资♀源?网 ☆
A.浓H2SO4 B.NaCl溶液 C.Ba(OH)2溶液 D.NaOH溶液
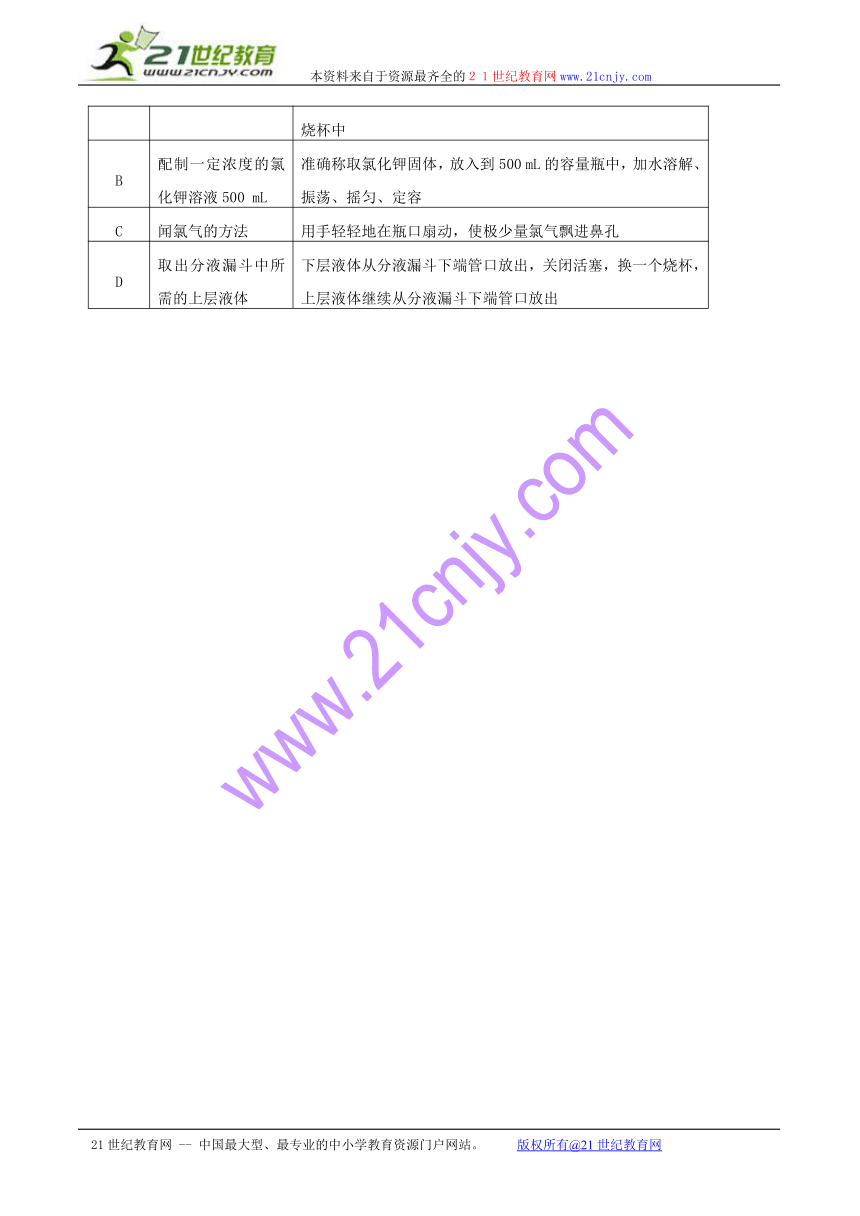
17.下列实验操作完全正确的是 ( )
编号
实 验
操 作
A
钠与水的反应
用镊子从煤油中取出金属钠,切下绿豆大小,放入装满水的烧杯中
B
配制一定浓度的氯化钾溶液500 mL
准确称取氯化钾固体,放入到500 mL的容量瓶中,加水溶解、振荡、摇匀、定容☆考♂资♀源?网 ☆
C
闻氯气的方法
用手轻轻地在瓶口扇动,使极少量氯气飘进鼻孔
D
取出分液漏斗中所需的上层液体
下层液体从分液漏斗下端管口放出,关闭活塞,换一个烧杯,上层液体继续从分液漏斗下端管口放出
威远自强中学高2012届高一上期期末考试
化学试卷 2010-1-27
题号
1
2
3
4
5
6
7
8
9
答案
题号
10
11
12
13
14
15
16
17
答案
第Ⅱ卷(非选择题 共69分)
二、(本题包括2小题,共26分)
18.(12分)碱金属和卤族是高中化学中典型的金属元素和非金属元素。☆考♂资♀源?网 ☆
(1)碱金属元素和卤族元素在自然界里都以 (填“化合态”或“游离态”)存在。碱金属元素包括 (填元索符号,Fr除外,下同)、Na、K、Rb、Cs,它们中金属性最强的是 ,其单质的熔点、沸点逐渐 (填“升高”、“降低”或“不变”)。
(2)氯气可溶解于水,部分能够与水起反应,回答下列问题: ①写出氯气与水反应的离子方程式为: ;
②氯水经光照后,黄绿色消失,并放出无色气体,该反应的化学方程式是:
。
③新制的氯水有多重性,在加有淀粉的碘化钾溶液中滴加新制的氯水,溶液变蓝色该反应的化学方程式是: 。
(3)碘受热直接变成紫色的蒸气,这种现象称为 。
19.(14分)
(1)0.5 mol 氯气的质量为 ,其中含有 个氯原子,在标准状况下,体积为 L。
(2)质量都是50 g的 HCl、NH3、CO2、O2四种气体中,含有分子数目最少的是 _ ,
在相同温度和相同压强条件下,体积最大的是 。
(3)在 mL 0.2 mol/L NaOH溶液中含1 g溶质;配制50 mL 0.2 mol/L CuSO4溶液,需要CuSO4·5H2O ____ g。
三、(本题包括2小题,共19分)
20.(5分) 今欲用NaOH固体配制490mL 0.2mol/L的NaOH溶液。根据题意填空:
A.配制该溶液应选用 ??????? ?mL容量瓶。
B.用托盘天平称取 ????? ?g固体NaOH。
C.将称好的NaOH固体放至500mL的大烧杯中,倒入约250mL蒸馏水,用玻璃棒搅拌至完全溶解。待冷却至室温后,将烧杯中的溶液用玻璃棒引流转移至容量瓶。
D.用少量蒸馏水洗涤烧杯2-3次,并将每次洗涤的溶液都注入容量瓶, 轻轻晃动容量瓶,使溶液混和均匀。
E.向容量瓶中加入蒸馏水,直到液面离刻度线约1-2厘米时,改用??? ?滴加蒸馏水至液面与刻度线相切。盖好瓶塞,摇匀。如果加水时液面超过刻度线,将使配得的溶液浓度 (填“偏高”、“偏低”或 “无影响”)。☆考♂资♀源?网 ☆
F.配制好的溶液????????? (填“能”或“不能”)长期存放在容量瓶中。
21.(14分)实验室用如图所示的仪器药品制取氯化铁粉末,已知氯化铁粉末很容易吸水生成结晶水化合物FeCl3+6H2O=FeCl3·6H2O, ☆考♂资♀源?网 ☆
(1)填写仪器名称:图中Ⅰ是
(2)按照气体流向从左到右顺序连接仪器应是(填仪器接口顺序)
①接 , 接 , 接
(3)B中反应的化学方程式是 。
(4)容器E的作用是 。
(5)A、B中的酒精灯应先点燃 处(填“A”或“B”)的酒精灯。
(6)这套实验装置还不完整,还须补充 装置。
(7)工业上用氯气生产漂白粉的化学方程式为:☆考♂资♀源?网 ☆
。
四、(本题包括1小题,共8分)
22、(8分)现有A、B、C、D、E、F、G、H、M九种物质,其中A、B、C均为氧化物,且A为淡黄色粉末,常温下B为无色液体。组成E单质的原子的最外层的电子数是次外层的电子数的3倍,G为黄绿色气体单质,F的水溶液与石灰水混合可制得D的溶液。它们之间相互转化的关系如下图,其他与题无关的生成物均已略去。请回答下列问题:☆考♂资♀源?网 ☆
(1)写出化学式:C ,M 。☆考♂资♀源?网 ☆
(2)A+B反应的化学方程式 。
(3)写出D+G→H的离子方程式 。
五、(本题包括2小题,共16分)
23.(10分)实验室常用的浓盐酸密度为1.2g·mL-1、质量分数为36.5%。实验室里用
二氧化锰与浓盐酸反应来制取适量的氯气。
(1)此浓盐酸的物质的量浓度为 。☆考♂资♀源?网 ☆
(2)写出实验室制氯气的反应方程式,并用双线桥法表示电子转移的方向和数目。
(3)若用足量该浓盐酸与二氧化锰反应,生成的氯气在标准状况时的体积为5.6升,
被氧化的HCl的质量为 克。☆考♂资♀源?网 ☆
(4)若实验中该浓盐酸10ml与足量的MnO2反应,则生成Cl2的物质的量是 。
A.大于O.03mol B.小于O.03mol C.等于0.93mol
24.(4分)已知:①某双原子分子构成的气体,其摩尔质量为Mg·mol-1。
②V L Al2 (SO4)3溶液中含a g Al3+,从中取出L,并稀释至V L。
请完成下列计算(本题均不写计算过程):☆考♂资♀源?网 ☆
(1)该气体在标准状况下的密度为 g·L-1。
(2)该气体一个分子的质量为 g(用含有NA的代数式来表示)
(3)则稀释后溶液中SO42—的物质的量浓度为 mol/L(用含有a、V
的代数式来表示)
威远自强中学高2012届高一上期期末考试
化学参考答案 2010-1-27
题号
1
2
3
4
5
6
7
8
9
答案
B
B
B
D
D
A
B
A
B
题号
10
11
12
13
14
15
16
17
答案
D
D
A
B
C
D
B
C
18、(12分)☆考♂资♀源?网 ☆
(1)化合态 Li Cs 降低 (1分×4)
(2)①Cl2+H2O=H++Cl-+ HClO ②2HClO 2HCl+02 ↑ ③Cl2+2KI=2KCl+I2
(3)升华 (2分×4)
19、(14分,每空2分)☆考♂资♀源?网 ☆
(1)35.5g 6.02×1023 11.2L (2)CO2 NH3 (3) 125 2.5
20、(5分, 每空1分)
A.500 B.4.0 E.胶头滴管,偏低 F.不能
21.(14分,每空2分)
(1)分液漏斗(1分) (2)⑦⑥④⑤②
(3) 3Cl2+2Fe==2FeCl3 (4)除去氯气中的氯化氢气体
(5)A (6)装有氢氧化钠溶液的烧杯或尾气吸收
(7)2Cl2+2Ca(OH)2 CaCl2+Ca(ClO)2+2H2O☆考♂资♀源?网 ☆
22.(8分,每空2分)
(1)CO2 HClO (2)2Na2O2+2H2O=== 4NaOH+O2↑
(3)C12+20H- === Cl-+ClO-+H2O
23.( 4分,每空2分)
(1)12mol/L
(2)MnO2 + 4HCl(浓) MnCl2 + 2H2O + Cl2↑ ( 方程式、双线桥各2分)
(3)18.25 (4)B
24.(6分,每空2分)
(1)M/22.4 (2) M / NA (3)
21世纪教育网
w.w.^w.k.s.5*u.c.#o@m
21世纪教育网 ☆
化学试卷 2010-1-27
班级 学号 姓名
说明:1、本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,全卷共120分,考试时间为120分钟。
2、答题前,考生务必将本人的班级、姓名、学号填在第Ⅱ卷的密封线内相应的位置。
3、请将第Ⅰ卷上每小题所选答案前的字母标号填写在第Ⅱ卷卷首相应的答题栏内。在第Ⅰ卷上答题无效。
4、主要考试范围: 第一册第1~4章、第5章(一、二节)
可能用到的相对原子质量:H—1 C—12 O—16 N—14 Na—23 Al—27
S—32 Cl—35.5 Cu—64 Fe—56
第Ⅰ卷(选择题 共51分)
一、选择题(本题包括17小题,每小题3分,共51分,每小题只有一个正确答案)
1.放射性同位素可用于治疗肿瘤。该同位素原子核内的中子数是 ( ) A.19 B.72 C.53 D.125
2.下列物质中属于强电解质的是 ( )
A.SO2 B.Na2SO4 C.Cl2 D.CH3COOH
3.下列叙述中不正确的是 ( )
A.钠离子与钠原子有相同的质子数
B.钠原子易失一个电子,单质表现强氧化性
C.化学反应中的能量变化通常表现为热量的变化
D.氧化还原反应的实质是电子的转移
4.向溴化钠、碘化钾的混合溶液中通入过量氯气充分反应,将溶液蒸上,并灼烧所得物质,最后残留的固体物质是( )21世纪教育网 ☆
A.NaCl、KCl和I2 B.NaCl和KI
C.NaBr和KCl D.NaCl和KCl
5.下列反应属于氧化还原反应,且水既不是氧化剂又不是还原剂的是 ( )
A.2Na+2H2O=2NaOH+H2↑ B.2F2+2H2O=4HF+O2↑☆考♂资♀源?网 ☆
C.CaO+H2O=Ca(OH)2 D.Cl2+H2O=HCl+HClO
6.下列溶液中,Na+物质的量浓度最大的是 ( )
A.1mL 0.5mol·L-1的NaNO3溶液 B.100mL 0.01mol·L-1的NaCl溶液
C.10mL 0.1mol·L-1的NaOH溶液 D.100mL 0.1mol·L-1的Na2SO4溶液
7.下列有关氯水的叙述,正确的是 ( )☆考♂资♀源?网 ☆
A.新制氯水只含有氯分子和次氯酸分子
B.新制氯水可使紫色石蕊试液先变红后褪色
C.氯水光照时有气泡逸出,该气体的主要成分是氯气
D.氯水放置数天后,其酸性逐渐减弱
8. 向一小烧杯中分别加入等体积的水和煤油,片刻后再向该烧杯中轻轻地加入一绿豆大小的金属钠,可能观察到的现象符合下图中的 ( )☆考♂资♀源?网 ☆
9.下列叙述正确的是 ( )
A. H2SO4的摩尔质量是98
B.钠钾合金常用作核反应堆的导热剂☆考♂资♀源?网 ☆
C. 1mol物质的质量等于该物质的相对分子质量
D.含碘食盐中加入的是碘化钾
10.下列保存物质或试剂的方法不正确的是 ( )
A.实验室保存溴时,常在保存液溴的试剂瓶中加入少量水来防止溴挥发
B.常将钠保存在煤油中☆考♂资♀源?网 ☆
C.新制氯水应密封保存在棕色试剂瓶中
D.取碘水于试管中,加入CCl4,振荡后静置,溶液分层,上层呈紫红色
11.某澄清溶液,可能含有Ca2+、Na+、Cl-、CO32-、I-中的一种或几种,现做如下实验:
①通入足量氯气,溶液变为棕黄色,滴加淀粉溶液后溶液显蓝色。☆考♂资♀源?网 ☆
②加入BaCl2有白色沉淀生成,再加入足量盐酸后,沉淀完全溶解,并有气体生成。
下列关于该澄清溶液的说法中错误的是 ( )
A.一定含有I- B.一定含有CO32-
C.可能含有Cl- D.一定含有Ca2+
12.下列各组离子在酸性溶液中能大量共存的是 ( )
A.Na+ Cu2+ Cl- NO B.K+ Cu2+ SO HCO☆考♂资♀源?网 ☆
C.Ag+ Na+ NO Cl- D.Mg2+ Fe2+ Cl- OH-
13.相同物质的量的两种气体的体积如果不相同,其主要原因是 ( )
A.气体的分子大小不同 B.气体分子间的平均距离不同
C.气体的性质不同 D.气体分子中原子个数不同
14.下列递变规律正确的是 ( )
A. 卤族元素的单质熔沸点均随核电荷数的增大而降低 ☆考♂资♀源?网 ☆
B.稳定性:HF< HCl <HBr< HI
C. 还原性:F- <Cl- <Br- <I-
D. 碱金属都有焰色反应,且都呈黄色
15.下列说法正确的是 ( )
①22.4L氧气中一定含有6.02×1023个氧分子☆考♂资♀源?网 ☆
②将80gNaOH溶于1L水中,所得溶液中NaOH的物质的量浓度是2mol/L
③18g水在标准状况下的体积为22.4L
④在常温常压下,20mLNH3和60mL氧气所含分子数之比为1:3
A.①②③④ B.①②④ C.②③ D.④
16.如图所示:若关闭Ⅰ阀,打开Ⅱ阀,让潮湿的氯气经过甲瓶后,通入乙瓶,布条不褪色;若关闭Ⅱ阀打开Ⅰ阀,再通入这种气体,布条褪色。甲瓶中所盛的试剂不可能是 ( )☆考♂资♀源?网 ☆
A.浓H2SO4 B.NaCl溶液 C.Ba(OH)2溶液 D.NaOH溶液
17.下列实验操作完全正确的是 ( )
编号
实 验
操 作
A
钠与水的反应
用镊子从煤油中取出金属钠,切下绿豆大小,放入装满水的烧杯中
B
配制一定浓度的氯化钾溶液500 mL
准确称取氯化钾固体,放入到500 mL的容量瓶中,加水溶解、振荡、摇匀、定容☆考♂资♀源?网 ☆
C
闻氯气的方法
用手轻轻地在瓶口扇动,使极少量氯气飘进鼻孔
D
取出分液漏斗中所需的上层液体
下层液体从分液漏斗下端管口放出,关闭活塞,换一个烧杯,上层液体继续从分液漏斗下端管口放出
威远自强中学高2012届高一上期期末考试
化学试卷 2010-1-27
题号
1
2
3
4
5
6
7
8
9
答案
题号
10
11
12
13
14
15
16
17
答案
第Ⅱ卷(非选择题 共69分)
二、(本题包括2小题,共26分)
18.(12分)碱金属和卤族是高中化学中典型的金属元素和非金属元素。☆考♂资♀源?网 ☆
(1)碱金属元素和卤族元素在自然界里都以 (填“化合态”或“游离态”)存在。碱金属元素包括 (填元索符号,Fr除外,下同)、Na、K、Rb、Cs,它们中金属性最强的是 ,其单质的熔点、沸点逐渐 (填“升高”、“降低”或“不变”)。
(2)氯气可溶解于水,部分能够与水起反应,回答下列问题: ①写出氯气与水反应的离子方程式为: ;
②氯水经光照后,黄绿色消失,并放出无色气体,该反应的化学方程式是:
。
③新制的氯水有多重性,在加有淀粉的碘化钾溶液中滴加新制的氯水,溶液变蓝色该反应的化学方程式是: 。
(3)碘受热直接变成紫色的蒸气,这种现象称为 。
19.(14分)
(1)0.5 mol 氯气的质量为 ,其中含有 个氯原子,在标准状况下,体积为 L。
(2)质量都是50 g的 HCl、NH3、CO2、O2四种气体中,含有分子数目最少的是 _ ,
在相同温度和相同压强条件下,体积最大的是 。
(3)在 mL 0.2 mol/L NaOH溶液中含1 g溶质;配制50 mL 0.2 mol/L CuSO4溶液,需要CuSO4·5H2O ____ g。
三、(本题包括2小题,共19分)
20.(5分) 今欲用NaOH固体配制490mL 0.2mol/L的NaOH溶液。根据题意填空:
A.配制该溶液应选用 ??????? ?mL容量瓶。
B.用托盘天平称取 ????? ?g固体NaOH。
C.将称好的NaOH固体放至500mL的大烧杯中,倒入约250mL蒸馏水,用玻璃棒搅拌至完全溶解。待冷却至室温后,将烧杯中的溶液用玻璃棒引流转移至容量瓶。
D.用少量蒸馏水洗涤烧杯2-3次,并将每次洗涤的溶液都注入容量瓶, 轻轻晃动容量瓶,使溶液混和均匀。
E.向容量瓶中加入蒸馏水,直到液面离刻度线约1-2厘米时,改用??? ?滴加蒸馏水至液面与刻度线相切。盖好瓶塞,摇匀。如果加水时液面超过刻度线,将使配得的溶液浓度 (填“偏高”、“偏低”或 “无影响”)。☆考♂资♀源?网 ☆
F.配制好的溶液????????? (填“能”或“不能”)长期存放在容量瓶中。
21.(14分)实验室用如图所示的仪器药品制取氯化铁粉末,已知氯化铁粉末很容易吸水生成结晶水化合物FeCl3+6H2O=FeCl3·6H2O, ☆考♂资♀源?网 ☆
(1)填写仪器名称:图中Ⅰ是
(2)按照气体流向从左到右顺序连接仪器应是(填仪器接口顺序)
①接 , 接 , 接
(3)B中反应的化学方程式是 。
(4)容器E的作用是 。
(5)A、B中的酒精灯应先点燃 处(填“A”或“B”)的酒精灯。
(6)这套实验装置还不完整,还须补充 装置。
(7)工业上用氯气生产漂白粉的化学方程式为:☆考♂资♀源?网 ☆
。
四、(本题包括1小题,共8分)
22、(8分)现有A、B、C、D、E、F、G、H、M九种物质,其中A、B、C均为氧化物,且A为淡黄色粉末,常温下B为无色液体。组成E单质的原子的最外层的电子数是次外层的电子数的3倍,G为黄绿色气体单质,F的水溶液与石灰水混合可制得D的溶液。它们之间相互转化的关系如下图,其他与题无关的生成物均已略去。请回答下列问题:☆考♂资♀源?网 ☆
(1)写出化学式:C ,M 。☆考♂资♀源?网 ☆
(2)A+B反应的化学方程式 。
(3)写出D+G→H的离子方程式 。
五、(本题包括2小题,共16分)
23.(10分)实验室常用的浓盐酸密度为1.2g·mL-1、质量分数为36.5%。实验室里用
二氧化锰与浓盐酸反应来制取适量的氯气。
(1)此浓盐酸的物质的量浓度为 。☆考♂资♀源?网 ☆
(2)写出实验室制氯气的反应方程式,并用双线桥法表示电子转移的方向和数目。
(3)若用足量该浓盐酸与二氧化锰反应,生成的氯气在标准状况时的体积为5.6升,
被氧化的HCl的质量为 克。☆考♂资♀源?网 ☆
(4)若实验中该浓盐酸10ml与足量的MnO2反应,则生成Cl2的物质的量是 。
A.大于O.03mol B.小于O.03mol C.等于0.93mol
24.(4分)已知:①某双原子分子构成的气体,其摩尔质量为Mg·mol-1。
②V L Al2 (SO4)3溶液中含a g Al3+,从中取出L,并稀释至V L。
请完成下列计算(本题均不写计算过程):☆考♂资♀源?网 ☆
(1)该气体在标准状况下的密度为 g·L-1。
(2)该气体一个分子的质量为 g(用含有NA的代数式来表示)
(3)则稀释后溶液中SO42—的物质的量浓度为 mol/L(用含有a、V
的代数式来表示)
威远自强中学高2012届高一上期期末考试
化学参考答案 2010-1-27
题号
1
2
3
4
5
6
7
8
9
答案
B
B
B
D
D
A
B
A
B
题号
10
11
12
13
14
15
16
17
答案
D
D
A
B
C
D
B
C
18、(12分)☆考♂资♀源?网 ☆
(1)化合态 Li Cs 降低 (1分×4)
(2)①Cl2+H2O=H++Cl-+ HClO ②2HClO 2HCl+02 ↑ ③Cl2+2KI=2KCl+I2
(3)升华 (2分×4)
19、(14分,每空2分)☆考♂资♀源?网 ☆
(1)35.5g 6.02×1023 11.2L (2)CO2 NH3 (3) 125 2.5
20、(5分, 每空1分)
A.500 B.4.0 E.胶头滴管,偏低 F.不能
21.(14分,每空2分)
(1)分液漏斗(1分) (2)⑦⑥④⑤②
(3) 3Cl2+2Fe==2FeCl3 (4)除去氯气中的氯化氢气体
(5)A (6)装有氢氧化钠溶液的烧杯或尾气吸收
(7)2Cl2+2Ca(OH)2 CaCl2+Ca(ClO)2+2H2O☆考♂资♀源?网 ☆
22.(8分,每空2分)
(1)CO2 HClO (2)2Na2O2+2H2O=== 4NaOH+O2↑
(3)C12+20H- === Cl-+ClO-+H2O
23.( 4分,每空2分)
(1)12mol/L
(2)MnO2 + 4HCl(浓) MnCl2 + 2H2O + Cl2↑ ( 方程式、双线桥各2分)
(3)18.25 (4)B
24.(6分,每空2分)
(1)M/22.4 (2) M / NA (3)
21世纪教育网
w.w.^w.k.s.5*u.c.#o@m
21世纪教育网 ☆
同课章节目录
