离子键的形成课件
图片预览






文档简介
课件17张PPT。第二单元 离子键 离子晶体南靖一中 沈建忠教学目标
1、理解离子键及其离子键的形成过程。
2、能用电子式表示离子化合物的形成过程。
3、掌握影响离子键强弱的因素。
4、理解离子晶体的概念、构成及物理性质。
5、掌握常见的离子晶体的类型。 一
、
离
子
键
的
形
成教学要点和难点
1、离子键及其离子键的形成。
2、用电子式表示离子化合物的形成。
3、影响离子键强弱的因素。
教学过程根据元素的金属性和非金属性差异,你知道那些原子之间能形成离子键?
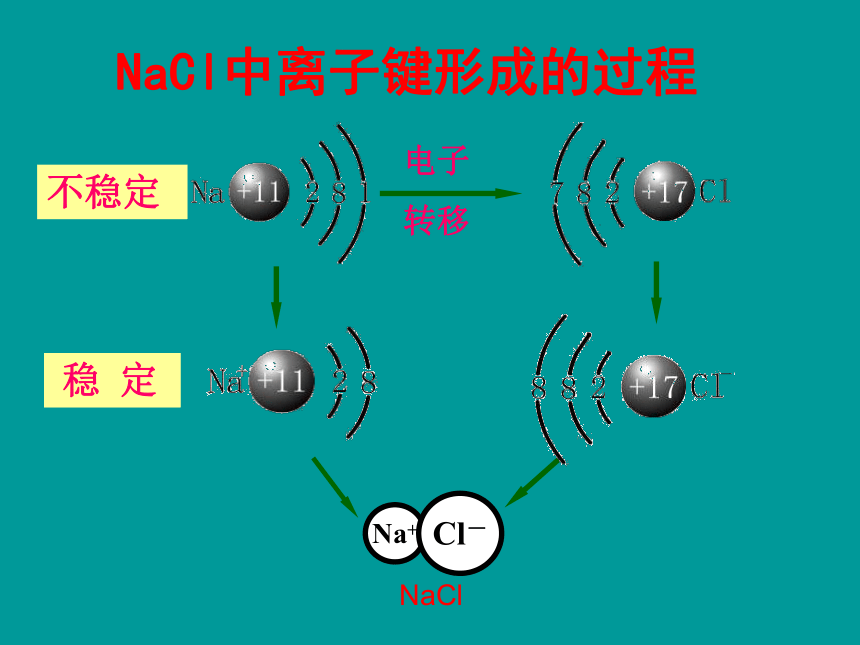
钠原子与氯原子是如何结合形成氯化钠的?你能用电子式表示氯化钠的形成过程吗?NaCl中离子键形成的过程电子
转移不稳定 NaCl1.形成离子键的主要原因 活泼的金属元素和活泼的非金属元素的原子容易发生电子得失,形成相对稳定结构的阴、阳离子,从而产生离子键。2.定义:
阴、阳离子通过静电作用形成的化学键称为
离子键(1)成键粒子:阴、阳离子(3)成键元素(一般情况):(2)成键本质:静电作用(吸引与排斥)活泼金属元素(IA、IIA等)与活泼非金属元素(VIA、VIIA等)形成化合物的元素的电负性的差>1.73、离子化合物 离子化合物包括:(1)活泼的金属元素如(IA、IIA)和活泼的非
金属元素如(VIA、VIIA)形成的化合物。
(2)活泼的金属元素和酸根离子(或氢氧根离
子)形成的盐(或碱)
(3)铵根和酸根离子(或活泼非金属元素离子)
形成的盐。 定义:由离子键构成的化合物。如:
KCl、MgCl2、CaCl2、ZnSO4、NaOH。注意:
1、金属元素不一定能形成离子化合物,
如:AlCl3、BeCl2。因金属活泼性弱,难失电子。
2、离子化合物中不一定含金属元素,如NH4NO3。
3、离子键只存在离子化合物中,离子化合物中一定有
离子键,也可能含有共价键,如NaOH、Na2O2、
ZnSO4。
4、离子化合物受热熔化时会破坏离子键,从水溶液中
结晶形成离子化合物时会形成离子键,但都属物理变化。
故破坏化学键或形成化学键不一定发生化学变化,而发
生化学变化过程一定有旧化学键的断裂或新的化学键的
形成。原子:4、用电子式表示离子化合物的形成(1)电子式:在元素符号周围用小点(或×)来表
示原子外层电子,这种式子叫电子式。 Al C C
C N S 离子化合物: 离子:NaOH CaC2
Ca(OH)2 NH3 课堂练习( A )(2)、用电子式表示离子化合物的形成过程例:练习. 1、用电子式表示下列物质:
(1)CaO (2)Na2O (3)CaCl2
(4)H2O2 (5)H2O (6)N2
2.书写下列物质的电子式MgCl2 NaOH NH4Cl3. 用电子式表示下列物质的形成过程。NaCl MgCl2 注意区分: 用电子式表示物质
用电子式表示物质形成过程小结:书写注意事项。教科书 P39 通常情况下,阴、阳离子可以看成是球形对称的,其电荷分布也是球形对称的,只要空间条件允许,则一个离子可以同时吸引多个带相反电荷的离子。因此离子键没有方向性和饱和性。1. 如果把阴、阳离子看成是球形对称的,阴阳离子的电荷
分布是均匀的,则它们在空间的各个方向上的静电作用是否相同?
2. 如果是相同的,在静电作用能达到的范围内,只要空间
范围许可,一个离子是否应当同时尽可能多得吸引带相
反电荷的离子呢?5、 离子键的特征本节小结阴离子Nn-阳离子Mm+用电子式表示离子化合物失去电子得到电子静电作用 静电吸引=静电排斥离 子 键 影 响 因 素 ①离子半径 ②离子电荷
离子键:使阴、阳离子结合成化合物的静电作用.例
作业布置:
1、完成《导与学》P29--34
2、完成课本P42--1、2、3、4
1、理解离子键及其离子键的形成过程。
2、能用电子式表示离子化合物的形成过程。
3、掌握影响离子键强弱的因素。
4、理解离子晶体的概念、构成及物理性质。
5、掌握常见的离子晶体的类型。 一
、
离
子
键
的
形
成教学要点和难点
1、离子键及其离子键的形成。
2、用电子式表示离子化合物的形成。
3、影响离子键强弱的因素。
教学过程根据元素的金属性和非金属性差异,你知道那些原子之间能形成离子键?
钠原子与氯原子是如何结合形成氯化钠的?你能用电子式表示氯化钠的形成过程吗?NaCl中离子键形成的过程电子
转移不稳定 NaCl1.形成离子键的主要原因 活泼的金属元素和活泼的非金属元素的原子容易发生电子得失,形成相对稳定结构的阴、阳离子,从而产生离子键。2.定义:
阴、阳离子通过静电作用形成的化学键称为
离子键(1)成键粒子:阴、阳离子(3)成键元素(一般情况):(2)成键本质:静电作用(吸引与排斥)活泼金属元素(IA、IIA等)与活泼非金属元素(VIA、VIIA等)形成化合物的元素的电负性的差>1.73、离子化合物 离子化合物包括:(1)活泼的金属元素如(IA、IIA)和活泼的非
金属元素如(VIA、VIIA)形成的化合物。
(2)活泼的金属元素和酸根离子(或氢氧根离
子)形成的盐(或碱)
(3)铵根和酸根离子(或活泼非金属元素离子)
形成的盐。 定义:由离子键构成的化合物。如:
KCl、MgCl2、CaCl2、ZnSO4、NaOH。注意:
1、金属元素不一定能形成离子化合物,
如:AlCl3、BeCl2。因金属活泼性弱,难失电子。
2、离子化合物中不一定含金属元素,如NH4NO3。
3、离子键只存在离子化合物中,离子化合物中一定有
离子键,也可能含有共价键,如NaOH、Na2O2、
ZnSO4。
4、离子化合物受热熔化时会破坏离子键,从水溶液中
结晶形成离子化合物时会形成离子键,但都属物理变化。
故破坏化学键或形成化学键不一定发生化学变化,而发
生化学变化过程一定有旧化学键的断裂或新的化学键的
形成。原子:4、用电子式表示离子化合物的形成(1)电子式:在元素符号周围用小点(或×)来表
示原子外层电子,这种式子叫电子式。 Al C C
C N S 离子化合物: 离子:NaOH CaC2
Ca(OH)2 NH3 课堂练习( A )(2)、用电子式表示离子化合物的形成过程例:练习. 1、用电子式表示下列物质:
(1)CaO (2)Na2O (3)CaCl2
(4)H2O2 (5)H2O (6)N2
2.书写下列物质的电子式MgCl2 NaOH NH4Cl3. 用电子式表示下列物质的形成过程。NaCl MgCl2 注意区分: 用电子式表示物质
用电子式表示物质形成过程小结:书写注意事项。教科书 P39 通常情况下,阴、阳离子可以看成是球形对称的,其电荷分布也是球形对称的,只要空间条件允许,则一个离子可以同时吸引多个带相反电荷的离子。因此离子键没有方向性和饱和性。1. 如果把阴、阳离子看成是球形对称的,阴阳离子的电荷
分布是均匀的,则它们在空间的各个方向上的静电作用是否相同?
2. 如果是相同的,在静电作用能达到的范围内,只要空间
范围许可,一个离子是否应当同时尽可能多得吸引带相
反电荷的离子呢?5、 离子键的特征本节小结阴离子Nn-阳离子Mm+用电子式表示离子化合物失去电子得到电子静电作用 静电吸引=静电排斥离 子 键 影 响 因 素 ①离子半径 ②离子电荷
离子键:使阴、阳离子结合成化合物的静电作用.例
作业布置:
1、完成《导与学》P29--34
2、完成课本P42--1、2、3、4
