离子晶体课件
图片预览







文档简介
课件30张PPT。二、离子晶体南靖一中 沈建忠(第二课时)干冰水晶明矾雪花氯化钠金刚石常见晶体 重晶石 BaSO4 莹石 CaF2 胆矾 CuSO4·5H2O 明矾 KAl(SO4)2·12H2O
1.NaCl晶体是典型的离子化合物,其中存在哪些微粒?试写出NaCl的电子式. 2.上述离子是通过怎样的相互作用结合成晶体的呢?你知道吗?3.离子晶体中结构类型有哪些?(一)、离子晶体结构类型
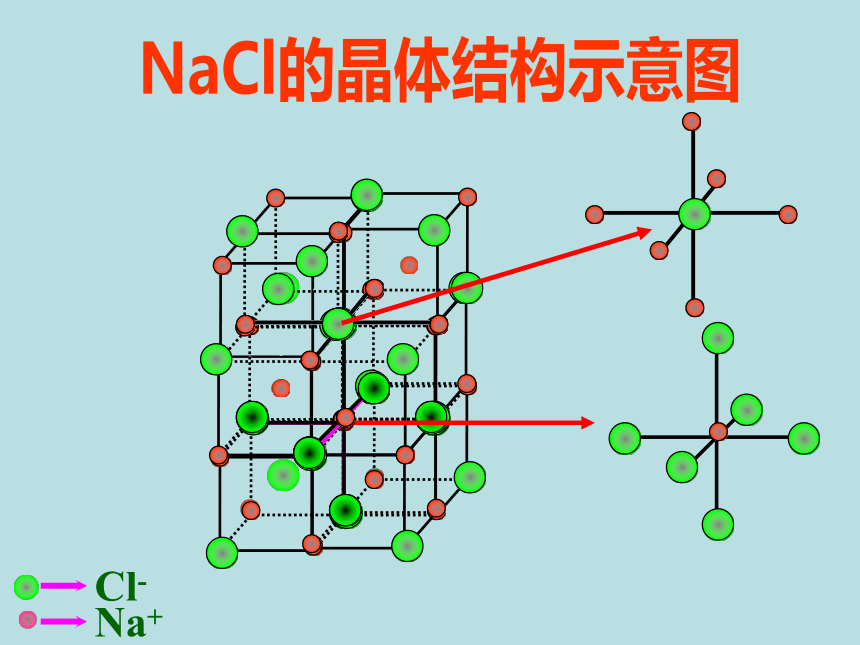
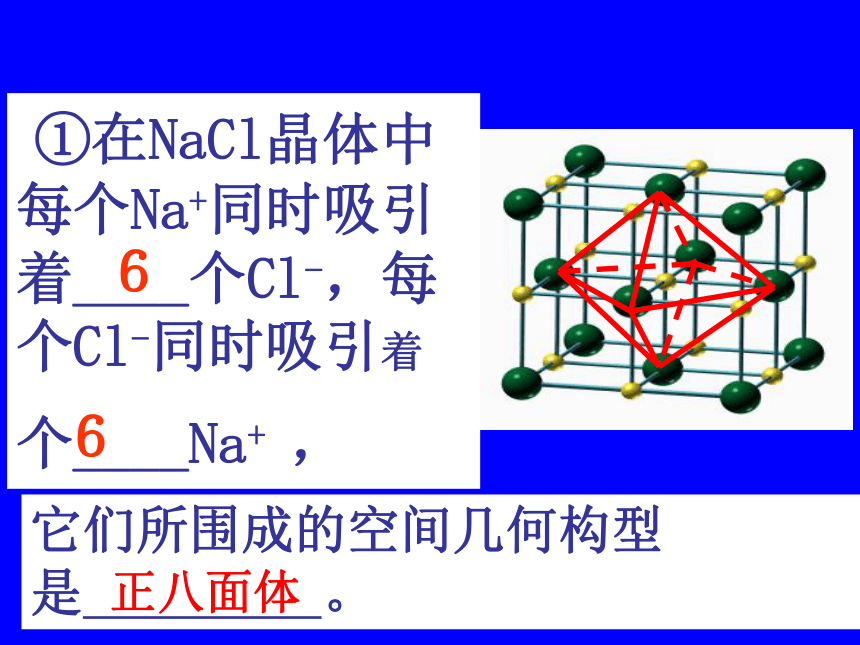
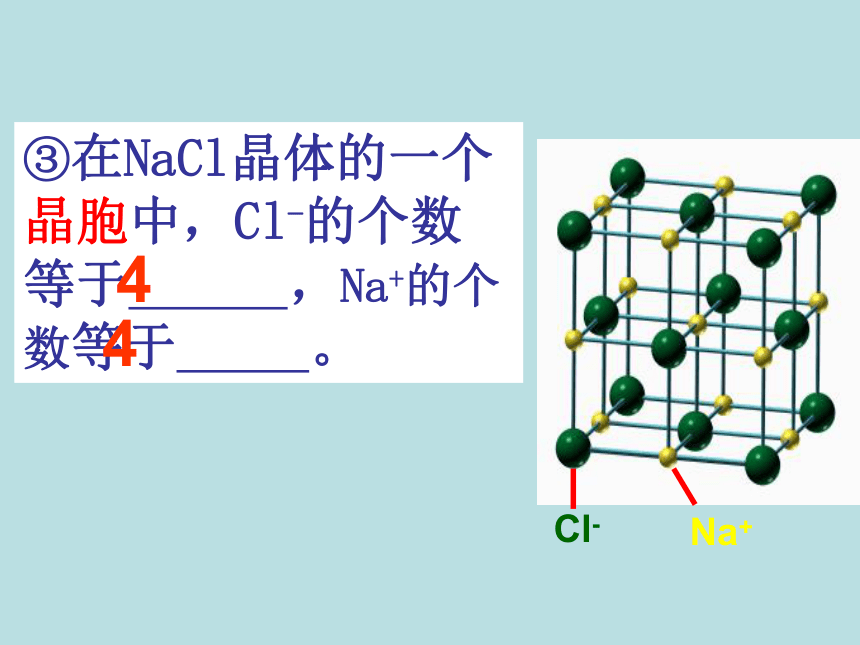
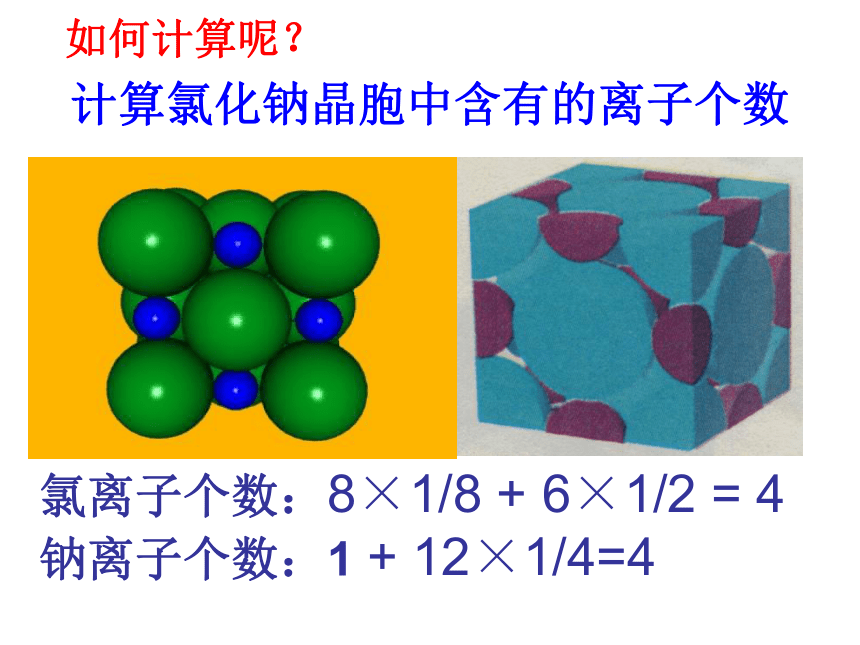
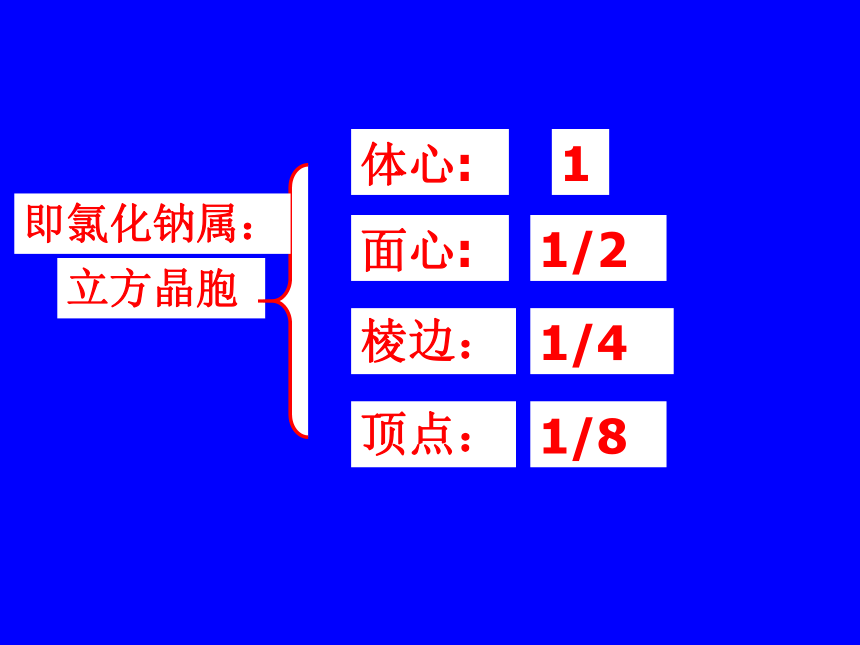
1、NaCl型(KCl、NaBr、LiF、CaO)NaCl的晶体结构示意图 ①在NaCl晶体中每个Na+同时吸引着____个Cl-,每个Cl-同时吸引着个____Na+ ,6它们所围成的空间几何构型是 。正八面体6②与一个Na+相邻最近且距离相等的Na+有 个?12(三个垂直面)③在NaCl晶体的一个晶胞中,Cl-的个数等于 ,Na+的个数等于 。44计算氯化钠晶胞中含有的离子个数氯离子个数:8×1/8 + 6×1/2 = 4 钠离子个数:1 + 12×1/4=4 如何计算呢?立方晶胞体心:1面心:1/2棱边:1/4顶点:1/8即氯化钠属:在NaCl晶体中是否存在单个的NaCl分子?不存在——拥有4个氯离子,4个钠离子。Cl—:Na+ = 1 : 1氯化钠晶体的一个晶胞中,所以氯化钠化学式表示为: Na Cl
“Na Cl”只表示组成,不表示单独的分子2、CsCl型(CsBr、CsI、NH4Cl)CsCl的晶体结构示意图正方体型结构 在CsCl晶体中,每个Cs+同时吸引( )个Cl-,每个Cl- 同时吸引( )个Cs+。 在CsCl晶体中,每个Cs+周围与它最接近且距离相等的Cs+共有( )个。886该晶胞中Cl-数为1,Cs+数为1. 为什么NaCl的熔沸点比CsCl高?交流与讨论结论:
对于组成和结构相似的物质,
阴、阳离子半径越小,离子键越强,熔沸点较高,晶体越稳定。 离子键的强弱在一定程度上可以用离子晶体的晶格能来衡量。(二)、离子晶体的晶格能1、晶格能(与金属的原子化热比较)
指拆开1mol离子晶体使之形成气态阴离子和气态阳离子所吸收的能量。
2、晶格能越大,表明离子晶体中的离子键越稳定。
一般而言,晶格能越高,离子晶体的熔点越高、硬度越大。
3、晶格能大小还影响着离子晶体在水中的溶解度、溶解热等性质。
4、影响晶格能大小因素
离子晶体中阴阳离子间距离越小,
所带电荷越多,离子键越强,晶格
能越大。(三)离子的配位数 1、离子晶体中离子的配位数是指一个离子周围最邻近的带相反电荷的离
子数目2、NaCl CsCl晶体中 阴、阳离子配位数NaCl 型离子配位数为6CsCl型离子配位数为8离子晶体中的离子配位数 阴、阳离子半径比与配位数的关系拓展视野立方体八面体四面体 8 :86 :64 :4简单
立方面心
立方 小结(四)、离子晶体的特点:
●无单个分子存在。如NaCl 和CsCl不是表示分子式。
●一般易溶于水,难溶于非极性溶剂。
●熔沸点较高,硬度较大,难挥发难压缩。
●固态时不导电,水溶液或者熔融状态下均导电。
●离子晶体硬而脆,无延展性。
本节小结:
1、 NaCl 、CsCl的晶胞结构特点。
2、离子晶体的特点
作业布置:
1、完成书本P42—5、6、7
2、完成《导与学》P29-35附:ZnS的晶体结构示意图 根据硫化锌的结构模型确定晶胞,并分析其构成。每个晶胞中有 个Zn2+,
有 个S2-
441.某离子晶体的结构(局部如图),X位于立方体的顶点,Y位于立方体的中心,则该晶体的化学式是X :Y= 1/8×4 : 1= 1 : 2(XY2)?
3 若已知NaCl的摩尔质量为 M g/mol
晶胞的边长为a cm,设阿伏加德常数为
NA,则NaCl晶体的密度为: g/cm3
————。 晶胞法:小立方体法:
1.NaCl晶体是典型的离子化合物,其中存在哪些微粒?试写出NaCl的电子式. 2.上述离子是通过怎样的相互作用结合成晶体的呢?你知道吗?3.离子晶体中结构类型有哪些?(一)、离子晶体结构类型
1、NaCl型(KCl、NaBr、LiF、CaO)NaCl的晶体结构示意图 ①在NaCl晶体中每个Na+同时吸引着____个Cl-,每个Cl-同时吸引着个____Na+ ,6它们所围成的空间几何构型是 。正八面体6②与一个Na+相邻最近且距离相等的Na+有 个?12(三个垂直面)③在NaCl晶体的一个晶胞中,Cl-的个数等于 ,Na+的个数等于 。44计算氯化钠晶胞中含有的离子个数氯离子个数:8×1/8 + 6×1/2 = 4 钠离子个数:1 + 12×1/4=4 如何计算呢?立方晶胞体心:1面心:1/2棱边:1/4顶点:1/8即氯化钠属:在NaCl晶体中是否存在单个的NaCl分子?不存在——拥有4个氯离子,4个钠离子。Cl—:Na+ = 1 : 1氯化钠晶体的一个晶胞中,所以氯化钠化学式表示为: Na Cl
“Na Cl”只表示组成,不表示单独的分子2、CsCl型(CsBr、CsI、NH4Cl)CsCl的晶体结构示意图正方体型结构 在CsCl晶体中,每个Cs+同时吸引( )个Cl-,每个Cl- 同时吸引( )个Cs+。 在CsCl晶体中,每个Cs+周围与它最接近且距离相等的Cs+共有( )个。886该晶胞中Cl-数为1,Cs+数为1. 为什么NaCl的熔沸点比CsCl高?交流与讨论结论:
对于组成和结构相似的物质,
阴、阳离子半径越小,离子键越强,熔沸点较高,晶体越稳定。 离子键的强弱在一定程度上可以用离子晶体的晶格能来衡量。(二)、离子晶体的晶格能1、晶格能(与金属的原子化热比较)
指拆开1mol离子晶体使之形成气态阴离子和气态阳离子所吸收的能量。
2、晶格能越大,表明离子晶体中的离子键越稳定。
一般而言,晶格能越高,离子晶体的熔点越高、硬度越大。
3、晶格能大小还影响着离子晶体在水中的溶解度、溶解热等性质。
4、影响晶格能大小因素
离子晶体中阴阳离子间距离越小,
所带电荷越多,离子键越强,晶格
能越大。(三)离子的配位数 1、离子晶体中离子的配位数是指一个离子周围最邻近的带相反电荷的离
子数目2、NaCl CsCl晶体中 阴、阳离子配位数NaCl 型离子配位数为6CsCl型离子配位数为8离子晶体中的离子配位数 阴、阳离子半径比与配位数的关系拓展视野立方体八面体四面体 8 :86 :64 :4简单
立方面心
立方 小结(四)、离子晶体的特点:
●无单个分子存在。如NaCl 和CsCl不是表示分子式。
●一般易溶于水,难溶于非极性溶剂。
●熔沸点较高,硬度较大,难挥发难压缩。
●固态时不导电,水溶液或者熔融状态下均导电。
●离子晶体硬而脆,无延展性。
本节小结:
1、 NaCl 、CsCl的晶胞结构特点。
2、离子晶体的特点
作业布置:
1、完成书本P42—5、6、7
2、完成《导与学》P29-35附:ZnS的晶体结构示意图 根据硫化锌的结构模型确定晶胞,并分析其构成。每个晶胞中有 个Zn2+,
有 个S2-
441.某离子晶体的结构(局部如图),X位于立方体的顶点,Y位于立方体的中心,则该晶体的化学式是X :Y= 1/8×4 : 1= 1 : 2(XY2)?
3 若已知NaCl的摩尔质量为 M g/mol
晶胞的边长为a cm,设阿伏加德常数为
NA,则NaCl晶体的密度为: g/cm3
————。 晶胞法:小立方体法:
