江苏省09-10学年高二学业水平测试创新题专项练习
文档属性
| 名称 | 江苏省09-10学年高二学业水平测试创新题专项练习 |  | |
| 格式 | zip | ||
| 文件大小 | 764.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2010-03-08 20:34:00 | ||
图片预览

文档简介
江苏省09-10学年高二学业水平测试
创新题专项练习
化学
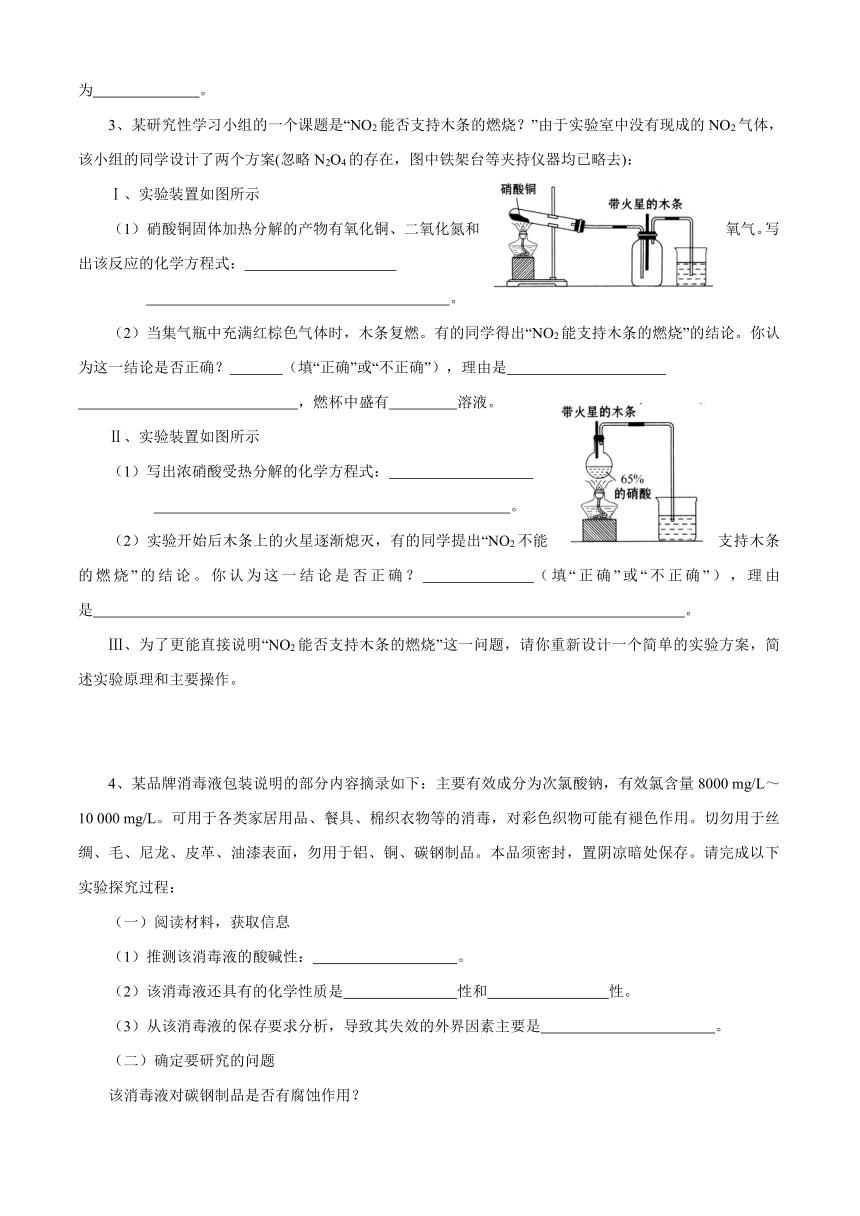
1、某铁的氧化物粉末可能含有FeO、Fe2O3中的一种或两种。某兴趣小组同学利用以下装置测定铁的氧化物的组成,请回答下列问题:(已知)
(1)装置甲的作用是 。
(2)装置丁中的实验现象是
。
(3)若丙中铁的氧化物的化学式为FexOy,则丙中反应的化学方程式为 。若丙中铁的氧化物质量为3.92g,且完全反应,丁中生成沉淀的质量为13.79g,试确定该氧化物中x:y= ,该固体粉末的组成为 。
(4)某同学认为上述沉淀方法较复杂,利用1 mol·L—1的硫酸、KSCN溶液、酸性高锰酸钾溶液,即可检验该铁的氧化物的组成,请设计实验检验:
。
2、某白色粉末可能由Na2CO3、NaHCO3中的一种或两种组成。某化学实验小组在实验室中对其组成进行探究,并提出如下假设:
假设Ⅰ:白色粉末是Na2CO3。
假设Ⅱ:白色粉末是NaHCO3。
假设Ⅲ:白色粉末是Na2CO3、NaHCO3的混合物。
(1)请设计实验验证假设Ⅱ: 。
(2)称取一定量的样品置于坩埚中加热片刻后,冷却称重,发现固体质量减少,则假设
(填“Ⅰ”、“Ⅱ”、“Ⅲ”)一定不成立。
(3)实验证明,该样品是Na2CO3、NaHCO3的混合物,为测定混合物中Na2CO3的质量分数,该小组同学又设计了如图所示装置进行实验。
①实验前后均需向装置中通入H2,实验后通入H2的目的是 。
②装置D的作用是 。
③实验前取17.9g样品,实验后测得装置C增重8.80g,则该样品中Na2CO3的质量分数为 。
3、某研究性学习小组的一个课题是“NO2能否支持木条的燃烧?”由于实验室中没有现成的NO2气体,该小组的同学设计了两个方案(忽略N2O4的存在,图中铁架台等夹持仪器均已略去):
Ⅰ、实验装置如图所示
(1)硝酸铜固体加热分解的产物有氧化铜、二氧化氮和氧气。写出该反应的化学方程式:
。
(2)当集气瓶中充满红棕色气体时,木条复燃。有的同学得出“NO2能支持木条的燃烧”的结论。你认为这一结论是否正确? (填“正确”或“不正确”),理由是
,燃杯中盛有 溶液。
Ⅱ、实验装置如图所示
(1)写出浓硝酸受热分解的化学方程式:
。
(2)实验开始后木条上的火星逐渐熄灭,有的同学提出“NO2不能支持木条的燃烧”的结论。你认为这一结论是否正确? (填“正确”或“不正确”),理由是 。
Ⅲ、为了更能直接说明“NO2能否支持木条的燃烧”这一问题,请你重新设计一个简单的实验方案,简述实验原理和主要操作。
4、某品牌消毒液包装说明的部分内容摘录如下:主要有效成分为次氯酸钠,有效氯含量8000 mg/L~10 000 mg/L。可用于各类家居用品、餐具、棉织衣物等的消毒,对彩色织物可能有褪色作用。切勿用于丝绸、毛、尼龙、皮革、油漆表面,勿用于铝、铜、碳钢制品。本品须密封,置阴凉暗处保存。请完成以下实验探究过程:
(一)阅读材料,获取信息
(1)推测该消毒液的酸碱性: 。
(2)该消毒液还具有的化学性质是 性和 性。
(3)从该消毒液的保存要求分析,导致其失效的外界因素主要是 。
(二)确定要研究的问题
该消毒液对碳钢制品是否有腐蚀作用?
(三)设计方案,实施探究
用烧杯取少量样品,将一颗光亮的铁钉放入烧杯,浸泡一段时间。对可能产生的现象有如下假设:假设①:有明显现象;假设②:无明显现象。
(4)基于假设①,结论是铁钉被腐蚀,预期的实验现象是 。
(5)基于假设②,结论是 ,请设计实验进一步验证该结论,叙述实验操作:
。
5、溴水和氯化铁溶液是中学化学实验中的常用试剂,浓度较小时,溶液均呈黄色。某同学在探究铁的化合物的相互转化时,进行了如下实验。请你参与讨论。
实验操作:向20 mL的FeSO4溶液中,滴加浓溴水,振荡。
实验现象:溶液由浅绿色(近乎无色)变成黄色。
(1)溶液颜色发生改变的原因可能是 (用选项符号表示)。
①使溶液呈黄色的微粒是Br2 ②使溶液呈黄色的微粒是Fe3+
③使溶液呈黄色的微粒是Fe3+和Br2
(2)为进一步探究溴水和FeSO4溶液是否发生了反应,下列是该同学设计的一些实验方案:
操作 实验现象及结论
方案1 取少量黄色溶液,加入NaOH 最终生成红褐色沉淀,说明发生了化学反应
方案2 取少量黄色溶液,加入淀粉碘化钾溶液 溶液变蓝色,说明未发生化学反应
方案3 取少量黄色溶液,加入四氯化碳,振荡 下层溶液呈橙红色,说明未发生化学反应
①方案1的结论是否合理 (填“合理”或“不合理”)。
②方案2的结论明显不合理,可能发生反应的离子方程式为 。
③方案3的结论也不合理,理由是 。
④`你认为判断溴水和FeSO4溶液是否反应的最简单方法是(填“操作”“现象”“结论”):
。
6、随着人们日常生活水平的提高,室内空气污染越来越受到人们的重视。造成室内环境污染
的有毒物质主要有甲醛、苯、氨、氡、一氧化碳等物质。请回答下列问题:
⑴ 苯分子的结构简式为 。
⑵ 我国《室内空气质量标准》规定室内空气中甲醛(HCHO)含量不得超过0.08mg/m3。某校
化学研究性学习小组的同学通过查阅资料,拟采用如下方法测定某新装修居室内空气中甲醛的含量。测定原理:5HCHO+4KMnO4+6H2SO4=2K2SO4+4MnSO4+5CO2↑+11H2O
实验操作:用容积为1000 mL的医用注射器抽取空气,缓慢注入酸性高锰酸钾溶液中(装置
如下),当酸性高锰酸钾溶液正好褪色时,停止注入。
① 用0.1000mol/L的酸性KMnO4溶液配制实验中使用的酸性KMnO4溶液1000mL,需
0.1000mol/L的酸性KMnO4溶液的体积为 。
② 向酸性高锰酸钾溶液中注入空气前,应检查装置气密性,操作方法为
;装置中多孔玻璃球的作用是 。
③ 实验时在居室内不同地点抽取空气,并缓慢注入酸性高锰酸钾溶液中。当第200次将注
射器中空气全部缓慢注入酸性高锰酸钾溶液中时,酸性高锰酸钾溶液正好褪色。请通过计算说明该居室空气中甲醛含量是否超标(空气中其他成分不与酸性高锰酸钾溶液反应)。
④ 请你举出减少室内空气污染的一条合理措施: 。
学业水平测试创新题专项练习
1.(1)除去混合气体中的CO2 (2)有白色沉淀生成
(3)FexOy+yCOxFe + yCO2 5∶7 nFeO∶nFe2O3=1∶2
(4)①将铁的氧化物溶于1mol/L的H2SO4制成溶液,并分成两份;
②在其中一份中加入KSCN溶液,若变为血红色,证明有Fe2O3;
③在另一份中加入少量KMnO4,若褪色,则说明有FeO.
2.(1)将粉末溶于水制成溶液,然后滴加BaCl2溶液,若无白色沉淀,则假设Ⅱ成立;
(2)Ⅰ
(3)①使产生的CO2全部被碱石灰吸收;②防止空气中的CO2、H2O(g)倒流;③29.6%
3、Ⅰ.(1)2Cu(NO3)22CuO+4NO2↑+O2↑
(2)正确 Cu(NO3)2分解产生的O2的体积分数与空气中O2的体积分数相等,但空气不能使带火星的木条复燃,所以NO2能支持燃烧。 NaOH
Ⅱ.(1)4HNO3(浓) 4NO2↑+O2↑+2H2O
(2)不正确 可能是由于产生大量的水蒸汽所致。
Ⅲ. 答:①使铜与浓HNO3反应
②生成的气体通入到浓H2SO4中干燥
③用向上排气法收集NO2气体
④用带火星的木条检验,若复燃,则说明NO2支持燃烧。
4.(1)碱性
(2)氧化(漂白) 不稳定
(3)CO2等酸性气体、光和热等
(4)铁钉表面出现铁锈(或红褐色固体)
(5)铁钉可能未被腐蚀;也可能被腐蚀,但无明显现象
用试管取出少量浸泡后的溶液,滴加足量稀H2SO4酸化,再滴加n滴KSCN
5.(1)①②③
(2)①不合理 ②2I-+2Fe3+=I2+2Fe2+ 或 2I +Br2=I2+2Br-
③有可能发生反应,但溴水过量
④取少量黄色溶液,滴加KSCN溶液,若溶液变成血红色,则说明Br2与FeSO4发生了反应。
6.(1)
(2)①1mL
②将弹簧夹夹住A处的乳胶管,注射器的活塞向右拉一段距离,过一段时间后,仍回到原处,说明不漏气。 增大接触面积
③甲醛含量超标
④打开门窗
吸收器
弹簧夹
医用注射器
1000 mL
室内空气
多 孔
玻璃球
5.00mL 0. 0001mol/L
酸性KMnO4溶液
创新题专项练习
化学
1、某铁的氧化物粉末可能含有FeO、Fe2O3中的一种或两种。某兴趣小组同学利用以下装置测定铁的氧化物的组成,请回答下列问题:(已知)
(1)装置甲的作用是 。
(2)装置丁中的实验现象是
。
(3)若丙中铁的氧化物的化学式为FexOy,则丙中反应的化学方程式为 。若丙中铁的氧化物质量为3.92g,且完全反应,丁中生成沉淀的质量为13.79g,试确定该氧化物中x:y= ,该固体粉末的组成为 。
(4)某同学认为上述沉淀方法较复杂,利用1 mol·L—1的硫酸、KSCN溶液、酸性高锰酸钾溶液,即可检验该铁的氧化物的组成,请设计实验检验:
。
2、某白色粉末可能由Na2CO3、NaHCO3中的一种或两种组成。某化学实验小组在实验室中对其组成进行探究,并提出如下假设:
假设Ⅰ:白色粉末是Na2CO3。
假设Ⅱ:白色粉末是NaHCO3。
假设Ⅲ:白色粉末是Na2CO3、NaHCO3的混合物。
(1)请设计实验验证假设Ⅱ: 。
(2)称取一定量的样品置于坩埚中加热片刻后,冷却称重,发现固体质量减少,则假设
(填“Ⅰ”、“Ⅱ”、“Ⅲ”)一定不成立。
(3)实验证明,该样品是Na2CO3、NaHCO3的混合物,为测定混合物中Na2CO3的质量分数,该小组同学又设计了如图所示装置进行实验。
①实验前后均需向装置中通入H2,实验后通入H2的目的是 。
②装置D的作用是 。
③实验前取17.9g样品,实验后测得装置C增重8.80g,则该样品中Na2CO3的质量分数为 。
3、某研究性学习小组的一个课题是“NO2能否支持木条的燃烧?”由于实验室中没有现成的NO2气体,该小组的同学设计了两个方案(忽略N2O4的存在,图中铁架台等夹持仪器均已略去):
Ⅰ、实验装置如图所示
(1)硝酸铜固体加热分解的产物有氧化铜、二氧化氮和氧气。写出该反应的化学方程式:
。
(2)当集气瓶中充满红棕色气体时,木条复燃。有的同学得出“NO2能支持木条的燃烧”的结论。你认为这一结论是否正确? (填“正确”或“不正确”),理由是
,燃杯中盛有 溶液。
Ⅱ、实验装置如图所示
(1)写出浓硝酸受热分解的化学方程式:
。
(2)实验开始后木条上的火星逐渐熄灭,有的同学提出“NO2不能支持木条的燃烧”的结论。你认为这一结论是否正确? (填“正确”或“不正确”),理由是 。
Ⅲ、为了更能直接说明“NO2能否支持木条的燃烧”这一问题,请你重新设计一个简单的实验方案,简述实验原理和主要操作。
4、某品牌消毒液包装说明的部分内容摘录如下:主要有效成分为次氯酸钠,有效氯含量8000 mg/L~10 000 mg/L。可用于各类家居用品、餐具、棉织衣物等的消毒,对彩色织物可能有褪色作用。切勿用于丝绸、毛、尼龙、皮革、油漆表面,勿用于铝、铜、碳钢制品。本品须密封,置阴凉暗处保存。请完成以下实验探究过程:
(一)阅读材料,获取信息
(1)推测该消毒液的酸碱性: 。
(2)该消毒液还具有的化学性质是 性和 性。
(3)从该消毒液的保存要求分析,导致其失效的外界因素主要是 。
(二)确定要研究的问题
该消毒液对碳钢制品是否有腐蚀作用?
(三)设计方案,实施探究
用烧杯取少量样品,将一颗光亮的铁钉放入烧杯,浸泡一段时间。对可能产生的现象有如下假设:假设①:有明显现象;假设②:无明显现象。
(4)基于假设①,结论是铁钉被腐蚀,预期的实验现象是 。
(5)基于假设②,结论是 ,请设计实验进一步验证该结论,叙述实验操作:
。
5、溴水和氯化铁溶液是中学化学实验中的常用试剂,浓度较小时,溶液均呈黄色。某同学在探究铁的化合物的相互转化时,进行了如下实验。请你参与讨论。
实验操作:向20 mL的FeSO4溶液中,滴加浓溴水,振荡。
实验现象:溶液由浅绿色(近乎无色)变成黄色。
(1)溶液颜色发生改变的原因可能是 (用选项符号表示)。
①使溶液呈黄色的微粒是Br2 ②使溶液呈黄色的微粒是Fe3+
③使溶液呈黄色的微粒是Fe3+和Br2
(2)为进一步探究溴水和FeSO4溶液是否发生了反应,下列是该同学设计的一些实验方案:
操作 实验现象及结论
方案1 取少量黄色溶液,加入NaOH 最终生成红褐色沉淀,说明发生了化学反应
方案2 取少量黄色溶液,加入淀粉碘化钾溶液 溶液变蓝色,说明未发生化学反应
方案3 取少量黄色溶液,加入四氯化碳,振荡 下层溶液呈橙红色,说明未发生化学反应
①方案1的结论是否合理 (填“合理”或“不合理”)。
②方案2的结论明显不合理,可能发生反应的离子方程式为 。
③方案3的结论也不合理,理由是 。
④`你认为判断溴水和FeSO4溶液是否反应的最简单方法是(填“操作”“现象”“结论”):
。
6、随着人们日常生活水平的提高,室内空气污染越来越受到人们的重视。造成室内环境污染
的有毒物质主要有甲醛、苯、氨、氡、一氧化碳等物质。请回答下列问题:
⑴ 苯分子的结构简式为 。
⑵ 我国《室内空气质量标准》规定室内空气中甲醛(HCHO)含量不得超过0.08mg/m3。某校
化学研究性学习小组的同学通过查阅资料,拟采用如下方法测定某新装修居室内空气中甲醛的含量。测定原理:5HCHO+4KMnO4+6H2SO4=2K2SO4+4MnSO4+5CO2↑+11H2O
实验操作:用容积为1000 mL的医用注射器抽取空气,缓慢注入酸性高锰酸钾溶液中(装置
如下),当酸性高锰酸钾溶液正好褪色时,停止注入。
① 用0.1000mol/L的酸性KMnO4溶液配制实验中使用的酸性KMnO4溶液1000mL,需
0.1000mol/L的酸性KMnO4溶液的体积为 。
② 向酸性高锰酸钾溶液中注入空气前,应检查装置气密性,操作方法为
;装置中多孔玻璃球的作用是 。
③ 实验时在居室内不同地点抽取空气,并缓慢注入酸性高锰酸钾溶液中。当第200次将注
射器中空气全部缓慢注入酸性高锰酸钾溶液中时,酸性高锰酸钾溶液正好褪色。请通过计算说明该居室空气中甲醛含量是否超标(空气中其他成分不与酸性高锰酸钾溶液反应)。
④ 请你举出减少室内空气污染的一条合理措施: 。
学业水平测试创新题专项练习
1.(1)除去混合气体中的CO2 (2)有白色沉淀生成
(3)FexOy+yCOxFe + yCO2 5∶7 nFeO∶nFe2O3=1∶2
(4)①将铁的氧化物溶于1mol/L的H2SO4制成溶液,并分成两份;
②在其中一份中加入KSCN溶液,若变为血红色,证明有Fe2O3;
③在另一份中加入少量KMnO4,若褪色,则说明有FeO.
2.(1)将粉末溶于水制成溶液,然后滴加BaCl2溶液,若无白色沉淀,则假设Ⅱ成立;
(2)Ⅰ
(3)①使产生的CO2全部被碱石灰吸收;②防止空气中的CO2、H2O(g)倒流;③29.6%
3、Ⅰ.(1)2Cu(NO3)22CuO+4NO2↑+O2↑
(2)正确 Cu(NO3)2分解产生的O2的体积分数与空气中O2的体积分数相等,但空气不能使带火星的木条复燃,所以NO2能支持燃烧。 NaOH
Ⅱ.(1)4HNO3(浓) 4NO2↑+O2↑+2H2O
(2)不正确 可能是由于产生大量的水蒸汽所致。
Ⅲ. 答:①使铜与浓HNO3反应
②生成的气体通入到浓H2SO4中干燥
③用向上排气法收集NO2气体
④用带火星的木条检验,若复燃,则说明NO2支持燃烧。
4.(1)碱性
(2)氧化(漂白) 不稳定
(3)CO2等酸性气体、光和热等
(4)铁钉表面出现铁锈(或红褐色固体)
(5)铁钉可能未被腐蚀;也可能被腐蚀,但无明显现象
用试管取出少量浸泡后的溶液,滴加足量稀H2SO4酸化,再滴加n滴KSCN
5.(1)①②③
(2)①不合理 ②2I-+2Fe3+=I2+2Fe2+ 或 2I +Br2=I2+2Br-
③有可能发生反应,但溴水过量
④取少量黄色溶液,滴加KSCN溶液,若溶液变成血红色,则说明Br2与FeSO4发生了反应。
6.(1)
(2)①1mL
②将弹簧夹夹住A处的乳胶管,注射器的活塞向右拉一段距离,过一段时间后,仍回到原处,说明不漏气。 增大接触面积
③甲醛含量超标
④打开门窗
吸收器
弹簧夹
医用注射器
1000 mL
室内空气
多 孔
玻璃球
5.00mL 0. 0001mol/L
酸性KMnO4溶液
同课章节目录
