第三单元共价键原子晶体第一课时
图片预览









文档简介
课件45张PPT。第三单元 共价键 原子晶体
(第一课时)南靖一中 沈建忠教学目标
1、理解共价键的形成过程;
2、理解共价的类型;
3、充分理解共用电子对;
4、了解共价键的几种重叠方式。
教学要点
共价键的形成及共价键的类型。
教学难点
共价键的重叠方式。教学引入
人类接触的物质中,多数是含有共价键
的物质,共价键是一种重要的化学键。
书本P43—你知道吗?
1、通常哪些元素的原子之间能形成共价键?
2、如何用电子式表示共价分子的形成过程?
3、含有共价键的物质是否一定是共价分子?一、共价键的形成1、定义:2、成键微粒:原子间通过共用电子对所形成的相互作用,叫做共价键。原 子(同种或不同种非金属元素的原子;
或部分金属元素原子和非金属元素原子)3、成键原因:不稳定要趋于稳定;体系能量降低原子双方提供未成对电子结合成共用电子对(1). 原子有未成对的电子;
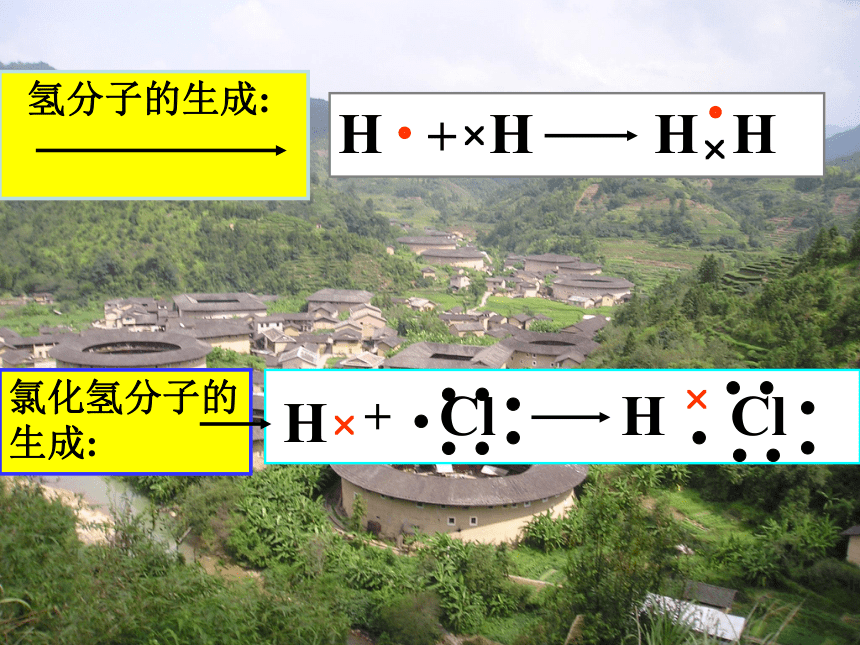
(2).原子间各出对等电子(通过共用电子对,而不是得失电子形成的。)H?H??HH?+Cl??????H? ?Cl??????H??+氯化氢分子的生成: 氢分子的生成:
4、成键元素:非金属与非金属5、存在范围:非金属单质、共价化合物
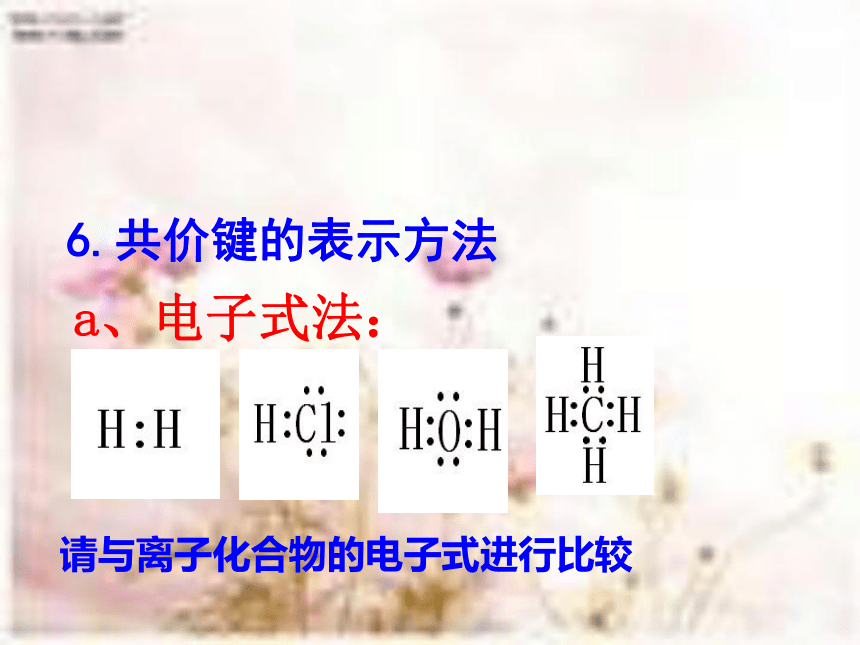
离子化合物(非金属单质、酸、非金属氧化物、非金属气态氢化物、AlCl3、BeCl2等)a、电子式法:6.共价键的表示方法请与离子化合物的电子式进行比较 以共价键形成的分子的电子式的
书写规律:1.每个原子均应达到稳定的结构
2.不加中括号[ ],不标正负电荷数
3.原子最外层电子数距8或2电子稳定结构差几个电子,就提供几个电子,并在此原子周围形成几对共用电子(即几个共价键) 在化学上常用一根短线
表示一对共用电子,例H-H
O=O、Cl-Cl、H-Cl,其余的
电子不标出。这样的式子叫
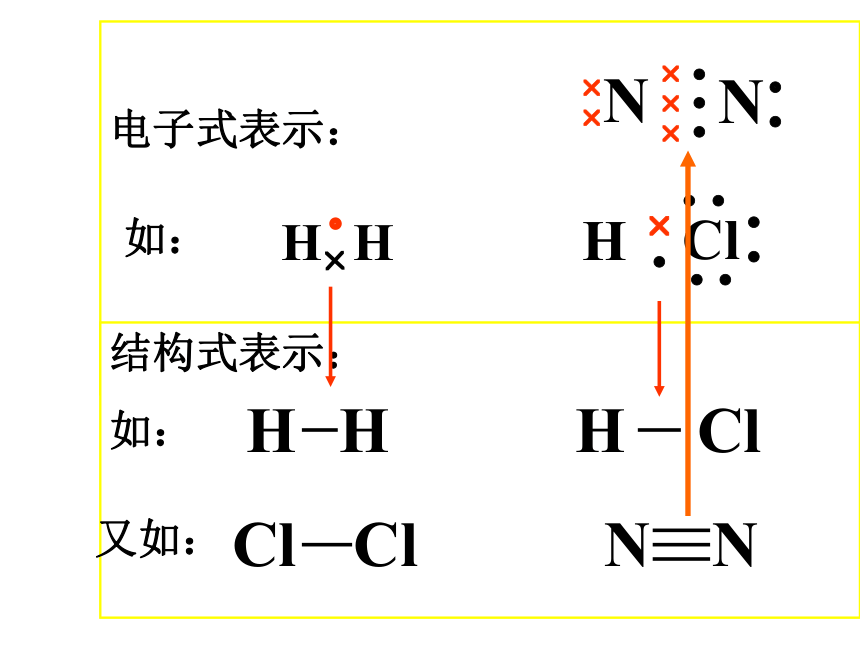
结构式。 b、结构式 :
电子式表示:
结构式表示:
如:
H??HH? ?Cl??????HHHClClClNN如:NN? ??????? ? ?又如:7、用电子式表示共价分子的形成过程:
Br2、HBr、H2O、NH3 Br???????+Br???????Br????????Br??????H+Br???????H??Br??????H?+O??????+H?HO??????? ?HN?????H?++H?H?N????H??H??H?+1、请你分别写出氮
原子和氨气的电子式;N H N H
H2、已知氯化铵为离子化合物,其电
子式如下,请分析其中所含有的化学
键: H
[H N H]+[ Cl ]-
H
3、请用电子式表示出下列物质:
Cl2、 N2、H2S、CH4、
K2S、Ca(OH)2、Na2O2
C????????HHH????????OH[ ]-Ca2+??O??????H[ ]-????O????Na+??O????[ ]2-Na+? ???????ClCl??????NN? ??????? ? ?HH????? ?S??
K+? ?? ?2-K[S+]????H4、写出H2O、CO2、NaOH,MgCl2
的电子式5、根据下列物质的结构
式写出相应电子式:
H—O—Cl 、 H—O—O—H
H—C ≡C—H6、判断下列化合物的类型
NaOH、H2S、MgCl2、H2SO4、KNO3、CO2
离子化合物
共价化合物
含共价键的离子化合物书写电子式注意:
1.分清键型(是离子键还是共价键)
2.形成离子键时,要标电荷;形成共价键时不标电荷
3.成键后的原子或离子,一般为8或2电子稳定结构共价化合物、离子化合物、非金属单质全是共价键才行
如H2O、CH4、H2CO3等 1.原子全稳定
2.不标电荷和[ ]
3.差几拿几成几
共价键 离子键电子对的偏移程度
总结思考的问题?1、是否所有的非金属单质中都存在共价键?2、2个氢原子一定能形成氢分子吗?两个核外电子自旋方向相反的氢原子靠近vr0V:势能
r:核间距r0vr0r0V:势能
r:核间距r0vr0r0V:势能
r:核间距r0vr0r0V:势能
r:核间距两个核外电子自旋方向相同的氢原子靠近vr0V:势能
r:核间距 成键原子相互接近时,原子轨道发生 ,自旋方向 的 电子形成 ,两原子核间的电子密度 ,体系的能量 。重叠相反未成对 共用电子对增 加降低返回8、共价键的成键本质:9、共价键的形成条件A、有自旋方向相反的未成对电子。B、原子轨道要实现最大限度的重叠。 即:电负性相同或差值小的非金属原子之间且成键的原子最外层未达到饱和状态,即成键原子有成单电子。思考的问题:金属键、离子键不具有饱和性和方向性,共价键是否也没有饱和性和方向性?为什么N、O、F与H形成简单的化合 物(NH3、H2O、HF)中H原子数不等?10、共价键的特征(1)、具有饱和性形成的共价键数 = 未成对电子数 在成键原子中,有几个未成对电子通常就只能形成几个共价键,所以在共价分子中每个原子形成共价键数目是一定的。XZXZ(2)、具有方向性返回请同学们结合课本P44页分析因为S轨道是球形对称的,所以S轨道与S轨道形成的共价键没有方向性。是不是所有的共价键都具有方向性?问题:(1).键长:在分子中,两个成键的原子的核间距离叫做键长。11、共价键的参数 一般说来,两个原子间所形成的键越短,键就越强,越牢固。(2).键能:拆开1mol某种键所需要吸收的能量,叫做键能。例如:H2 + 436KJ ? H + H
Cl2+247KJ ? Cl + Cl
N2+946KJ ? N + N一般来说,键能越大,表示化学键越牢固,含有该键的分子越稳定。键能的单位为: KJ/mol
参考下表中化学键的键能数据,下列分子中,受热时最稳定的是( )A.氢气 B.氟化氢 C.氯化氢 D.溴化氢B 在含有多个共价键的分子中, 相邻共价键之间存在一定的夹角,如H2O分子:CO2分子的键角
CH4分子的键角(3).键角:在分子中键和键之间的夹角叫做键角。甲烷(CH4)分子的空间结构
C—H键之间的夹角为109o28’12、影响共价键强弱的主要因素 键长(成键原子的核间距) 一般键长越 ,键能越 ,共价键越 ,分子就越 。小大牢固稳定本节小结:2.共价键的形成条件1.共价键的本质3.共价键的特征作业布置:
1、完成课本P52—3、4、5、6、7
2、完成《导与学》相应内容。
(第一课时)南靖一中 沈建忠教学目标
1、理解共价键的形成过程;
2、理解共价的类型;
3、充分理解共用电子对;
4、了解共价键的几种重叠方式。
教学要点
共价键的形成及共价键的类型。
教学难点
共价键的重叠方式。教学引入
人类接触的物质中,多数是含有共价键
的物质,共价键是一种重要的化学键。
书本P43—你知道吗?
1、通常哪些元素的原子之间能形成共价键?
2、如何用电子式表示共价分子的形成过程?
3、含有共价键的物质是否一定是共价分子?一、共价键的形成1、定义:2、成键微粒:原子间通过共用电子对所形成的相互作用,叫做共价键。原 子(同种或不同种非金属元素的原子;
或部分金属元素原子和非金属元素原子)3、成键原因:不稳定要趋于稳定;体系能量降低原子双方提供未成对电子结合成共用电子对(1). 原子有未成对的电子;
(2).原子间各出对等电子(通过共用电子对,而不是得失电子形成的。)H?H??HH?+Cl??????H? ?Cl??????H??+氯化氢分子的生成: 氢分子的生成:
4、成键元素:非金属与非金属5、存在范围:非金属单质、共价化合物
离子化合物(非金属单质、酸、非金属氧化物、非金属气态氢化物、AlCl3、BeCl2等)a、电子式法:6.共价键的表示方法请与离子化合物的电子式进行比较 以共价键形成的分子的电子式的
书写规律:1.每个原子均应达到稳定的结构
2.不加中括号[ ],不标正负电荷数
3.原子最外层电子数距8或2电子稳定结构差几个电子,就提供几个电子,并在此原子周围形成几对共用电子(即几个共价键) 在化学上常用一根短线
表示一对共用电子,例H-H
O=O、Cl-Cl、H-Cl,其余的
电子不标出。这样的式子叫
结构式。 b、结构式 :
电子式表示:
结构式表示:
如:
H??HH? ?Cl??????HHHClClClNN如:NN? ??????? ? ?又如:7、用电子式表示共价分子的形成过程:
Br2、HBr、H2O、NH3 Br???????+Br???????Br????????Br??????H+Br???????H??Br??????H?+O??????+H?HO??????? ?HN?????H?++H?H?N????H??H??H?+1、请你分别写出氮
原子和氨气的电子式;N H N H
H2、已知氯化铵为离子化合物,其电
子式如下,请分析其中所含有的化学
键: H
[H N H]+[ Cl ]-
H
3、请用电子式表示出下列物质:
Cl2、 N2、H2S、CH4、
K2S、Ca(OH)2、Na2O2
C????????HHH????????OH[ ]-Ca2+??O??????H[ ]-????O????Na+??O????[ ]2-Na+? ???????ClCl??????NN? ??????? ? ?HH????? ?S??
K+? ?? ?2-K[S+]????H4、写出H2O、CO2、NaOH,MgCl2
的电子式5、根据下列物质的结构
式写出相应电子式:
H—O—Cl 、 H—O—O—H
H—C ≡C—H6、判断下列化合物的类型
NaOH、H2S、MgCl2、H2SO4、KNO3、CO2
离子化合物
共价化合物
含共价键的离子化合物书写电子式注意:
1.分清键型(是离子键还是共价键)
2.形成离子键时,要标电荷;形成共价键时不标电荷
3.成键后的原子或离子,一般为8或2电子稳定结构共价化合物、离子化合物、非金属单质全是共价键才行
如H2O、CH4、H2CO3等 1.原子全稳定
2.不标电荷和[ ]
3.差几拿几成几
共价键 离子键电子对的偏移程度
总结思考的问题?1、是否所有的非金属单质中都存在共价键?2、2个氢原子一定能形成氢分子吗?两个核外电子自旋方向相反的氢原子靠近vr0V:势能
r:核间距r0vr0r0V:势能
r:核间距r0vr0r0V:势能
r:核间距r0vr0r0V:势能
r:核间距两个核外电子自旋方向相同的氢原子靠近vr0V:势能
r:核间距 成键原子相互接近时,原子轨道发生 ,自旋方向 的 电子形成 ,两原子核间的电子密度 ,体系的能量 。重叠相反未成对 共用电子对增 加降低返回8、共价键的成键本质:9、共价键的形成条件A、有自旋方向相反的未成对电子。B、原子轨道要实现最大限度的重叠。 即:电负性相同或差值小的非金属原子之间且成键的原子最外层未达到饱和状态,即成键原子有成单电子。思考的问题:金属键、离子键不具有饱和性和方向性,共价键是否也没有饱和性和方向性?为什么N、O、F与H形成简单的化合 物(NH3、H2O、HF)中H原子数不等?10、共价键的特征(1)、具有饱和性形成的共价键数 = 未成对电子数 在成键原子中,有几个未成对电子通常就只能形成几个共价键,所以在共价分子中每个原子形成共价键数目是一定的。XZXZ(2)、具有方向性返回请同学们结合课本P44页分析因为S轨道是球形对称的,所以S轨道与S轨道形成的共价键没有方向性。是不是所有的共价键都具有方向性?问题:(1).键长:在分子中,两个成键的原子的核间距离叫做键长。11、共价键的参数 一般说来,两个原子间所形成的键越短,键就越强,越牢固。(2).键能:拆开1mol某种键所需要吸收的能量,叫做键能。例如:H2 + 436KJ ? H + H
Cl2+247KJ ? Cl + Cl
N2+946KJ ? N + N一般来说,键能越大,表示化学键越牢固,含有该键的分子越稳定。键能的单位为: KJ/mol
参考下表中化学键的键能数据,下列分子中,受热时最稳定的是( )A.氢气 B.氟化氢 C.氯化氢 D.溴化氢B 在含有多个共价键的分子中, 相邻共价键之间存在一定的夹角,如H2O分子:CO2分子的键角
CH4分子的键角(3).键角:在分子中键和键之间的夹角叫做键角。甲烷(CH4)分子的空间结构
C—H键之间的夹角为109o28’12、影响共价键强弱的主要因素 键长(成键原子的核间距) 一般键长越 ,键能越 ,共价键越 ,分子就越 。小大牢固稳定本节小结:2.共价键的形成条件1.共价键的本质3.共价键的特征作业布置:
1、完成课本P52—3、4、5、6、7
2、完成《导与学》相应内容。
