共价键类型
图片预览



文档简介
课件51张PPT。第三单元共价键原子晶体
(第二课时:共价键的类型)南靖一中 沈建忠二、共价键的类型(一)、按两原子之间共用电子对
的数目,可分为共价单键、共价双
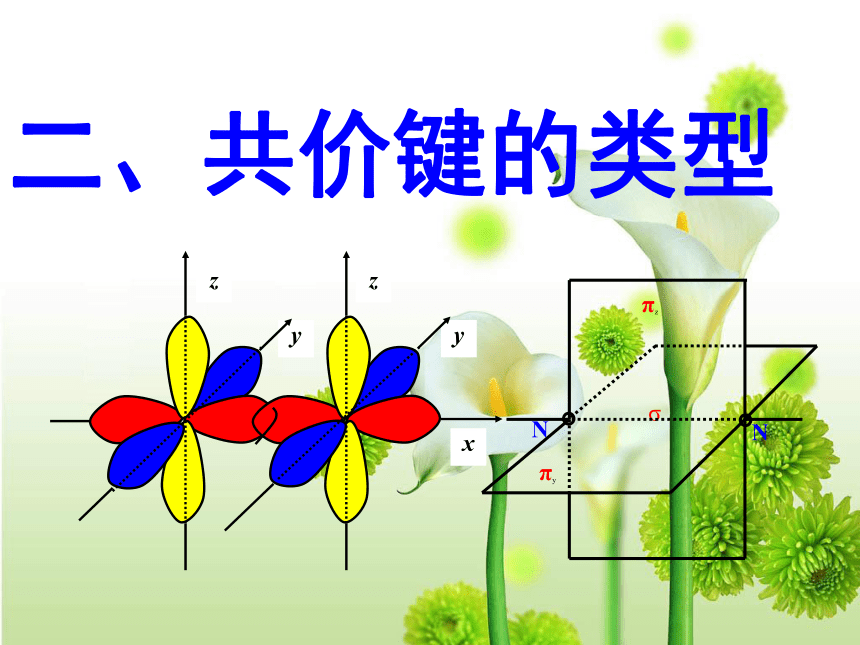
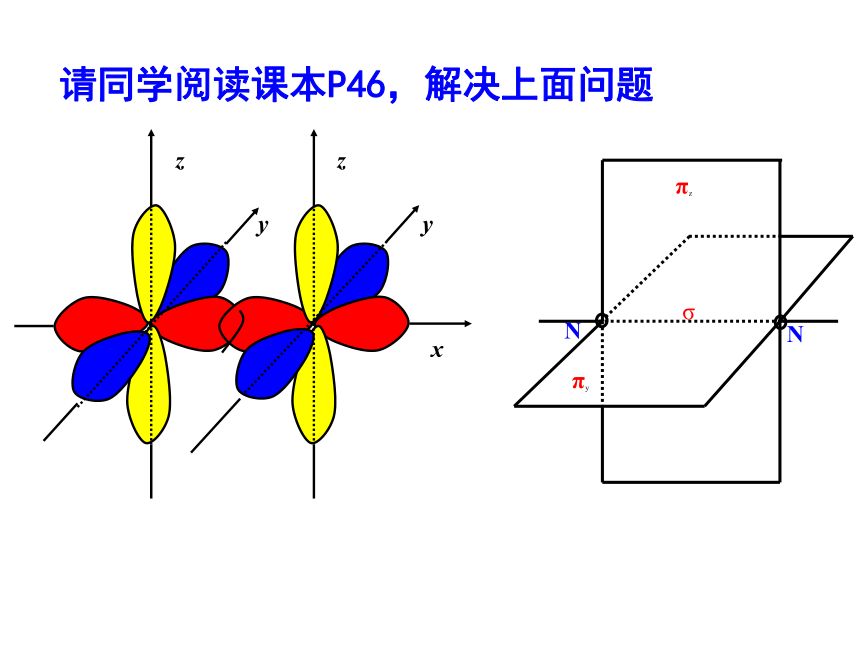
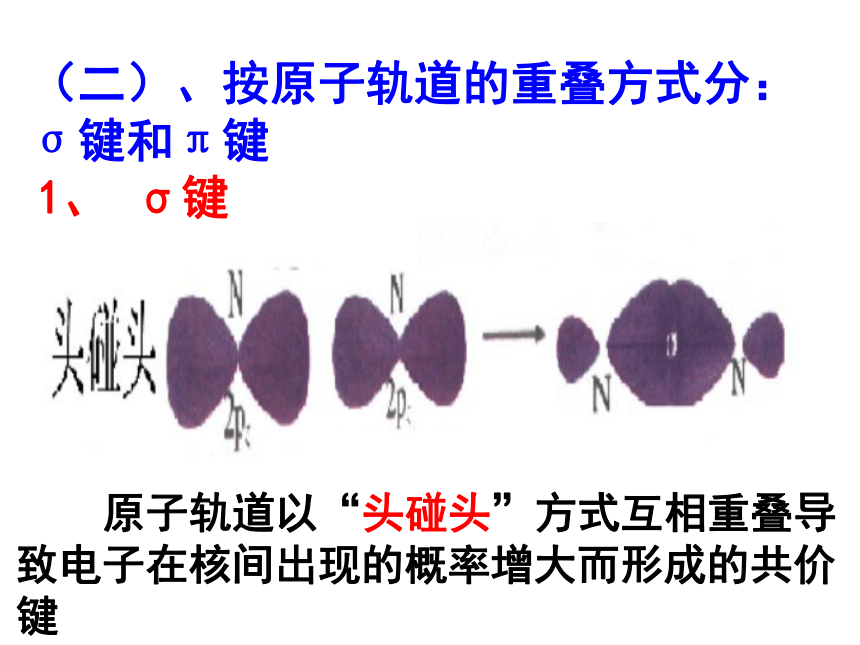
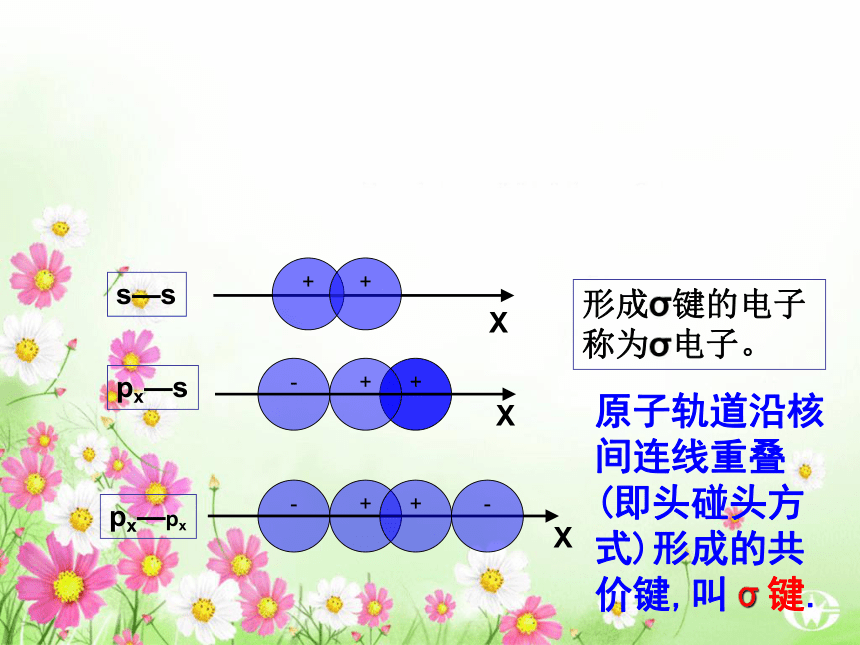
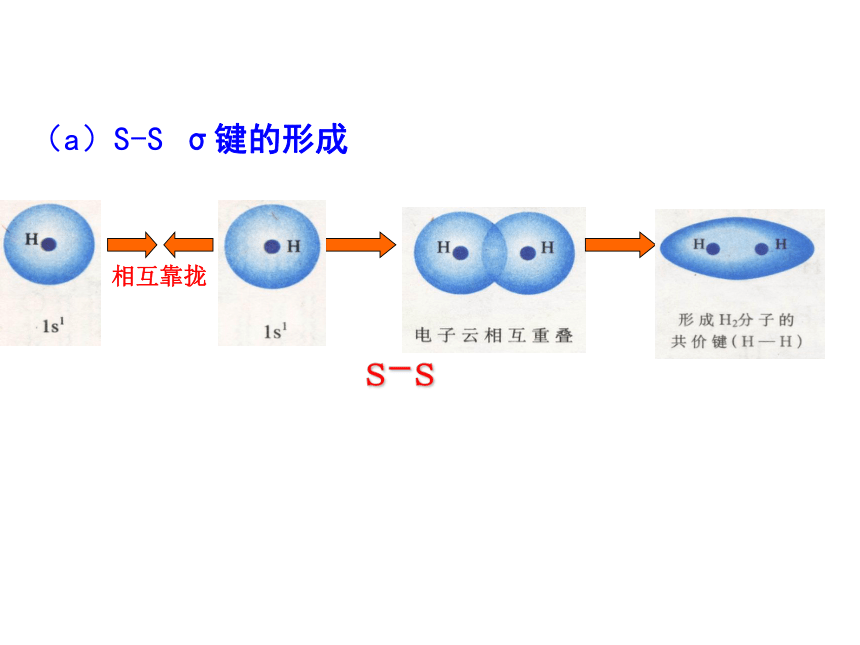
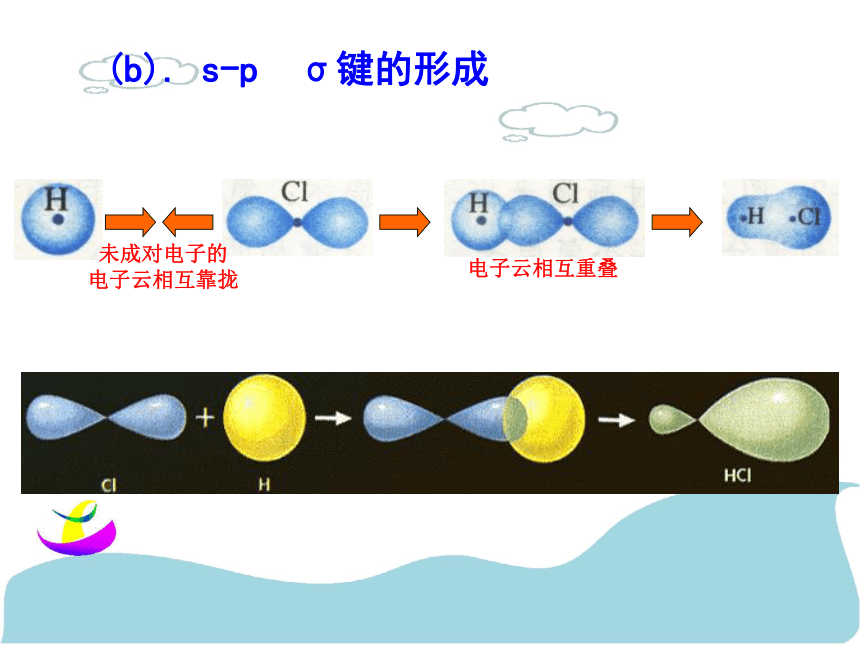
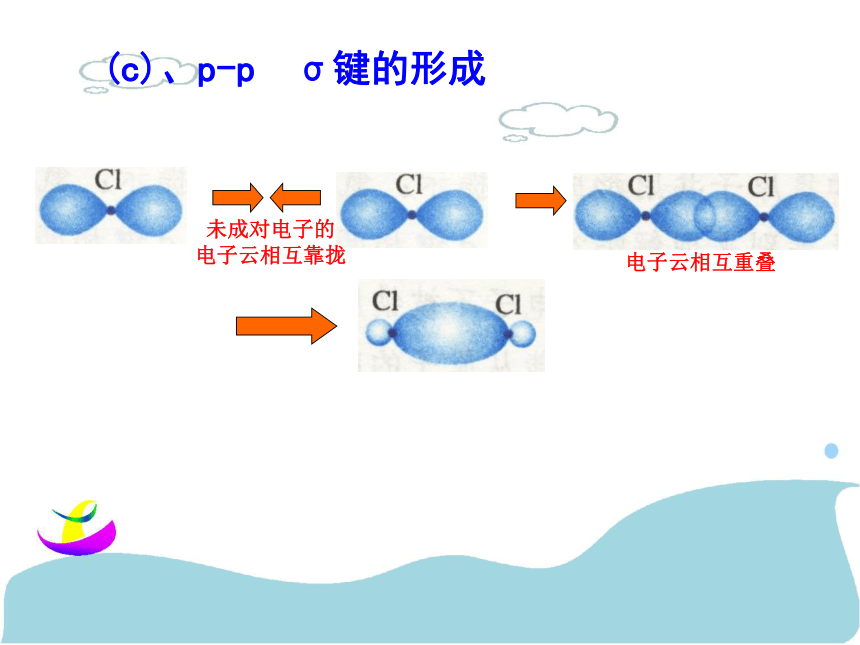
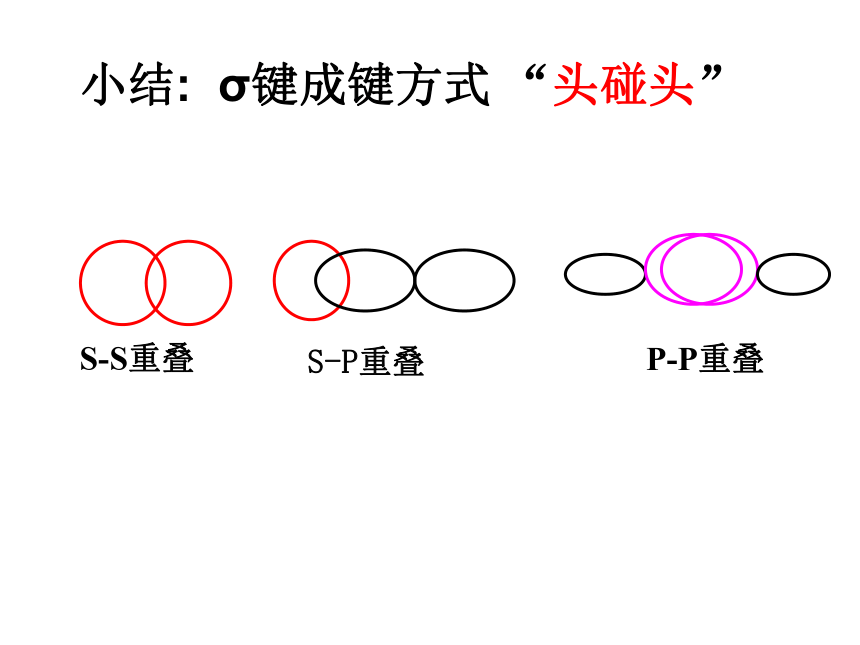
键、共价叁键。 氮气的化学性质很不活泼,通常很难与其他物质发生化学反应。请你写出氮分子的电子式和结构式,并分析氮分子中氮原子的轨道是如何重叠形成化学键的?交流与讨论P45请同学阅读课本P46,解决上面问题1、 σ键 原子轨道以“头碰头”方式互相重叠导致电子在核间出现的概率增大而形成的共价键(二)、按原子轨道的重叠方式分: σ键和π键 X++s—sX+px—sXpx—px形成σ键的电子
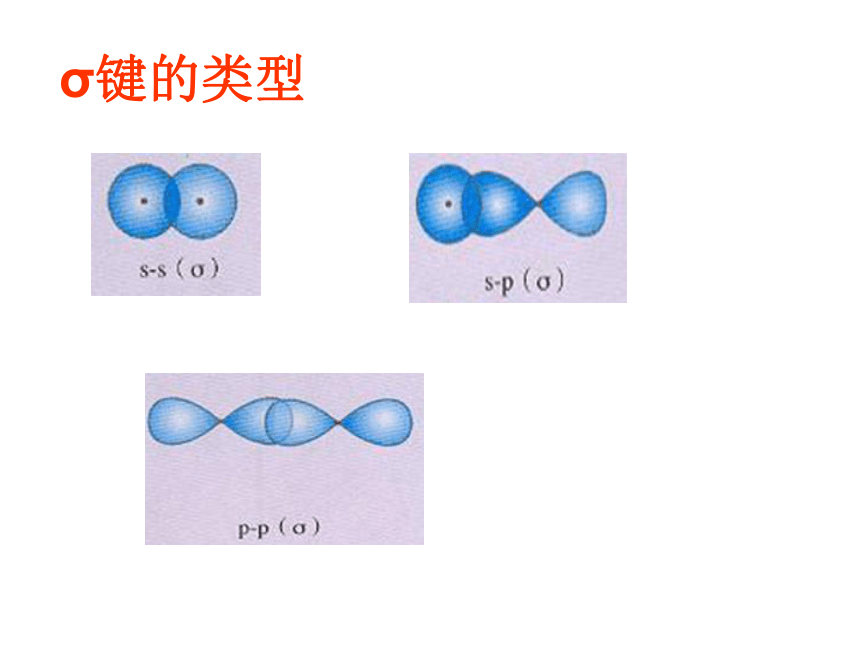
称为σ电子。原子轨道沿核间连线重叠(即头碰头方式)形成的共价键,叫σ键.(a)S-S σ键的形成(b). s-p σ键的形成(c)、p-p σ键的形成σ键的类型小结: σ键成键方式 “头碰头” 原子轨道以“肩并肩”方式相互重叠导致电子在核间出现的概率增大而形成的共价键2、π键+IXZZpZ—pZ形成π键的电子称为π电子。原子轨道在核间连线两侧进行重叠(即采用肩并肩)方式形成的共价键,叫π键.p-pπ键形成过程?键特点:两个原子轨道以平行或“肩并肩” 方式重叠;原子重叠的部分分别位于两原子核构成平面的两侧,如果以它们之间包含原子核的平面为镜面,它们互为镜像,称为镜像对称由于?键重叠程度要比?键小,所以?键的强度要比?键大。“肩并肩”π键的类型项目键型σ键与π键的对比沿轴方向 “头碰头”平行或 “肩并肩”轴对称镜像对称σ键强度大,
不容易断裂π键强度较小,
容易断裂共价单键是σ键,共价双键中一个是σ键,另一个是π键,共价三键中一个是σ键,另两个为π键小结1、σ键的常见类型有(1)s-s,(2)s-p,(2)p-p,请指出下列分子σ键所属类型:
A、HBr
B、NH3
C、F2
D、H2s-ps-pp-ps-s课堂习题2、已知π键可吸收紫外线,含π键物质可做护肤品。请问下列物质中哪些是含有π键的分子 ( )
A. CO B. CH4
C. CO2 D. C2H2CD3、有机物中的共价键(1)、C – H 是σ键。(2)、C—C 是σ键。(3)、C=C 一个σ键,一个π键。(4)、 C ≡C 一个σ键,两个π键。乙烯、乙炔分子中C-C σ键比较稳定不容易断裂, π键比较容易断裂。 乙烷、乙烯和乙炔分子中的共价键分别由几个σ键和几个π键组成?问题思考乙烷: 个σ键
乙烯: 个σ键 个π键
乙炔: 个σ键 个π键7乙烯、乙炔分子中轨道重叠方式示意图 请写出乙烯、乙炔与溴发生加成反应的反应方程式。并思考:在乙烯、乙炔和溴发生的加成反应中,乙烯、乙炔分子断裂什么类型的共价键?问题解决P46页拓展视野 1、根据氢原子和氟原子的核外电子排布,你知道F2和HF分子中形成的共价键有什么不同吗? 2、根据元素电负性的强弱,你能判断F2和HF分子中共用电子对是否发生便移吗?你知道吗?P47页(三)、按共用电子对是否发生偏移分:极性键和非极性键相 同 不发生相 同不 同 发 生不 同3、一般情况下,同种元素的原子之间形成 共价键,不同种元素的原子之间形成 共价键。非极性极 性4、在极性共价键中,成键原子吸引电子能力的差别越大,共用电子对的偏移程度 ,共价键的极性 。越大越 大完成 P47交流与讨论1、极性键:
非极性键:HCl CO H2OCl2 N2 H22、键的极性由强到弱的顺序:F—H O– H N—H C—H3、在水溶液中,NH3能与H+结合
生成NH4+,请用电子式表示N和H
形成NH3的过程,讨论NH3与H+是
如何形成NH4+的。
请同学们阅读书本P48页! 氨分子中,氮原子和氢原子通过什么键结合? 写出氨分子的电子式和结构式。 极性共价键 写出氨与盐酸反应的化学方程式和离子方程式。 氮原子有孤对电子,氢离子有空轨道。 NH3 + HCl = NH4Cl NH3 + H+ = NH4+ 氨分子中各原子均达稳定结构,为什么还
能与氢离子结合?H++→++或 共用电子对全部由氮原子提供。 由一个原子提供孤对电子,另一个原子提
供空轨道或另一个接受电子对的原子形成的共价键称配位键。氨根离子与水合氢离子等是通过配位键形成的。+H+→+(四)、按提供共用电子对的方式分:
普通共价键和配位键。 表示方法:
在表示分子或离子的结合式时,常用
表示配位键,
其箭头由提供电子对的原子指向接受
电子对的原子,如:
在氨离子中,四个N-H 键的键长、键能、键角均相等,表现的化学性质也完全相同。所以铵离子通常用下式表示:H++→+或++极性分子:正电中心和负电中心不重合非极性分子:正电中心和负电中心重合1、概念三、极性键与分子的极性:正电中心和 负电中心
是否重合 化学键的极性的向量和是否等于零(定量) 看键的极性,也看分子的空间构型 2、判断方法:(本质)1 含有非极性键的离子化合物有:Na2O2、FeS2、CaC2
含有离子键、共价键、配位键的有:NH4Cl
含有非极性键极性分子有:H2O2……
含有极性键的非极性分子有:CCl4、CO2、CH4小结:3、分子的空间构型及极性
(1)双原子分子
极性:HCl、CO 非极性:H2、Cl2
(2)三原子分子
非极性:O=C=O直线型,
极性: V型
(3)四原子分子
非极性: 极性:
平面三角型; 三角锥型
(4)五原子分子
非极性: 极性:
变形四面正四面体
?
H2、N2、O2、P4、C60非极性分子重合非极性键同核原子分子异核双原子分子异核多原子分子极性键分子中各键向量和为零分子中各键向量和不为零重合不重合不重合非极性分子极性分子极性分子CO、HClCO2、CH4HCN、H2O、NH3、CH3Cl小结:共价键的类型1、非极性键:共用电子对不偏向任何原子的共价键,同种非金属元素的原子形成的共价键。
2、极性键:共用电子对发生偏向的共价键,不同种非金属元素的原子形成的共价键。成键原子的电负型相差越大,键的极性越强。
配位键:由一个原子提供一对电子与另一个接受电子的原子形成共价键。例,NH4+ 、H3O+3、共用电子对的目的是达到稳定结构(氢原子达
到2个电子,其他原子达到8个电子)1、关于乙醇分子的说法正确的是( )
A、分子中共含有8个极性键
B、分子中不含非极性键
C、分子中只含σ键
D、分子中含有1个π键C课堂习题2、3、下列分子中含有非极性键的是共价化合物是 ( )
A、F2 B、C2H2 C、Na2O2 D、NH3B4、下列分子中含有非极性键的是共价化合物是 ( )
A、F2 B、C2H2 C、Na2O2 D、NH3
E、CH3COONa F、C2H6
G、H2O2 H、 CO25、已知水电离成为氢氧根离子和水合氢离子,试写出阳离子的结构 。6、下列分子中不含有π键的是:
A、O2 B、CaC2
C、F2 D、C6H6
E、氯乙烯 F、Na2O2作业布置:
1、完成书本P52----1、7
2、完成《导与学》相应习题。
(第二课时:共价键的类型)南靖一中 沈建忠二、共价键的类型(一)、按两原子之间共用电子对
的数目,可分为共价单键、共价双
键、共价叁键。 氮气的化学性质很不活泼,通常很难与其他物质发生化学反应。请你写出氮分子的电子式和结构式,并分析氮分子中氮原子的轨道是如何重叠形成化学键的?交流与讨论P45请同学阅读课本P46,解决上面问题1、 σ键 原子轨道以“头碰头”方式互相重叠导致电子在核间出现的概率增大而形成的共价键(二)、按原子轨道的重叠方式分: σ键和π键 X++s—sX+px—sXpx—px形成σ键的电子
称为σ电子。原子轨道沿核间连线重叠(即头碰头方式)形成的共价键,叫σ键.(a)S-S σ键的形成(b). s-p σ键的形成(c)、p-p σ键的形成σ键的类型小结: σ键成键方式 “头碰头” 原子轨道以“肩并肩”方式相互重叠导致电子在核间出现的概率增大而形成的共价键2、π键+IXZZpZ—pZ形成π键的电子称为π电子。原子轨道在核间连线两侧进行重叠(即采用肩并肩)方式形成的共价键,叫π键.p-pπ键形成过程?键特点:两个原子轨道以平行或“肩并肩” 方式重叠;原子重叠的部分分别位于两原子核构成平面的两侧,如果以它们之间包含原子核的平面为镜面,它们互为镜像,称为镜像对称由于?键重叠程度要比?键小,所以?键的强度要比?键大。“肩并肩”π键的类型项目键型σ键与π键的对比沿轴方向 “头碰头”平行或 “肩并肩”轴对称镜像对称σ键强度大,
不容易断裂π键强度较小,
容易断裂共价单键是σ键,共价双键中一个是σ键,另一个是π键,共价三键中一个是σ键,另两个为π键小结1、σ键的常见类型有(1)s-s,(2)s-p,(2)p-p,请指出下列分子σ键所属类型:
A、HBr
B、NH3
C、F2
D、H2s-ps-pp-ps-s课堂习题2、已知π键可吸收紫外线,含π键物质可做护肤品。请问下列物质中哪些是含有π键的分子 ( )
A. CO B. CH4
C. CO2 D. C2H2CD3、有机物中的共价键(1)、C – H 是σ键。(2)、C—C 是σ键。(3)、C=C 一个σ键,一个π键。(4)、 C ≡C 一个σ键,两个π键。乙烯、乙炔分子中C-C σ键比较稳定不容易断裂, π键比较容易断裂。 乙烷、乙烯和乙炔分子中的共价键分别由几个σ键和几个π键组成?问题思考乙烷: 个σ键
乙烯: 个σ键 个π键
乙炔: 个σ键 个π键7乙烯、乙炔分子中轨道重叠方式示意图 请写出乙烯、乙炔与溴发生加成反应的反应方程式。并思考:在乙烯、乙炔和溴发生的加成反应中,乙烯、乙炔分子断裂什么类型的共价键?问题解决P46页拓展视野 1、根据氢原子和氟原子的核外电子排布,你知道F2和HF分子中形成的共价键有什么不同吗? 2、根据元素电负性的强弱,你能判断F2和HF分子中共用电子对是否发生便移吗?你知道吗?P47页(三)、按共用电子对是否发生偏移分:极性键和非极性键相 同 不发生相 同不 同 发 生不 同3、一般情况下,同种元素的原子之间形成 共价键,不同种元素的原子之间形成 共价键。非极性极 性4、在极性共价键中,成键原子吸引电子能力的差别越大,共用电子对的偏移程度 ,共价键的极性 。越大越 大完成 P47交流与讨论1、极性键:
非极性键:HCl CO H2OCl2 N2 H22、键的极性由强到弱的顺序:F—H O– H N—H C—H3、在水溶液中,NH3能与H+结合
生成NH4+,请用电子式表示N和H
形成NH3的过程,讨论NH3与H+是
如何形成NH4+的。
请同学们阅读书本P48页! 氨分子中,氮原子和氢原子通过什么键结合? 写出氨分子的电子式和结构式。 极性共价键 写出氨与盐酸反应的化学方程式和离子方程式。 氮原子有孤对电子,氢离子有空轨道。 NH3 + HCl = NH4Cl NH3 + H+ = NH4+ 氨分子中各原子均达稳定结构,为什么还
能与氢离子结合?H++→++或 共用电子对全部由氮原子提供。 由一个原子提供孤对电子,另一个原子提
供空轨道或另一个接受电子对的原子形成的共价键称配位键。氨根离子与水合氢离子等是通过配位键形成的。+H+→+(四)、按提供共用电子对的方式分:
普通共价键和配位键。 表示方法:
在表示分子或离子的结合式时,常用
表示配位键,
其箭头由提供电子对的原子指向接受
电子对的原子,如:
在氨离子中,四个N-H 键的键长、键能、键角均相等,表现的化学性质也完全相同。所以铵离子通常用下式表示:H++→+或++极性分子:正电中心和负电中心不重合非极性分子:正电中心和负电中心重合1、概念三、极性键与分子的极性:正电中心和 负电中心
是否重合 化学键的极性的向量和是否等于零(定量) 看键的极性,也看分子的空间构型 2、判断方法:(本质)1 含有非极性键的离子化合物有:Na2O2、FeS2、CaC2
含有离子键、共价键、配位键的有:NH4Cl
含有非极性键极性分子有:H2O2……
含有极性键的非极性分子有:CCl4、CO2、CH4小结:3、分子的空间构型及极性
(1)双原子分子
极性:HCl、CO 非极性:H2、Cl2
(2)三原子分子
非极性:O=C=O直线型,
极性: V型
(3)四原子分子
非极性: 极性:
平面三角型; 三角锥型
(4)五原子分子
非极性: 极性:
变形四面正四面体
?
H2、N2、O2、P4、C60非极性分子重合非极性键同核原子分子异核双原子分子异核多原子分子极性键分子中各键向量和为零分子中各键向量和不为零重合不重合不重合非极性分子极性分子极性分子CO、HClCO2、CH4HCN、H2O、NH3、CH3Cl小结:共价键的类型1、非极性键:共用电子对不偏向任何原子的共价键,同种非金属元素的原子形成的共价键。
2、极性键:共用电子对发生偏向的共价键,不同种非金属元素的原子形成的共价键。成键原子的电负型相差越大,键的极性越强。
配位键:由一个原子提供一对电子与另一个接受电子的原子形成共价键。例,NH4+ 、H3O+3、共用电子对的目的是达到稳定结构(氢原子达
到2个电子,其他原子达到8个电子)1、关于乙醇分子的说法正确的是( )
A、分子中共含有8个极性键
B、分子中不含非极性键
C、分子中只含σ键
D、分子中含有1个π键C课堂习题2、3、下列分子中含有非极性键的是共价化合物是 ( )
A、F2 B、C2H2 C、Na2O2 D、NH3B4、下列分子中含有非极性键的是共价化合物是 ( )
A、F2 B、C2H2 C、Na2O2 D、NH3
E、CH3COONa F、C2H6
G、H2O2 H、 CO25、已知水电离成为氢氧根离子和水合氢离子,试写出阳离子的结构 。6、下列分子中不含有π键的是:
A、O2 B、CaC2
C、F2 D、C6H6
E、氯乙烯 F、Na2O2作业布置:
1、完成书本P52----1、7
2、完成《导与学》相应习题。
