共价键的键能与化学反应的反应热
图片预览





文档简介
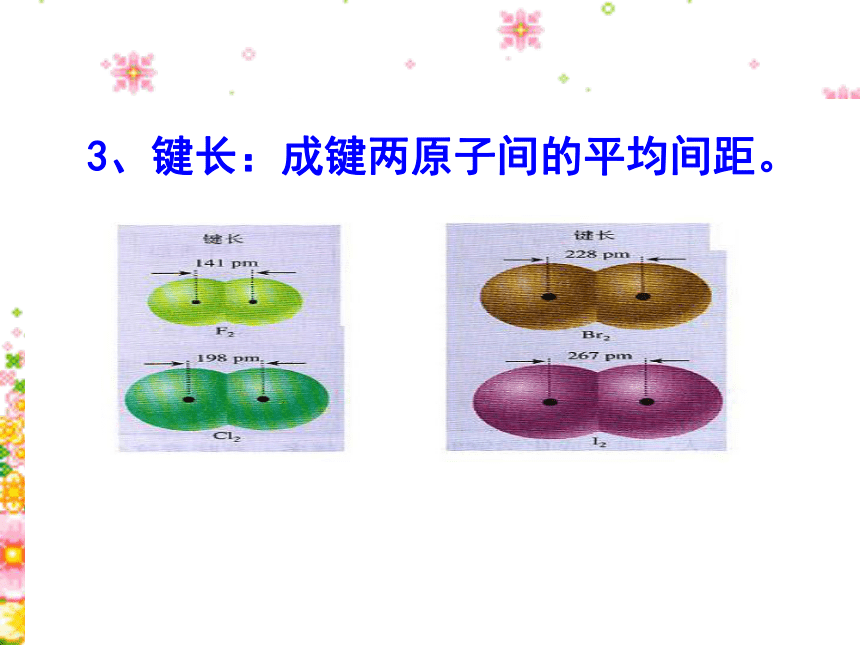
课件16张PPT。第三单元 共价键 原子晶体(第三节共价键的键能与化学反应的反应热)南靖一中 沈建忠回顾:共价键的键能 1 气态原子形成一摩共价单键所释放的能量(或破坏一摩单键所吸收的能量)叫做键能。单位:KJ?mol-1H + H → H2 + 436kJ2 共价键的键能用来衡量共价键牢固程度,共价键键能越大表示该共价键越牢固,即越不容易被破坏。H2 + 436kJ → H + H由课本P48你知道吗?引入新课.3、键长:成键两原子间的平均间距。4、共价键键能与键长的关系:
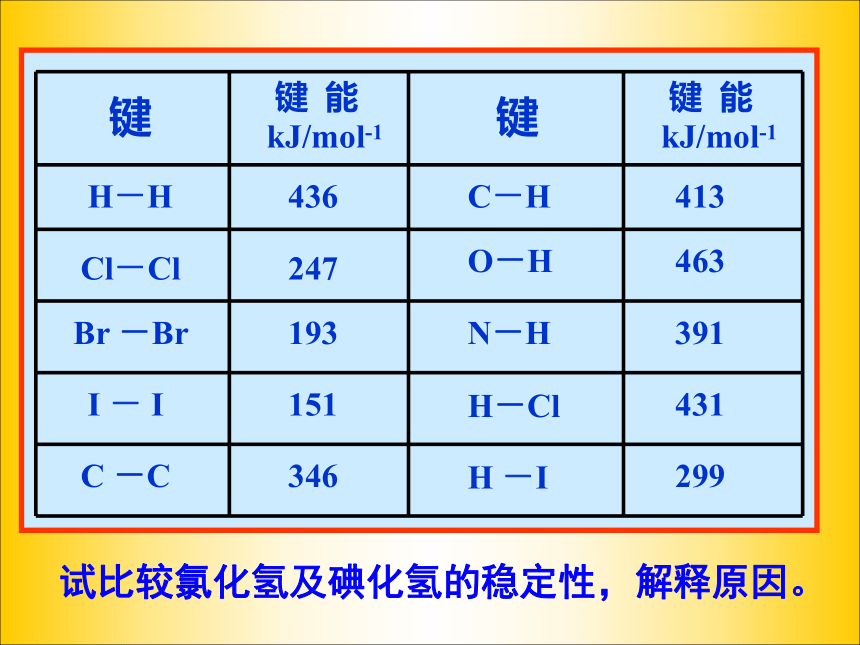
请认真分析P49 表3-5。结论:
键长越短,键能越大,共价键越稳定。试比较氯化氢及碘化氢的稳定性,解释原因。结论(1)原子间形成共价键,原子轨道发生重叠。原子轨道重叠程度越大,共价键的键能越大,两原子核的平均间距—键长越短。
(2)一般说来:结构相似的分子,其共价键的键长越短,共价键的键能越大,分子越稳定。见P49表3-5
三、共价键的键能与反应过
程中能量变化的关系P49 问题解决
主要问题是如何利用键能来
计算反应过程中的能量变化。(教学过程)拆开化学键要消耗能量,形成化学键会放出能量。
化学反应的过程就是折开反应物的化学键,形成生成物的化学键的过程
如果反应物的键能总和<生成物的键能总和,则此反应为放热反应;
反之,反应物的键能总和>生成物的键能总和则为吸热反应结论:△H总=△H反应物—△H生成物
△H反应物,△H生成物分别代表反应物生成物键能总和P50 问题解决(2)△H=2 ×436kJ/mol+498kJ/mol-2×(2×463) kJ/mol=-482kJ/mol1、(1)
△H = 946kJ/mol+3×436kJ/mol-
2×(3×393)kJ/mol= -104kJ/mol2、H---X的键能分别是:
H—F = 567kj/mol
H—Cl = 431kj/mol
H—Br = 366kj/mol
H—I = 298kj/mol
结论:键能越大,分子的稳定性越强。完成课本P50问题解决NO.3课堂习题:
1、已知C—H、C—F、H—F、F—F键
的键能(单位: kJ/mol-1)分别为414、
489、565、158。试据键能数据估算如下
反应的反应热:CH4(g)+4F2(g)==
CF4(g)+4HF(g)答案:4X414+4X158—4X489—4X565
==—1928 kJ/mol-12、已知键能(单位: kJ/mol-1):
P—P:198;P—O:360;O==O:498;
P==O:585。又知P4O10分子的结构为
右图示:计算下列反应热:P4+5O2==P4O10答案:
6X198+5X498—4X585—12X360==—2982 kJ/mol-13、由N2和H2每生成1molNH3放热46KJ,
而每生成1molNH2—NH2却吸热96KJ,
又知H—H键的键能为435 kJ/mol-1,N三N
叁键的键能为941kJ/mol-1。求
(1)N—H键的键能;(答案:390)
(2)N—N单键的键能。(答案:155)本节小结:
1、共价键的键能与化学反应热的关系;
1、计算化学反应热。
作业布置:
1、完成书本P52页--2;
2、完成〈导与学〉相应内容。附录:(下一张) CO分子和N2分子的某些性质 等电子原理:1原子总数相同、价电子总数相同的分子具有
相似的化学键特征,它们的许多性质是相近
的 2.等电子体的判断和利用
判断方法:原子总数相同,价电子总数相同的 分子为 等电子体
运用:利用等电子体的性质相似,空间构型相 同,可运用来预测分子空间的构型和性质
请认真分析P49 表3-5。结论:
键长越短,键能越大,共价键越稳定。试比较氯化氢及碘化氢的稳定性,解释原因。结论(1)原子间形成共价键,原子轨道发生重叠。原子轨道重叠程度越大,共价键的键能越大,两原子核的平均间距—键长越短。
(2)一般说来:结构相似的分子,其共价键的键长越短,共价键的键能越大,分子越稳定。见P49表3-5
三、共价键的键能与反应过
程中能量变化的关系P49 问题解决
主要问题是如何利用键能来
计算反应过程中的能量变化。(教学过程)拆开化学键要消耗能量,形成化学键会放出能量。
化学反应的过程就是折开反应物的化学键,形成生成物的化学键的过程
如果反应物的键能总和<生成物的键能总和,则此反应为放热反应;
反之,反应物的键能总和>生成物的键能总和则为吸热反应结论:△H总=△H反应物—△H生成物
△H反应物,△H生成物分别代表反应物生成物键能总和P50 问题解决(2)△H=2 ×436kJ/mol+498kJ/mol-2×(2×463) kJ/mol=-482kJ/mol1、(1)
△H = 946kJ/mol+3×436kJ/mol-
2×(3×393)kJ/mol= -104kJ/mol2、H---X的键能分别是:
H—F = 567kj/mol
H—Cl = 431kj/mol
H—Br = 366kj/mol
H—I = 298kj/mol
结论:键能越大,分子的稳定性越强。完成课本P50问题解决NO.3课堂习题:
1、已知C—H、C—F、H—F、F—F键
的键能(单位: kJ/mol-1)分别为414、
489、565、158。试据键能数据估算如下
反应的反应热:CH4(g)+4F2(g)==
CF4(g)+4HF(g)答案:4X414+4X158—4X489—4X565
==—1928 kJ/mol-12、已知键能(单位: kJ/mol-1):
P—P:198;P—O:360;O==O:498;
P==O:585。又知P4O10分子的结构为
右图示:计算下列反应热:P4+5O2==P4O10答案:
6X198+5X498—4X585—12X360==—2982 kJ/mol-13、由N2和H2每生成1molNH3放热46KJ,
而每生成1molNH2—NH2却吸热96KJ,
又知H—H键的键能为435 kJ/mol-1,N三N
叁键的键能为941kJ/mol-1。求
(1)N—H键的键能;(答案:390)
(2)N—N单键的键能。(答案:155)本节小结:
1、共价键的键能与化学反应热的关系;
1、计算化学反应热。
作业布置:
1、完成书本P52页--2;
2、完成〈导与学〉相应内容。附录:(下一张) CO分子和N2分子的某些性质 等电子原理:1原子总数相同、价电子总数相同的分子具有
相似的化学键特征,它们的许多性质是相近
的 2.等电子体的判断和利用
判断方法:原子总数相同,价电子总数相同的 分子为 等电子体
运用:利用等电子体的性质相似,空间构型相 同,可运用来预测分子空间的构型和性质
