原子晶体
图片预览






文档简介
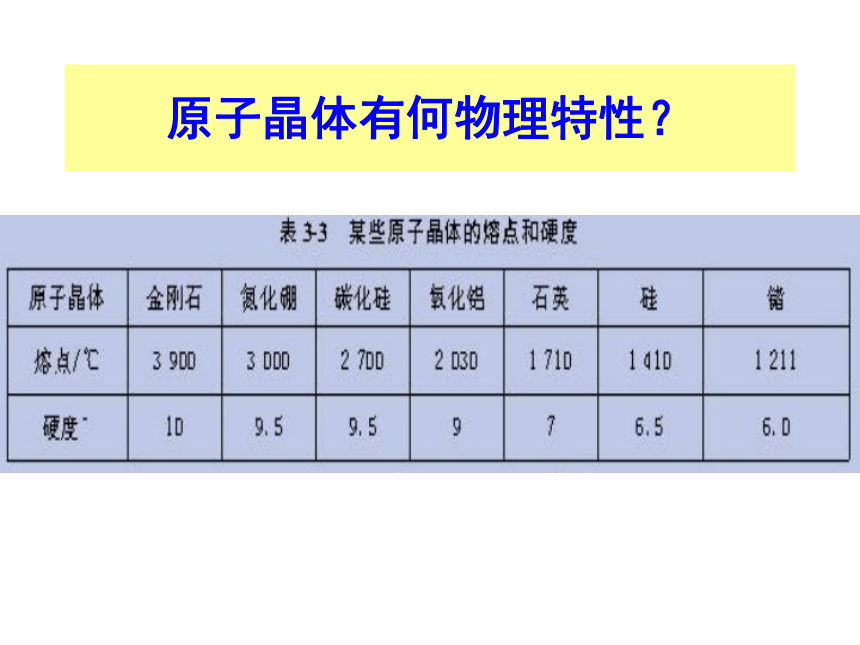
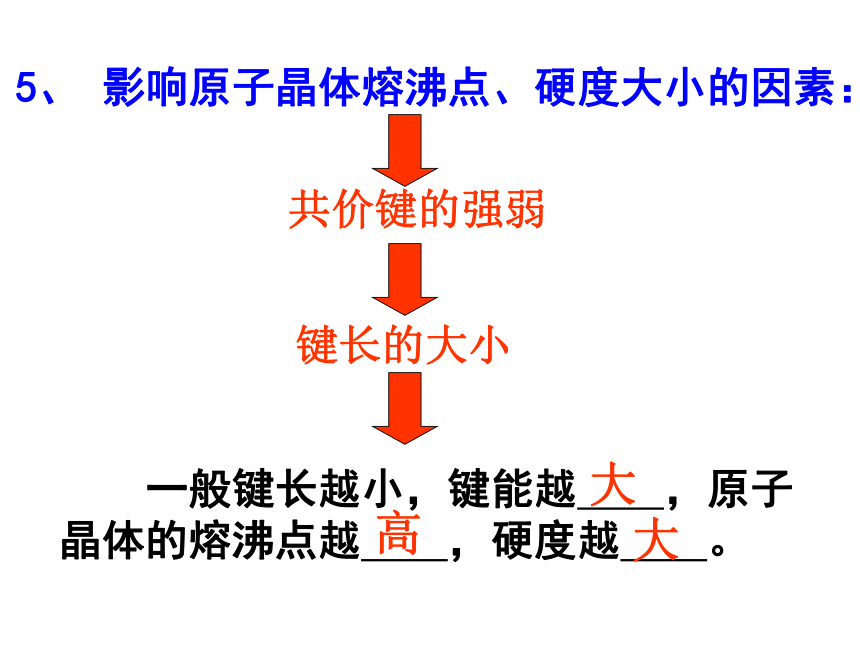
课件38张PPT。第三单元 共价键 原子晶体(第四课时:原子晶体)南靖一中 沈建忠水晶原子晶体一. 原子晶体相邻 间通过 结合而成的具有 结构的晶体.2、组成微粒:3、微粒间作用力:1、定义:共价键空间网状原子原子共价键原子晶体有何物理特性?4、 原子晶体的特点①、晶体中 单个分子存在;化学式只代表 。没 有原子个数之比②、熔、沸点 ;硬度 ; 溶于一般溶剂; 导电。很 高很 大难不问题解决P51页5、 影响原子晶体熔沸点、硬度大小的因素:共价键的强弱键长的大小 一般键长越小,键能越 ,原子晶体的熔沸点越 ,硬度越 。大高大6.常见的原子晶体
某些非金属单质:
金刚石(C)、晶体硅(Si)、
晶体硼(B)、晶体锗(Ge)等
某些非金属化合物:
碳化硅(SiC)晶体、氮化硼(BN)晶体
某些氧化物:
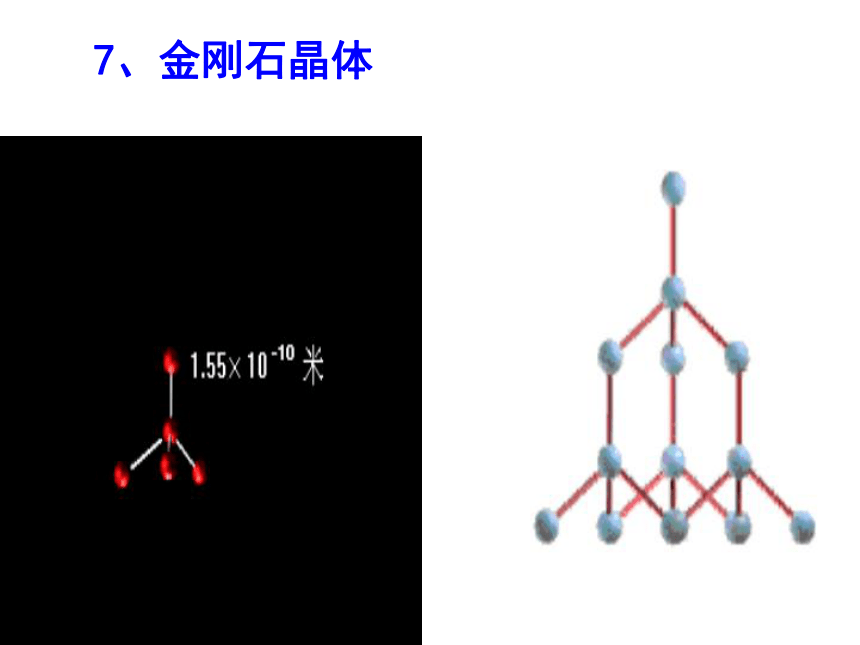
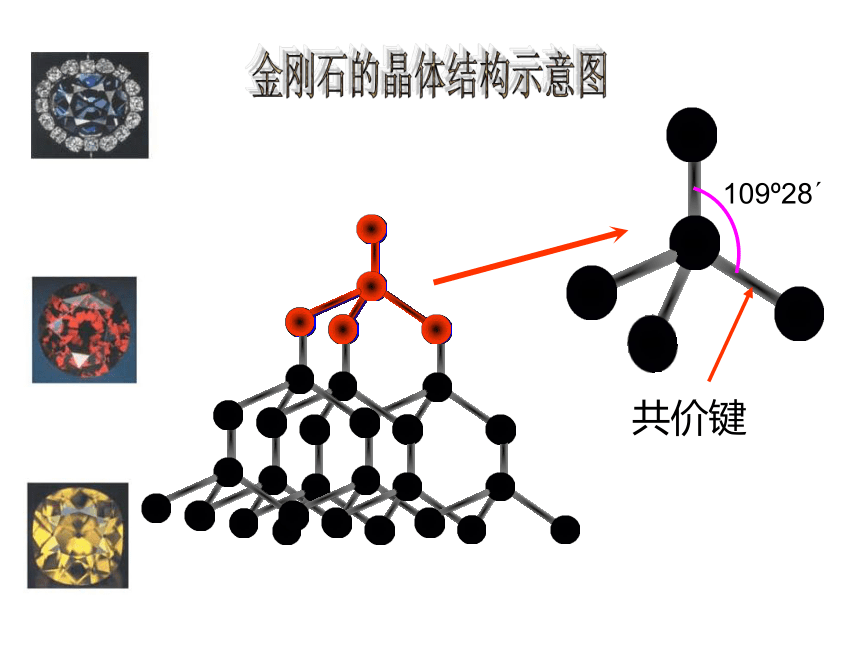
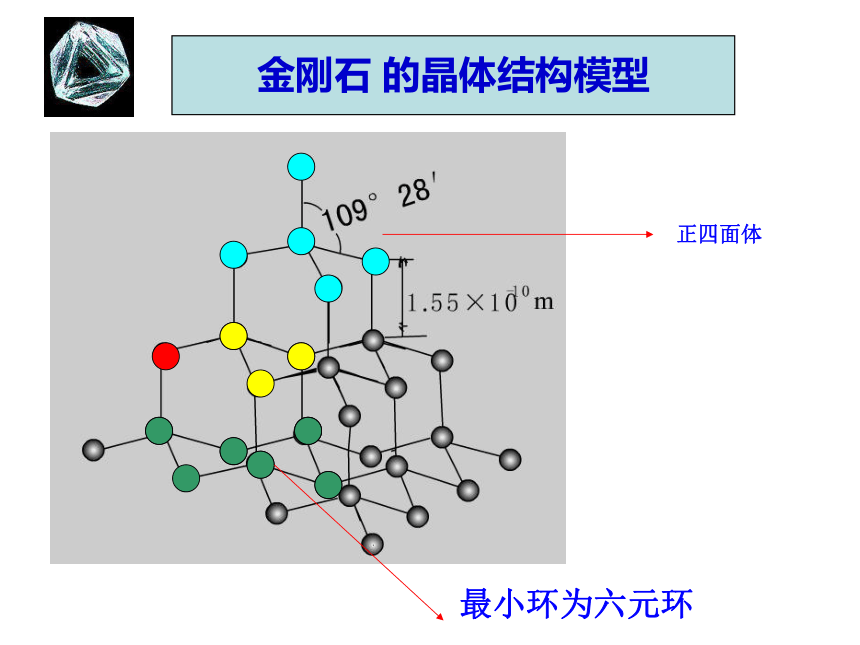
二氧化硅( SiO2)晶体、Al2O37、金刚石晶体金刚石的晶体结构109o28′金刚石的晶体结构示意图共价键正四面体金刚石 的晶体结构模型最小环为六元环基本单元:六元环 个碳原子形成一个 环46六 元②晶体中碳原子与C-C键数目比 。1:2180o109o28′SiO8、二氧化硅的晶体结构示意图共价键在SiO2 晶体中,1个Si原子和4个O原子形成4个共价键,每个Si原子周围结合4个O原子;同时,每个O原子跟2个Si原子相结合。最小环为十二元环。二氧化硅的晶体结构SiO2晶体结构①构成SiO2晶体的微粒是什么?Si原子和O原子②每个Si原子与 个O原子以共价键相结合4每个O原子与 个Si原子以共价键相结合2③晶体中Si原子与O原子个数比为 。 1:2晶体中Si原子与Si-O键数目之比为 。 1:4④晶体中最小的环有 个 原子。12解释:结构相似的原子晶体,原子半径越小,键长越短,键能越大,晶体熔点越高
金刚石 > 碳化硅 > 晶体硅交流与研讨1、怎样从原子结构角度理解金刚石、硅和硅的熔点和硬度依次下降?2、“具有共价键的晶体叫做原子晶体”。这种说法对吗?为什么?比较碳化硅、晶体硅、金刚石晶体的熔点。并说明原因。
同为原子晶体,成键的原子半径越小,键长越短,
键能越大,晶体熔点越高。 键长: C—C < C–Si < Si—Si
键能:C—C > C–Si > Si—Si所以熔点 : 金刚石>SiC>Si小结:三种化学键的比较金属阳离子和自由电子静电作用共用电子对有无无原子半径和价电子数离子半径和离子电荷键长阴阳离子间的静电作用9、石墨的晶体结构模型石墨为什么很软?石墨为层状结构,各层之间是范德华力结合,容易滑动,所以石墨很软。
石墨的熔沸点为什么很高?石墨各层均为平面网状结构,碳原子之间存在很强的共价键,故熔沸点很高。
石墨晶体是层状结构,在每一层内,碳原子排成六边形,每个碳原子都与其他3个碳原子以共价键结合,形成平面的网状结构。在层与层之间,是以分子间作用力相结合的。由于同一层的碳原子间以较强的共价键结合,使石墨的熔点很高。但由于层与层之间的分子间作用力较弱,容易滑动,使石墨的硬度很小。像石墨这样的晶体一般称为过渡型晶体或混合型晶体。 石墨晶体的层状结构,层内为平面正六边形结构(如图),思考下列问题:①图中平均每个正六边形占有C原子数为____个、占有的碳碳键数为____个。23②层内7个六元环完全占有的C原子数为_____个,碳原子数目与碳碳化学键数目之比为_______.142:31、下列物质属于原子晶体的化合物是 ( )
A.金刚石 B.NaOH
C.二氧化硅 D.干冰C课堂习题2、氮化硅(Si3N4)是一种新型的耐高温耐磨材料,在工业上有广泛的应用,它属于 ( )
A.原子晶体 B.分子晶体
C.金属晶体 D.离子晶体A金刚石与石墨的比较仔细观察左边的示意图后,回答下列问题:金刚石与石墨的熔点均很高,那么二者熔点是否相同?为什么?若不相同,哪种更高一些?1.a mol金刚石中,碳碳键数为 mol。
2、二氧化硅晶体结构可以看作金刚石结构中硅代替碳,且在硅与硅之间插入一个氧原子,则30g二氧化硅中含有_____molSi-O2a23.磷在空气中充分燃烧后生成了PmOn分子,其空间结构如图,图中圆圈表示原子,实线表示化学键。请将表示磷原子的圆圈涂黑,分子中如有配位键请标明。由图形推断氧化物的分子式为___________,将分子中的磷原子相连构成__________(填空间构型)P4O10正四面体4.碳单质中的C60是如球状的多面体,该结构的建立基于以下考虑 :(1)C60分子中每个碳原子只跟相邻的3个碳原子形成化学键;(2)C60分子中只含有五边形和六边形;
(3)多面体的顶点数、面数和棱边数的关系遵循欧拉定理:顶点数+面数-棱边数=2。
综上所述,可推知C60分子有12个五边形和20个六边形,相当于C60含有30个双键.
回答:(1)固体C60与金刚石比较,熔点较高者为____,理由 ____.
(2)通过计算C60分子中所含的单键数_____________
(3)C70分子已经制得,它的分子结构模型可以与C60同样考虑推知,通过计算确定C70分子中的五边形数目为______和六边形_____
(1)金刚石熔点高,
因为C60是分子晶体,而金刚石是原子晶体.
(2)60
(3)12个,25个本节小结:
1、原子晶体定义及特点;
2、常见的原子晶体:金刚石、石墨。
作业布置:
1、完成书本P52---9;
2、完成《导与学》本节内容。
某些非金属单质:
金刚石(C)、晶体硅(Si)、
晶体硼(B)、晶体锗(Ge)等
某些非金属化合物:
碳化硅(SiC)晶体、氮化硼(BN)晶体
某些氧化物:
二氧化硅( SiO2)晶体、Al2O37、金刚石晶体金刚石的晶体结构109o28′金刚石的晶体结构示意图共价键正四面体金刚石 的晶体结构模型最小环为六元环基本单元:六元环 个碳原子形成一个 环46六 元②晶体中碳原子与C-C键数目比 。1:2180o109o28′SiO8、二氧化硅的晶体结构示意图共价键在SiO2 晶体中,1个Si原子和4个O原子形成4个共价键,每个Si原子周围结合4个O原子;同时,每个O原子跟2个Si原子相结合。最小环为十二元环。二氧化硅的晶体结构SiO2晶体结构①构成SiO2晶体的微粒是什么?Si原子和O原子②每个Si原子与 个O原子以共价键相结合4每个O原子与 个Si原子以共价键相结合2③晶体中Si原子与O原子个数比为 。 1:2晶体中Si原子与Si-O键数目之比为 。 1:4④晶体中最小的环有 个 原子。12解释:结构相似的原子晶体,原子半径越小,键长越短,键能越大,晶体熔点越高
金刚石 > 碳化硅 > 晶体硅交流与研讨1、怎样从原子结构角度理解金刚石、硅和硅的熔点和硬度依次下降?2、“具有共价键的晶体叫做原子晶体”。这种说法对吗?为什么?比较碳化硅、晶体硅、金刚石晶体的熔点。并说明原因。
同为原子晶体,成键的原子半径越小,键长越短,
键能越大,晶体熔点越高。 键长: C—C < C–Si < Si—Si
键能:C—C > C–Si > Si—Si所以熔点 : 金刚石>SiC>Si小结:三种化学键的比较金属阳离子和自由电子静电作用共用电子对有无无原子半径和价电子数离子半径和离子电荷键长阴阳离子间的静电作用9、石墨的晶体结构模型石墨为什么很软?石墨为层状结构,各层之间是范德华力结合,容易滑动,所以石墨很软。
石墨的熔沸点为什么很高?石墨各层均为平面网状结构,碳原子之间存在很强的共价键,故熔沸点很高。
石墨晶体是层状结构,在每一层内,碳原子排成六边形,每个碳原子都与其他3个碳原子以共价键结合,形成平面的网状结构。在层与层之间,是以分子间作用力相结合的。由于同一层的碳原子间以较强的共价键结合,使石墨的熔点很高。但由于层与层之间的分子间作用力较弱,容易滑动,使石墨的硬度很小。像石墨这样的晶体一般称为过渡型晶体或混合型晶体。 石墨晶体的层状结构,层内为平面正六边形结构(如图),思考下列问题:①图中平均每个正六边形占有C原子数为____个、占有的碳碳键数为____个。23②层内7个六元环完全占有的C原子数为_____个,碳原子数目与碳碳化学键数目之比为_______.142:31、下列物质属于原子晶体的化合物是 ( )
A.金刚石 B.NaOH
C.二氧化硅 D.干冰C课堂习题2、氮化硅(Si3N4)是一种新型的耐高温耐磨材料,在工业上有广泛的应用,它属于 ( )
A.原子晶体 B.分子晶体
C.金属晶体 D.离子晶体A金刚石与石墨的比较仔细观察左边的示意图后,回答下列问题:金刚石与石墨的熔点均很高,那么二者熔点是否相同?为什么?若不相同,哪种更高一些?1.a mol金刚石中,碳碳键数为 mol。
2、二氧化硅晶体结构可以看作金刚石结构中硅代替碳,且在硅与硅之间插入一个氧原子,则30g二氧化硅中含有_____molSi-O2a23.磷在空气中充分燃烧后生成了PmOn分子,其空间结构如图,图中圆圈表示原子,实线表示化学键。请将表示磷原子的圆圈涂黑,分子中如有配位键请标明。由图形推断氧化物的分子式为___________,将分子中的磷原子相连构成__________(填空间构型)P4O10正四面体4.碳单质中的C60是如球状的多面体,该结构的建立基于以下考虑 :(1)C60分子中每个碳原子只跟相邻的3个碳原子形成化学键;(2)C60分子中只含有五边形和六边形;
(3)多面体的顶点数、面数和棱边数的关系遵循欧拉定理:顶点数+面数-棱边数=2。
综上所述,可推知C60分子有12个五边形和20个六边形,相当于C60含有30个双键.
回答:(1)固体C60与金刚石比较,熔点较高者为____,理由 ____.
(2)通过计算C60分子中所含的单键数_____________
(3)C70分子已经制得,它的分子结构模型可以与C60同样考虑推知,通过计算确定C70分子中的五边形数目为______和六边形_____
(1)金刚石熔点高,
因为C60是分子晶体,而金刚石是原子晶体.
(2)60
(3)12个,25个本节小结:
1、原子晶体定义及特点;
2、常见的原子晶体:金刚石、石墨。
作业布置:
1、完成书本P52---9;
2、完成《导与学》本节内容。
