化学变化中的质量关系—化学反应方程式
文档属性
| 名称 | 化学变化中的质量关系—化学反应方程式 |

|
|
| 格式 | rar | ||
| 文件大小 | 31.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2010-03-10 00:00:00 | ||
图片预览


文档简介
化学变化中的质量关系—化学反应方程式
山西 刘福明
一、使用托盘天平的注意事项
1.左物右码。
2.称量干燥的固体药品前,应在两个托盘上各放一张干净、大小相同的纸片,把药品放在纸上称量。
3.易潮解的药品,必须放在玻璃器皿(如小烧杯、表面皿等)里称量。
二、关于质量守恒定律的探究实验
质量守恒定律的探究实验是重要的定量实验之一,它的重点在于探究反应物的质量与生成物的质量关系。我们容易忽略气态或烟雾状物质的质量,如镁条在空气中完全燃烧,容易忽略参加反应的氧气质量,也容易忽略燃烧时包含在白烟中的氧化镁的质量。因此,如果反应物或生成物为气态或烟雾状的物质,要探究反应物的质量与生成物的质量关系,实验装置必须密闭。
三、质量守恒定律及其微观解释
大量实验证明,参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和。在化学反应过程中,各种原子的种类、数目、质量没有改变,因此化学反应前后各物质的质量总和相等。
四、化学方程式的意义
质的方面——表示在一定条件下反应中的反应物和生成物;
量的方面——表示反应的各物质之间的质量关系。即各物质之间的质量比,及反应前后质量守恒等。
基础检测
1.下列有关使用托盘天平的叙述中,不正确的是( )
A.称量前先把游码放在标尺的零刻度处,调节天平至平衡
B.将干燥的药品直接放在天平的托盘上称量
C.称量时左盘放称量物,右盘放砝码
D.称量完毕,把砝码放回砝码盒中
2.某同学用托盘天平称量物质的质量,大致有以下几步:①把称量物放在左盘,砝码放在右盘;②调整零点;③读出砝码和游码的读数后,砝码放回盒中,游码移在零处。其正确的操作顺序是( )
A. ①②③B. ②①③C. ③①②D. ①③②
3.某同学用托盘天平称量固体物质时,把固体物质放在右盘,砝码放在左盘,称得固体物质的质量为10.8 g(1 g以下用游码)。如果按正确的方法称量,这位同学所称固体的实际质量是( )
A. 9.2 gB. 9.8 gC. 10.8 gD. 10.2 g
4.在下列化学反应中,生成的固体物质质量比反应前固体物质质量增大的是( )
A.细铁丝在氧气中燃烧B.木炭燃烧
C.高锰酸钾加热分解D.氧化汞分解
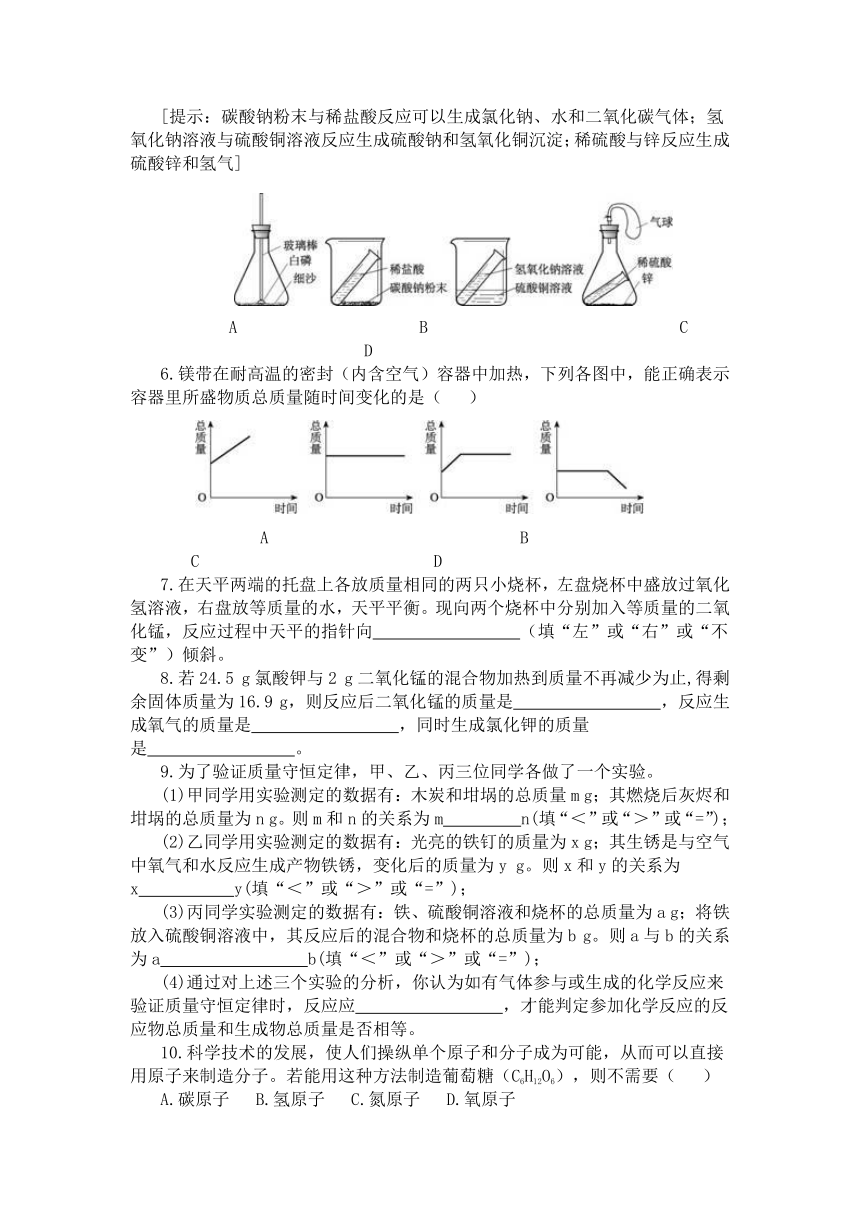
5.在探究质量守恒定律的实验中,小明设计了如下图所示的实验装置,其中在反应前后容器中物质的总质量不相等的是( )
[提示:碳酸钠粉末与稀盐酸反应可以生成氯化钠、水和二氧化碳气体;氢氧化钠溶液与硫酸铜溶液反应生成硫酸钠和氢氧化铜沉淀;稀硫酸与锌反应生成硫酸锌和氢气]
A B C D
6.镁带在耐高温的密封(内含空气)容器中加热,下列各图中,能正确表示容器里所盛物质总质量随时间变化的是( )
A B C D
7.在天平两端的托盘上各放质量相同的两只小烧杯,左盘烧杯中盛放过氧化氢溶液,右盘放等质量的水,天平平衡。现向两个烧杯中分别加入等质量的二氧化锰,反应过程中天平的指针向 (填“左”或“右”或“不变”)倾斜。
8.若24.5 g氯酸钾与2 g二氧化锰的混合物加热到质量不再减少为止,得剩余固体质量为16.9 g,则反应后二氧化锰的质量是 ,反应生成氧气的质量是 ,同时生成氯化钾的质量是 。
9.为了验证质量守恒定律,甲、乙、丙三位同学各做了一个实验。
(1)甲同学用实验测定的数据有:木炭和坩埚的总质量m g;其燃烧后灰烬和坩埚的总质量为n g。则m和n的关系为m n(填“<”或“>”或“=”);
(2)乙同学用实验测定的数据有:光亮的铁钉的质量为x g;其生锈是与空气中氧气和水反应生成产物铁锈,变化后的质量为y g。则x和y的关系为 x y(填“<”或“>”或“=”);
(3)丙同学实验测定的数据有:铁、硫酸铜溶液和烧杯的总质量为a g;将铁放入硫酸铜溶液中,其反应后的混合物和烧杯的总质量为b g。则a与b的关系为a b(填“<”或“>”或“=”);
(4)通过对上述三个实验的分析,你认为如有气体参与或生成的化学反应来验证质量守恒定律时,反应应 ,才能判定参加化学反应的反应物总质量和生成物总质量是否相等。
10.科学技术的发展,使人们操纵单个原子和分子成为可能,从而可以直接用原子来制造分子。若能用这种方法制造葡萄糖(C6H12O6),则不需要( )
A.碳原子 B.氢原子 C.氮原子 D.氧原子
11.
形象地表示反应前反应物分子及其数目,则反应后生成物分子及其数目不可能出现的情况是( )
12.某物质A在氧气中完全燃烧,生成二氧化碳和水,请判断该物质的元素组成情况。
13.下列7个选项:①元素的种类;②原子质量;③分子种类;④物质种类;⑤原子的数目;⑥反应物和生成物的总质量;⑦原子的种类。根据质量守恒定律,化学反应前后没有发生改变的项目有(填序号)。 。
14.通过右图所示反应示意图回答下列问题:
(1)该反应的基本反应类型为 反应;
(2)用分子和原子的观点来解释该化学反应的变化过程。
能力提高
1.下列说法正确的是( )
A.根据质量守恒定律,1 L氢气和1 L氢气和1 L氧气反应能生成2 L水
B.烛完全燃烧后,蜡烛没有了,违背了质量守恒定律
C.有固体、液体间的反应遵守质量守恒定律,如果气体参加,就不遵守了
D.铁丝在氧气中燃烧,生成四氧化三铁的质量等于参加反应的铁丝和氧气的质量之和
2.根据质量守恒定律,3克碳和9克氧气直接生成二氧化碳的质量是( )
A.12克 B.11克 C.44克 D.22克.
3.R在氧气中燃烧的化学方程式为:2R+3O2====2CO2+4H2O,则有关R的组成叙述正确的是( )
A只含有碳、氢元素B一定含有碳、氢元素,可能含有氧元素
C一定含有碳、氢、氧元素D一定含碳、氧元素,可能含有氢元素
4.下列叙述中,错误的是( )
A.化学反应前后,物质的质量总和是一样的
B.元素的种类是一样的
C.各种原子的总数是一样的
D.物质的分子的个数是一样的画龙点睛
5.在A+B===C+D的反应中,5克A物质跟4克B物质恰好完全反应,生成3克C物质和 克D物质,这是根据 定律进行上述计算的。
6.在化学反应2X2+3Y2===2R中,若用X、Y表示R的化学式为 。
7.在A+B==C+D的反应中,A与B的质量比为4:3,当生成物C与D共2.8克时,则参加反应的B的质量是 克。
8.高级汽车中常配置有一种汽车安全气袋,内部贮有硝酸铵(NH4NO3)。当汽车在高速行驶受到猛烈撞击时,硝酸铵迅速分解产生大量的一氧化氮(N2O)气体与另一种氧化物充满气袋。。请给出:
(1)NH4NO3受撞击后发生分解反应的化学方程式是 。
(2)此反应中反应物和生成物中氮元素的化合价从左到右依次为 。
9.黑火药是我国古代四大发明之一,它是由木炭、硫磺、火硝(KNO3)按一定比例混合而成的,爆炸时生成硫化钾(K2S)、氮气和二氧化碳。请写出黑火药爆炸的化学方程式:
10.将A.B.C.三种物质各16 g混合加热,充分反应后混合物中有12 gA、27gC和一定质量的D。若A、B、C、D的相对分子质量分别为1、32、44、18,则该反应的化学方程式可表示为: 。
11.根据质量守恒定律及2Mg+O2===2MgO的反应方程式,下列各组数据正确的是( )
A镁的质量2克,氧气质量3克,氧化镁质量5克
B镁持质量3克,氧气质量2克,氧化镁质量5克
C镁的质量1克,氧气质量4克,氧化镁质量5克
D镁的质量4克,氧气质量1克,氧化镁质量5克
12.在反应2X+Y==2Z中,已知Y的相对分子质量为32,Z的相对分子质量为80,则X的相对分子质量为( )
A.24 B.48 C.64 D.128
13.镁在空气中燃烧反应如下:2Mg+O2====2MgO 3M+N2=== Mg3N2,已知24克镁在纯氧气中燃烧可得40克产物,则24克镁在空气中燃烧可得产物的质量是( )
A等于40克 B.小于40克 C.大于40克 D.无法确定
14.某二价金属13克分别投入等质量的足量的稀硫酸中,生成0.4克氢气,该金属的相对原子质量是( )\
A.13 B.26 C.52 D.65
15.将23克钠、24克镁分别投入等质量的足量的稀硫酸中,充分反应后得到的溶液质量为a克和b克,则a与b的关系是( )
A.a=b B.a<b C.a>b D.无法判断
16.有一种含水的过氧化氢样品10克,在二氧化锰的催化作用下,完全分解得到3.2克氧气,试求该样品中过氧化氢的质量分数。
17.A、B、C三种物质各15 g,在一定条件下充分反应后只生成30 gD。若再向残留物中加入10 gA,继续充分反应后,只有C有剩余,则
(1)第一次反应停止后,残留物中A g,B g,C g;
(2)第二次反应中,消耗A g,消耗B g,剩余C g;
(3)该反应中A、B、C三种物质的质量比为 。
综合评估
1.已知反应3A+2B===3C+2D,生成物C、D的质量比为9:8,若A、B的混合物34 g充分混合后,恰好完全反应,则生成物C的质量是( )
A.8g B.16g C.9g D.18g
2.下列说法正确的是( )
A.根据质量守恒定律,1 L氢气和1 L氧气反应能生成2 L水
B.蜡烛完全燃烧后,蜡烛没有了,着违背了质量守恒定律
C.只有固体、液体间反应遵守质量守恒定律
D.铁氧气中燃烧,生成四氧化三铁质量等于参加反应的铁丝与氧气的质量之和
3.现有化学反应:X+Y==Z,若将a gX和b gY在一定条件下充分反应,生成物Z的质量( )
A.等于(a+b)g B.小于(a+b)g C.大于(a+b)g D.不大于(a+b)g
4.化学反应前后,一定不变的是( )
①分子种类②原子种类③分子数目④原子数目⑤各物质的质量总和
A.①③⑤ B.①②⑤ C.②④⑤ D.②③⑤
5.在反应X+2Y==R+2M中,已知R和M的相对原子质量比为22:9,当1.6 gX与Y完全反应后,生成4.4克R,则在反应中Y与M的质量比为( )
A.12:9 B.23:9 C.32:9 D.16:9
6.已知在一定条件,硫酸铵分解的化学方程式为:3(NH4)2SO4===xNH3↑+SO2↑+N2↑+6H2O,根据质量守恒定律判断上式中x为( )
A.1 B.2 C.3 D.4
7.下列关于化学方程式:2H2+O22H2O的读法中不正确的是( )
A.氢气与氧气在点燃的条件下生成了水
B.每两个氢分子和一个氧分子反应生成两个水分子
C.每四份质量的氢气和32份质量的氧气反应生成36份质量的水
D.两个氢分子加一个氧分子等于两个水分子.
8.已知化学方程式4A+2B2=2AxBy,由此可推知x、y的值为( )
A.4 6 B.2 2 C.2 3 D.3 2
9.现将A、B两种物质各10 g混合加热,A完全反应,生成8 gC和4 gD,则参加反应的A与B的质量比是( )、
A.1:1 B.2:1 C.4:1 D.5:1
10.根据化学方程式:3AB+C2B3==2C+3X,确定X的化学式为( )
A.AB2 B.A3B2 C.A2B3 D.AB3
11.黑火药是我国四大发明之一,黑火药的爆炸可用.2KNO3.+3C+S===K2S.+N2.+3X表示,则X的化学式为( )、
A.CO B.CO2 C.NO D.SO2、
12.在反应3X+4Y==2Z中,已知X的相对分子质量是32,Z的相对分子质量是102,则Y的相对分子质量为( )
A.27 B.70 C.108 D.172
13.等质量的三瓶氧气,分别与氢气、甲烷(CH4+2O2=CO2+2H2O)、碳完全反应,消耗三种物质的质量比为( )
A.1:2:3 B.3:2:1 C.1:4:3 D.1:8:6
14.有A、B、C、D四种物质,它们能发生下列反应:A+B===C+D,已知12克A与14克B物质恰好完全反应,生成18克C和一定量的D,若要获得12克D,需要参加反应的A物质的质量为( )
A.12g B.14g C.18g D.15g
15.1.6g某物质在氧气中完全燃烧,生成4.4g二氧化碳和3.6g水,关于该物质的组成有下列判断:①一定含有C.H元素②一定不含O元素③可能含O元素④一定含O元素⑤分子中C.H原子个数之比为1:2⑥分子中C.H原子个数之比为1:4;正确的是( )
A.①②⑥ B.①②⑤ C.①③⑥ D.①④⑤
16.现有化学反应A+B===C+D,已知A为a克,B为b克,完全反应后生成D为d克,则生成C的质量为 克。
17.12克的碳和32克的氧气恰好完全反应,生成二氧化碳44克,若6克碳在18克氧气中燃烧,可生成二氧化碳 克,剩余 克。
18.某可燃物燃烧后生成的产物中与二氧化碳、二氧化硫和一氧化碳,则该可燃物中一定含有 元素,可能含有 元素。
19.有A、B、C三种物质各4g组成的混合物,在一定条件下,所发生的化学反应表达式为:C+B===A+D,反应后的物质中只有5克A、5克D和若干克B,根据质量守恒定律,可知参加反应的B、C的质量比为 。
20.在托盘天平两边各放一支等质量的烧杯,向两只烧杯中注入等质量等浓度的稀盐酸,天平平衡。向烧杯中加入等质量的Fe、Mg,充分反应后,发现两烧杯中金属均有剩余,则天平指针 偏转(填“向左”或“向右”或“不”)。
山西 刘福明
一、使用托盘天平的注意事项
1.左物右码。
2.称量干燥的固体药品前,应在两个托盘上各放一张干净、大小相同的纸片,把药品放在纸上称量。
3.易潮解的药品,必须放在玻璃器皿(如小烧杯、表面皿等)里称量。
二、关于质量守恒定律的探究实验
质量守恒定律的探究实验是重要的定量实验之一,它的重点在于探究反应物的质量与生成物的质量关系。我们容易忽略气态或烟雾状物质的质量,如镁条在空气中完全燃烧,容易忽略参加反应的氧气质量,也容易忽略燃烧时包含在白烟中的氧化镁的质量。因此,如果反应物或生成物为气态或烟雾状的物质,要探究反应物的质量与生成物的质量关系,实验装置必须密闭。
三、质量守恒定律及其微观解释
大量实验证明,参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和。在化学反应过程中,各种原子的种类、数目、质量没有改变,因此化学反应前后各物质的质量总和相等。
四、化学方程式的意义
质的方面——表示在一定条件下反应中的反应物和生成物;
量的方面——表示反应的各物质之间的质量关系。即各物质之间的质量比,及反应前后质量守恒等。
基础检测
1.下列有关使用托盘天平的叙述中,不正确的是( )
A.称量前先把游码放在标尺的零刻度处,调节天平至平衡
B.将干燥的药品直接放在天平的托盘上称量
C.称量时左盘放称量物,右盘放砝码
D.称量完毕,把砝码放回砝码盒中
2.某同学用托盘天平称量物质的质量,大致有以下几步:①把称量物放在左盘,砝码放在右盘;②调整零点;③读出砝码和游码的读数后,砝码放回盒中,游码移在零处。其正确的操作顺序是( )
A. ①②③B. ②①③C. ③①②D. ①③②
3.某同学用托盘天平称量固体物质时,把固体物质放在右盘,砝码放在左盘,称得固体物质的质量为10.8 g(1 g以下用游码)。如果按正确的方法称量,这位同学所称固体的实际质量是( )
A. 9.2 gB. 9.8 gC. 10.8 gD. 10.2 g
4.在下列化学反应中,生成的固体物质质量比反应前固体物质质量增大的是( )
A.细铁丝在氧气中燃烧B.木炭燃烧
C.高锰酸钾加热分解D.氧化汞分解
5.在探究质量守恒定律的实验中,小明设计了如下图所示的实验装置,其中在反应前后容器中物质的总质量不相等的是( )
[提示:碳酸钠粉末与稀盐酸反应可以生成氯化钠、水和二氧化碳气体;氢氧化钠溶液与硫酸铜溶液反应生成硫酸钠和氢氧化铜沉淀;稀硫酸与锌反应生成硫酸锌和氢气]
A B C D
6.镁带在耐高温的密封(内含空气)容器中加热,下列各图中,能正确表示容器里所盛物质总质量随时间变化的是( )
A B C D
7.在天平两端的托盘上各放质量相同的两只小烧杯,左盘烧杯中盛放过氧化氢溶液,右盘放等质量的水,天平平衡。现向两个烧杯中分别加入等质量的二氧化锰,反应过程中天平的指针向 (填“左”或“右”或“不变”)倾斜。
8.若24.5 g氯酸钾与2 g二氧化锰的混合物加热到质量不再减少为止,得剩余固体质量为16.9 g,则反应后二氧化锰的质量是 ,反应生成氧气的质量是 ,同时生成氯化钾的质量是 。
9.为了验证质量守恒定律,甲、乙、丙三位同学各做了一个实验。
(1)甲同学用实验测定的数据有:木炭和坩埚的总质量m g;其燃烧后灰烬和坩埚的总质量为n g。则m和n的关系为m n(填“<”或“>”或“=”);
(2)乙同学用实验测定的数据有:光亮的铁钉的质量为x g;其生锈是与空气中氧气和水反应生成产物铁锈,变化后的质量为y g。则x和y的关系为 x y(填“<”或“>”或“=”);
(3)丙同学实验测定的数据有:铁、硫酸铜溶液和烧杯的总质量为a g;将铁放入硫酸铜溶液中,其反应后的混合物和烧杯的总质量为b g。则a与b的关系为a b(填“<”或“>”或“=”);
(4)通过对上述三个实验的分析,你认为如有气体参与或生成的化学反应来验证质量守恒定律时,反应应 ,才能判定参加化学反应的反应物总质量和生成物总质量是否相等。
10.科学技术的发展,使人们操纵单个原子和分子成为可能,从而可以直接用原子来制造分子。若能用这种方法制造葡萄糖(C6H12O6),则不需要( )
A.碳原子 B.氢原子 C.氮原子 D.氧原子
11.
形象地表示反应前反应物分子及其数目,则反应后生成物分子及其数目不可能出现的情况是( )
12.某物质A在氧气中完全燃烧,生成二氧化碳和水,请判断该物质的元素组成情况。
13.下列7个选项:①元素的种类;②原子质量;③分子种类;④物质种类;⑤原子的数目;⑥反应物和生成物的总质量;⑦原子的种类。根据质量守恒定律,化学反应前后没有发生改变的项目有(填序号)。 。
14.通过右图所示反应示意图回答下列问题:
(1)该反应的基本反应类型为 反应;
(2)用分子和原子的观点来解释该化学反应的变化过程。
能力提高
1.下列说法正确的是( )
A.根据质量守恒定律,1 L氢气和1 L氢气和1 L氧气反应能生成2 L水
B.烛完全燃烧后,蜡烛没有了,违背了质量守恒定律
C.有固体、液体间的反应遵守质量守恒定律,如果气体参加,就不遵守了
D.铁丝在氧气中燃烧,生成四氧化三铁的质量等于参加反应的铁丝和氧气的质量之和
2.根据质量守恒定律,3克碳和9克氧气直接生成二氧化碳的质量是( )
A.12克 B.11克 C.44克 D.22克.
3.R在氧气中燃烧的化学方程式为:2R+3O2====2CO2+4H2O,则有关R的组成叙述正确的是( )
A只含有碳、氢元素B一定含有碳、氢元素,可能含有氧元素
C一定含有碳、氢、氧元素D一定含碳、氧元素,可能含有氢元素
4.下列叙述中,错误的是( )
A.化学反应前后,物质的质量总和是一样的
B.元素的种类是一样的
C.各种原子的总数是一样的
D.物质的分子的个数是一样的画龙点睛
5.在A+B===C+D的反应中,5克A物质跟4克B物质恰好完全反应,生成3克C物质和 克D物质,这是根据 定律进行上述计算的。
6.在化学反应2X2+3Y2===2R中,若用X、Y表示R的化学式为 。
7.在A+B==C+D的反应中,A与B的质量比为4:3,当生成物C与D共2.8克时,则参加反应的B的质量是 克。
8.高级汽车中常配置有一种汽车安全气袋,内部贮有硝酸铵(NH4NO3)。当汽车在高速行驶受到猛烈撞击时,硝酸铵迅速分解产生大量的一氧化氮(N2O)气体与另一种氧化物充满气袋。。请给出:
(1)NH4NO3受撞击后发生分解反应的化学方程式是 。
(2)此反应中反应物和生成物中氮元素的化合价从左到右依次为 。
9.黑火药是我国古代四大发明之一,它是由木炭、硫磺、火硝(KNO3)按一定比例混合而成的,爆炸时生成硫化钾(K2S)、氮气和二氧化碳。请写出黑火药爆炸的化学方程式:
10.将A.B.C.三种物质各16 g混合加热,充分反应后混合物中有12 gA、27gC和一定质量的D。若A、B、C、D的相对分子质量分别为1、32、44、18,则该反应的化学方程式可表示为: 。
11.根据质量守恒定律及2Mg+O2===2MgO的反应方程式,下列各组数据正确的是( )
A镁的质量2克,氧气质量3克,氧化镁质量5克
B镁持质量3克,氧气质量2克,氧化镁质量5克
C镁的质量1克,氧气质量4克,氧化镁质量5克
D镁的质量4克,氧气质量1克,氧化镁质量5克
12.在反应2X+Y==2Z中,已知Y的相对分子质量为32,Z的相对分子质量为80,则X的相对分子质量为( )
A.24 B.48 C.64 D.128
13.镁在空气中燃烧反应如下:2Mg+O2====2MgO 3M+N2=== Mg3N2,已知24克镁在纯氧气中燃烧可得40克产物,则24克镁在空气中燃烧可得产物的质量是( )
A等于40克 B.小于40克 C.大于40克 D.无法确定
14.某二价金属13克分别投入等质量的足量的稀硫酸中,生成0.4克氢气,该金属的相对原子质量是( )\
A.13 B.26 C.52 D.65
15.将23克钠、24克镁分别投入等质量的足量的稀硫酸中,充分反应后得到的溶液质量为a克和b克,则a与b的关系是( )
A.a=b B.a<b C.a>b D.无法判断
16.有一种含水的过氧化氢样品10克,在二氧化锰的催化作用下,完全分解得到3.2克氧气,试求该样品中过氧化氢的质量分数。
17.A、B、C三种物质各15 g,在一定条件下充分反应后只生成30 gD。若再向残留物中加入10 gA,继续充分反应后,只有C有剩余,则
(1)第一次反应停止后,残留物中A g,B g,C g;
(2)第二次反应中,消耗A g,消耗B g,剩余C g;
(3)该反应中A、B、C三种物质的质量比为 。
综合评估
1.已知反应3A+2B===3C+2D,生成物C、D的质量比为9:8,若A、B的混合物34 g充分混合后,恰好完全反应,则生成物C的质量是( )
A.8g B.16g C.9g D.18g
2.下列说法正确的是( )
A.根据质量守恒定律,1 L氢气和1 L氧气反应能生成2 L水
B.蜡烛完全燃烧后,蜡烛没有了,着违背了质量守恒定律
C.只有固体、液体间反应遵守质量守恒定律
D.铁氧气中燃烧,生成四氧化三铁质量等于参加反应的铁丝与氧气的质量之和
3.现有化学反应:X+Y==Z,若将a gX和b gY在一定条件下充分反应,生成物Z的质量( )
A.等于(a+b)g B.小于(a+b)g C.大于(a+b)g D.不大于(a+b)g
4.化学反应前后,一定不变的是( )
①分子种类②原子种类③分子数目④原子数目⑤各物质的质量总和
A.①③⑤ B.①②⑤ C.②④⑤ D.②③⑤
5.在反应X+2Y==R+2M中,已知R和M的相对原子质量比为22:9,当1.6 gX与Y完全反应后,生成4.4克R,则在反应中Y与M的质量比为( )
A.12:9 B.23:9 C.32:9 D.16:9
6.已知在一定条件,硫酸铵分解的化学方程式为:3(NH4)2SO4===xNH3↑+SO2↑+N2↑+6H2O,根据质量守恒定律判断上式中x为( )
A.1 B.2 C.3 D.4
7.下列关于化学方程式:2H2+O22H2O的读法中不正确的是( )
A.氢气与氧气在点燃的条件下生成了水
B.每两个氢分子和一个氧分子反应生成两个水分子
C.每四份质量的氢气和32份质量的氧气反应生成36份质量的水
D.两个氢分子加一个氧分子等于两个水分子.
8.已知化学方程式4A+2B2=2AxBy,由此可推知x、y的值为( )
A.4 6 B.2 2 C.2 3 D.3 2
9.现将A、B两种物质各10 g混合加热,A完全反应,生成8 gC和4 gD,则参加反应的A与B的质量比是( )、
A.1:1 B.2:1 C.4:1 D.5:1
10.根据化学方程式:3AB+C2B3==2C+3X,确定X的化学式为( )
A.AB2 B.A3B2 C.A2B3 D.AB3
11.黑火药是我国四大发明之一,黑火药的爆炸可用.2KNO3.+3C+S===K2S.+N2.+3X表示,则X的化学式为( )、
A.CO B.CO2 C.NO D.SO2、
12.在反应3X+4Y==2Z中,已知X的相对分子质量是32,Z的相对分子质量是102,则Y的相对分子质量为( )
A.27 B.70 C.108 D.172
13.等质量的三瓶氧气,分别与氢气、甲烷(CH4+2O2=CO2+2H2O)、碳完全反应,消耗三种物质的质量比为( )
A.1:2:3 B.3:2:1 C.1:4:3 D.1:8:6
14.有A、B、C、D四种物质,它们能发生下列反应:A+B===C+D,已知12克A与14克B物质恰好完全反应,生成18克C和一定量的D,若要获得12克D,需要参加反应的A物质的质量为( )
A.12g B.14g C.18g D.15g
15.1.6g某物质在氧气中完全燃烧,生成4.4g二氧化碳和3.6g水,关于该物质的组成有下列判断:①一定含有C.H元素②一定不含O元素③可能含O元素④一定含O元素⑤分子中C.H原子个数之比为1:2⑥分子中C.H原子个数之比为1:4;正确的是( )
A.①②⑥ B.①②⑤ C.①③⑥ D.①④⑤
16.现有化学反应A+B===C+D,已知A为a克,B为b克,完全反应后生成D为d克,则生成C的质量为 克。
17.12克的碳和32克的氧气恰好完全反应,生成二氧化碳44克,若6克碳在18克氧气中燃烧,可生成二氧化碳 克,剩余 克。
18.某可燃物燃烧后生成的产物中与二氧化碳、二氧化硫和一氧化碳,则该可燃物中一定含有 元素,可能含有 元素。
19.有A、B、C三种物质各4g组成的混合物,在一定条件下,所发生的化学反应表达式为:C+B===A+D,反应后的物质中只有5克A、5克D和若干克B,根据质量守恒定律,可知参加反应的B、C的质量比为 。
20.在托盘天平两边各放一支等质量的烧杯,向两只烧杯中注入等质量等浓度的稀盐酸,天平平衡。向烧杯中加入等质量的Fe、Mg,充分反应后,发现两烧杯中金属均有剩余,则天平指针 偏转(填“向左”或“向右”或“不”)。
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
