核外电子排布
图片预览



文档简介
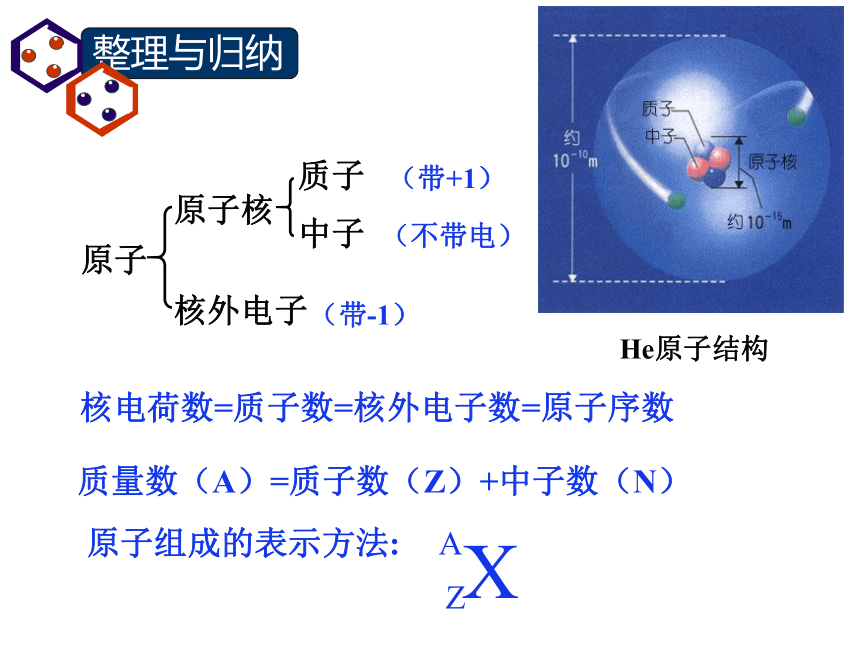
课件12张PPT。原子核外电子排布原子He原子结构核电荷数=质子数=核外电子数=原子序数质量数(A)=质子数(Z)+中子数(N)可以准确地测出它们在某一时刻
所处的位置及运行的速度;
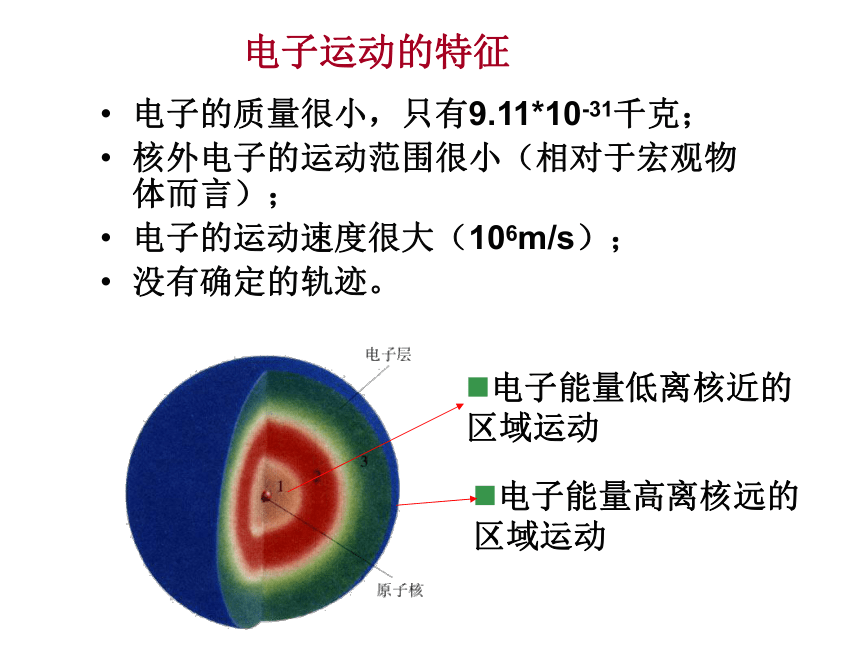
可以描画它们的运动轨迹。宏观物体的运动特征:电子的质量很小,只有9.11*10-31千克;
核外电子的运动范围很小(相对于宏观物体而言);
电子的运动速度很大(106m/s);
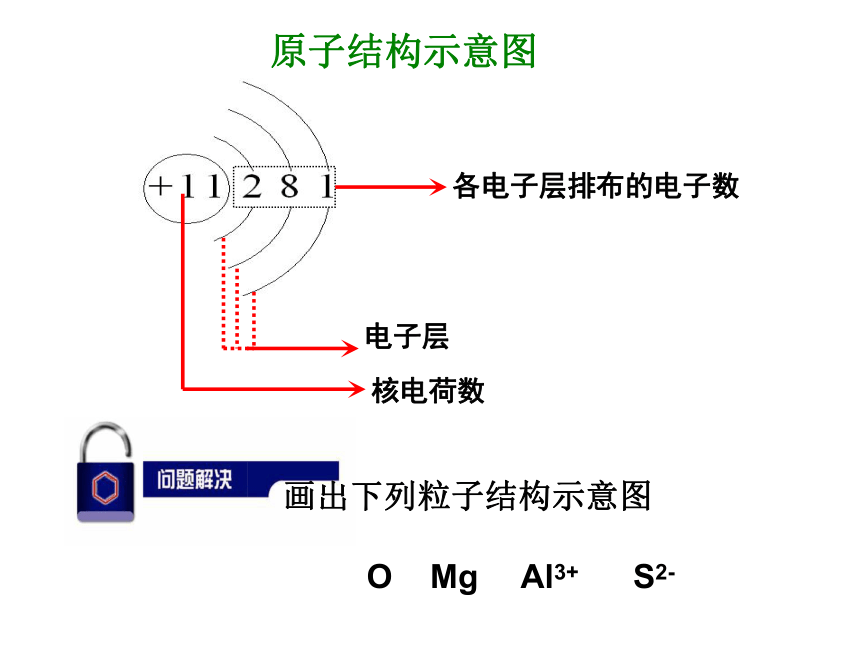
没有确定的轨迹。电子运动的特征各电子层排布的电子数电子层核电荷数原子结构示意图观察图1-2中18种原子的原子结构示意图,分析核外电子分层排布的规律。1、电子层的表示方法 K L M N O P QK最外层电子数=次外层电子数:
最外层电子数=2倍次外层电子数:
最外层电子数=1/2倍次外层电子数:
电子层数=最外层电子数:
电子总数=2倍的最外层电子数:
内层电子总数=2倍的最外层电子数:Be、ArCLi、SiH、Be、AlBeLi、P2、已知ABCD四种元素的质子数都小于18,它
们的核电荷数A﹤ B﹤C﹤D;A与B可生成化合物AB2,每个AB2分子中有22 个电子,B元素原子的最外层电子数为次外层电子数的3倍;C元素原子的次外层电子数为最外层电子数2倍,D元素原子的最外层电子数比次外层少1个。
(1)则各元素名称分别为A、B、C、D(2)C与B形成化合物的化学式。C与D形成化合物的化学式。3.常见10电子和18电子的微粒一核10电子二核10电子三核10电子四核10电子五核10电子NeHFH2ONH3CH4N3- O2- F- Na+ Mg2+ Al3+OH-NH2-H3O+NH4+一核18电子二核18电子三核18电子ArF2 HClH2SK+ Ca2+ Cl- S2-HS-
所处的位置及运行的速度;
可以描画它们的运动轨迹。宏观物体的运动特征:电子的质量很小,只有9.11*10-31千克;
核外电子的运动范围很小(相对于宏观物体而言);
电子的运动速度很大(106m/s);
没有确定的轨迹。电子运动的特征各电子层排布的电子数电子层核电荷数原子结构示意图观察图1-2中18种原子的原子结构示意图,分析核外电子分层排布的规律。1、电子层的表示方法 K L M N O P QK
最外层电子数=2倍次外层电子数:
最外层电子数=1/2倍次外层电子数:
电子层数=最外层电子数:
电子总数=2倍的最外层电子数:
内层电子总数=2倍的最外层电子数:Be、ArCLi、SiH、Be、AlBeLi、P2、已知ABCD四种元素的质子数都小于18,它
们的核电荷数A﹤ B﹤C﹤D;A与B可生成化合物AB2,每个AB2分子中有22 个电子,B元素原子的最外层电子数为次外层电子数的3倍;C元素原子的次外层电子数为最外层电子数2倍,D元素原子的最外层电子数比次外层少1个。
(1)则各元素名称分别为A、B、C、D(2)C与B形成化合物的化学式。C与D形成化合物的化学式。3.常见10电子和18电子的微粒一核10电子二核10电子三核10电子四核10电子五核10电子NeHFH2ONH3CH4N3- O2- F- Na+ Mg2+ Al3+OH-NH2-H3O+NH4+一核18电子二核18电子三核18电子ArF2 HClH2SK+ Ca2+ Cl- S2-HS-
