氨气
图片预览










文档简介
课件33张PPT。
氮肥的生产和使用 1800年没有使用化肥时,每公顷耕地生产0.73吨粮食1978年开始使用化肥后,每公顷耕地生产4.63吨粮食 如果不施化肥,中国只能养活2亿多人口,剩下11亿人就没饭吃。 (NH4)2SO4NH4NO3NH4HCO3NH4ClCO(NH2)2 铵态氮肥有机氮肥波施 分别获得1918年和1932年诺贝尔化学奖天才还是魔鬼?哈伯(F.Haber 1868—1934)他因为攻克氨的合
成这一世界难题,
将无数人从饥饿的
死亡线上拯救出来;
他也因发明大量化
学武器并用于战争,
使无数人伤残致死;
他是诺贝尔化学奖
得主受人尊敬,他也
是战争魔鬼遭人唾骂?2006年7月27日下午,南通市如东县经济开发区一工厂突然发生氨气泄漏事故,整个厂区是白茫茫的一片,方圆数百米,空气中弥漫着一股浓烈的刺激性气味,进入厂区呼吸都感到困难。厂区内寒气逼人,严重威胁着附近居民安全,当地消防部门接到报警后火速出动,紧急将周围群众疏散到安全位置,并果断处置,成功排除险情,避免了严重后果的发生。 新闻追踪一液氨泄漏之后
……
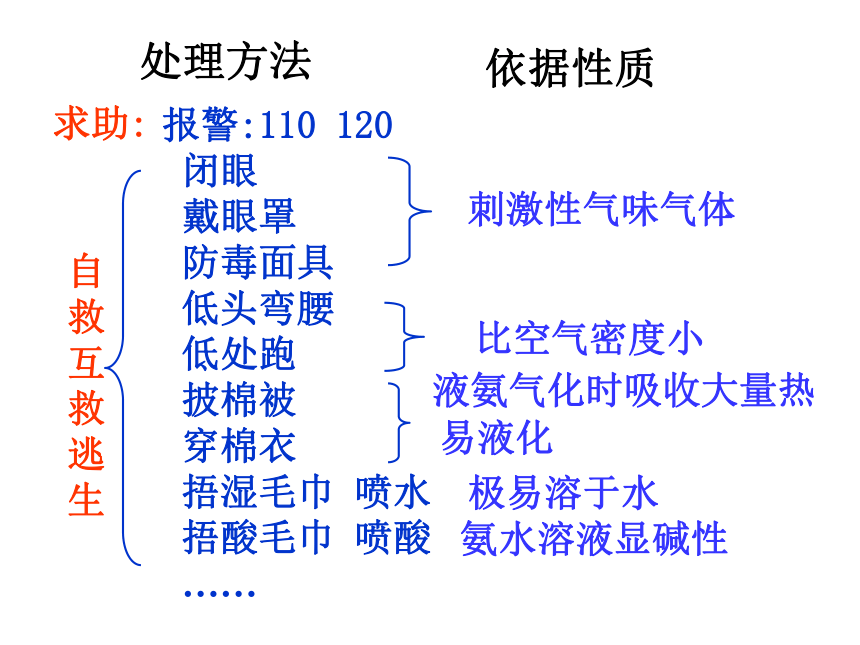
求助:
自救
互救
逃生 刺激性气味气体 液氨气化时吸收大量热极易溶于水 比空气密度小易液化氨水溶液显碱性依据性质
报警:110 120
闭眼
戴眼罩
防毒面具
低头弯腰
低处跑
披棉被
穿棉衣
捂湿毛巾 喷水
捂酸毛巾 喷酸
……处理方法 氨气的物理性质无色,有刺激性气味气体密度比空气小;用向上排空气法收集极易溶于水(1∶700);
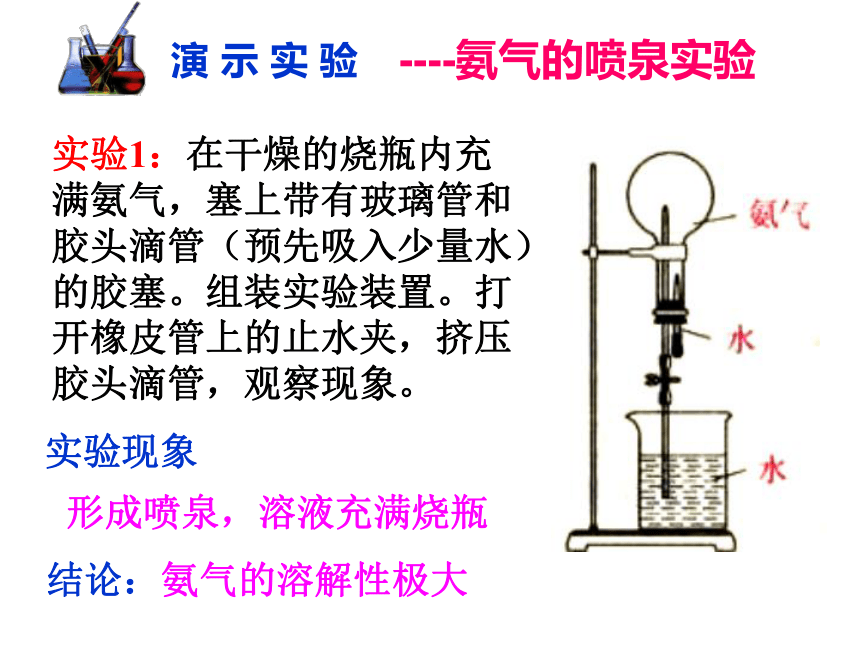
易液化(液氨)——作制冷剂实验1:在干燥的烧瓶内充满氨气,塞上带有玻璃管和胶头滴管(预先吸入少量水)的胶塞。组装实验装置。打开橡皮管上的止水夹,挤压胶头滴管,观察现象。实验现象形成喷泉,溶液充满烧瓶结论:氨气的溶解性极大----氨气的喷泉实验 演 示 实 验----氨气的喷泉实验 演 示 实 验(2)溶液为什么变为红色? (3)实验成败的关键是什么? (1)氨为什么会形成喷泉? a.烧瓶干燥;
b.装置的气密性好;
c.收集的气体纯度尽可能高。氨气溶于水溶液显碱性。 氨极易溶于水,使烧瓶内外形成较大的压差;城市中常见的人造喷泉及火山爆发的原理与上述的原理相似吗?喷泉实验小结:实验2
在一支洁净的试管中滴加几滴氨水,将湿润的红色石蕊试纸(或PH试纸)粘在玻璃棒上靠近试管口,观察试纸颜色的变化情况。实验现象: 试纸变蓝
结论 :氨水显碱性----氨气与水的反应 演 示 实 验3.化学性质(1)氨跟水的反应 NH3·H2O NH3 NH4+ H2O OH- H+③氨水保存:①分析氨水的成份:②氨水的密度:比水小,浓度越大,密度越小密封,保存在阴凉处— NH3是碱性气体不稳定:液氨和氨水的比较氨气液化氨气溶于水纯净物混合物只有NH3分子不导电、不显碱性能导电、具有弱碱性、不稳定、易挥发比较与讨论实验3
在一只烧杯中放两个棉花球,分别在两个棉花球上滴加几滴浓氨水和浓盐酸,用表面皿盖住烧杯口,观察现象。实验现象: 产生白烟 结论: 氨水具有挥发性,与挥发性酸发生反应 演 示 实 验氨与氯化氢反应 (2)氨跟酸的反应NH3+HCl = NH4Cl2NH3+H2SO4 = (NH4)2SO4NH3+HNO3 = NH4NO3本质: NH3+H+=NH4+ ( 常用硫酸作为氨气的吸收剂) (3)氨跟氧气反应----催化氧化(接触氧化) 2NH3+3Cl2 == N2+6HCl (氨不足)8NH3+3Cl2 == N2+6NH4Cl (氨充足)(4) 氨与其它非金属反应氨的催化氧化------工业制硝酸的基础1、利用右图装置下列组合不能形成明显喷泉是 2.质量百分含量为25%的氨水用等体积的水稀释后,所得溶液的溶质质量分数( )
A、等于12.5%
B、大于12.5%
C、小于12.5%
D、无法确定C实验现象 :实验结论 :实验操作 :试管底部固体减少,在试管中上部有白色固体出现。并可闻到刺激性气味。演示实验4铵盐不稳定,受热易分解二、铵盐的性质(1)易溶解:均为易溶于水的白色晶体。(2)受热易分解:晶体受热易分解,不一定产生NH3NH3 + HCl == NH4Cl实验现象 :实验操作 :湿润的红色石蕊试纸变蓝,并可闻到刺激性气味。 演示实验5(3)易碱解:和碱在加热的条件下,
发生复分解反应,产生NH3 。 NH4+的检验:湿润的红色石蕊试纸蘸有浓盐酸的玻棒不和碱性肥料一起使用
在干燥阴凉的地方储存三、氨的实验室制法(1)原料:NH4Cl和Ca(OH)2固体(7)尾气处理:装水的洗气瓶吸收NH3(3)制取装置:固固加热装置(4)收集装置:向下排空气法(5)干燥剂: 碱石灰、CaO固体(6)检验:a:湿润的石蕊试纸变蓝b:遇浓盐酸产生大量的白烟例1、实验室里若用如图所示装置制取氨气,试用表格形式列出图中装置的错误之处,并用文字简要说明如何改正试管a管口向上倾斜应略向下倾斜试管夹的位置不对应夹在离管口1/3处试管b管口向上应向下试管b塞上橡皮塞把橡皮塞改为棉花团反应物没加热用酒精灯加热1.有关氨的说法不正确的是 ( )
A、 NH3是4核10电子的分子,具有还原性
B、 NH3极易溶于水,可做喷泉实验,液氨可用作制冷剂
C、氨气是非电解质,氨水是电解质
D、蘸有浓盐酸的玻璃棒遇氨气可产生白烟 C课堂练习2.在1L1mol/L的氨水中 ( )
A、含有1molNH3分子
B、含NH3和NH4+之和为1mol
C、含NH3·H2O 1mol
D、含NH3、NH4+、NH3·H2O 之和为
1mol D(原子守恒) 课堂练习3、大气压对许多物理实验和化学实验有着重要影响。制取氨气并完成喷泉实验(夹持装置均已略去)。
(1)写出实验室制取氨气的化学方程式:______________________________
(2)收集氨气应使用______ 法,
要得到干燥的氨气可选用
_______ 做干燥剂。
向下排空气 碱石灰(3)用图1装置进行喷泉实验,上部烧瓶已装满干燥氨气,引发水上喷的操作是_____________________________________。
该实验的原理是___________________________________。
(4)如果只提供图2的装置,
请说明引发喷泉的方法。
打开止水夹,挤出胶头滴管中的水。 氨气极易溶解于水,致使烧瓶内气体压强迅速减小。 打开夹子,用手(或热毛巾等)将烧瓶捂热,氢气受热膨胀,赶出玻璃导管内的空气,氨气与水接触,即发生喷泉。
氮肥的生产和使用 1800年没有使用化肥时,每公顷耕地生产0.73吨粮食1978年开始使用化肥后,每公顷耕地生产4.63吨粮食 如果不施化肥,中国只能养活2亿多人口,剩下11亿人就没饭吃。 (NH4)2SO4NH4NO3NH4HCO3NH4ClCO(NH2)2 铵态氮肥有机氮肥波施 分别获得1918年和1932年诺贝尔化学奖天才还是魔鬼?哈伯(F.Haber 1868—1934)他因为攻克氨的合
成这一世界难题,
将无数人从饥饿的
死亡线上拯救出来;
他也因发明大量化
学武器并用于战争,
使无数人伤残致死;
他是诺贝尔化学奖
得主受人尊敬,他也
是战争魔鬼遭人唾骂?2006年7月27日下午,南通市如东县经济开发区一工厂突然发生氨气泄漏事故,整个厂区是白茫茫的一片,方圆数百米,空气中弥漫着一股浓烈的刺激性气味,进入厂区呼吸都感到困难。厂区内寒气逼人,严重威胁着附近居民安全,当地消防部门接到报警后火速出动,紧急将周围群众疏散到安全位置,并果断处置,成功排除险情,避免了严重后果的发生。 新闻追踪一液氨泄漏之后
……
求助:
自救
互救
逃生 刺激性气味气体 液氨气化时吸收大量热极易溶于水 比空气密度小易液化氨水溶液显碱性依据性质
报警:110 120
闭眼
戴眼罩
防毒面具
低头弯腰
低处跑
披棉被
穿棉衣
捂湿毛巾 喷水
捂酸毛巾 喷酸
……处理方法 氨气的物理性质无色,有刺激性气味气体密度比空气小;用向上排空气法收集极易溶于水(1∶700);
易液化(液氨)——作制冷剂实验1:在干燥的烧瓶内充满氨气,塞上带有玻璃管和胶头滴管(预先吸入少量水)的胶塞。组装实验装置。打开橡皮管上的止水夹,挤压胶头滴管,观察现象。实验现象形成喷泉,溶液充满烧瓶结论:氨气的溶解性极大----氨气的喷泉实验 演 示 实 验----氨气的喷泉实验 演 示 实 验(2)溶液为什么变为红色? (3)实验成败的关键是什么? (1)氨为什么会形成喷泉? a.烧瓶干燥;
b.装置的气密性好;
c.收集的气体纯度尽可能高。氨气溶于水溶液显碱性。 氨极易溶于水,使烧瓶内外形成较大的压差;城市中常见的人造喷泉及火山爆发的原理与上述的原理相似吗?喷泉实验小结:实验2
在一支洁净的试管中滴加几滴氨水,将湿润的红色石蕊试纸(或PH试纸)粘在玻璃棒上靠近试管口,观察试纸颜色的变化情况。实验现象: 试纸变蓝
结论 :氨水显碱性----氨气与水的反应 演 示 实 验3.化学性质(1)氨跟水的反应 NH3·H2O NH3 NH4+ H2O OH- H+③氨水保存:①分析氨水的成份:②氨水的密度:比水小,浓度越大,密度越小密封,保存在阴凉处— NH3是碱性气体不稳定:液氨和氨水的比较氨气液化氨气溶于水纯净物混合物只有NH3分子不导电、不显碱性能导电、具有弱碱性、不稳定、易挥发比较与讨论实验3
在一只烧杯中放两个棉花球,分别在两个棉花球上滴加几滴浓氨水和浓盐酸,用表面皿盖住烧杯口,观察现象。实验现象: 产生白烟 结论: 氨水具有挥发性,与挥发性酸发生反应 演 示 实 验氨与氯化氢反应 (2)氨跟酸的反应NH3+HCl = NH4Cl2NH3+H2SO4 = (NH4)2SO4NH3+HNO3 = NH4NO3本质: NH3+H+=NH4+ ( 常用硫酸作为氨气的吸收剂) (3)氨跟氧气反应----催化氧化(接触氧化) 2NH3+3Cl2 == N2+6HCl (氨不足)8NH3+3Cl2 == N2+6NH4Cl (氨充足)(4) 氨与其它非金属反应氨的催化氧化------工业制硝酸的基础1、利用右图装置下列组合不能形成明显喷泉是 2.质量百分含量为25%的氨水用等体积的水稀释后,所得溶液的溶质质量分数( )
A、等于12.5%
B、大于12.5%
C、小于12.5%
D、无法确定C实验现象 :实验结论 :实验操作 :试管底部固体减少,在试管中上部有白色固体出现。并可闻到刺激性气味。演示实验4铵盐不稳定,受热易分解二、铵盐的性质(1)易溶解:均为易溶于水的白色晶体。(2)受热易分解:晶体受热易分解,不一定产生NH3NH3 + HCl == NH4Cl实验现象 :实验操作 :湿润的红色石蕊试纸变蓝,并可闻到刺激性气味。 演示实验5(3)易碱解:和碱在加热的条件下,
发生复分解反应,产生NH3 。 NH4+的检验:湿润的红色石蕊试纸蘸有浓盐酸的玻棒不和碱性肥料一起使用
在干燥阴凉的地方储存三、氨的实验室制法(1)原料:NH4Cl和Ca(OH)2固体(7)尾气处理:装水的洗气瓶吸收NH3(3)制取装置:固固加热装置(4)收集装置:向下排空气法(5)干燥剂: 碱石灰、CaO固体(6)检验:a:湿润的石蕊试纸变蓝b:遇浓盐酸产生大量的白烟例1、实验室里若用如图所示装置制取氨气,试用表格形式列出图中装置的错误之处,并用文字简要说明如何改正试管a管口向上倾斜应略向下倾斜试管夹的位置不对应夹在离管口1/3处试管b管口向上应向下试管b塞上橡皮塞把橡皮塞改为棉花团反应物没加热用酒精灯加热1.有关氨的说法不正确的是 ( )
A、 NH3是4核10电子的分子,具有还原性
B、 NH3极易溶于水,可做喷泉实验,液氨可用作制冷剂
C、氨气是非电解质,氨水是电解质
D、蘸有浓盐酸的玻璃棒遇氨气可产生白烟 C课堂练习2.在1L1mol/L的氨水中 ( )
A、含有1molNH3分子
B、含NH3和NH4+之和为1mol
C、含NH3·H2O 1mol
D、含NH3、NH4+、NH3·H2O 之和为
1mol D(原子守恒) 课堂练习3、大气压对许多物理实验和化学实验有着重要影响。制取氨气并完成喷泉实验(夹持装置均已略去)。
(1)写出实验室制取氨气的化学方程式:______________________________
(2)收集氨气应使用______ 法,
要得到干燥的氨气可选用
_______ 做干燥剂。
向下排空气 碱石灰(3)用图1装置进行喷泉实验,上部烧瓶已装满干燥氨气,引发水上喷的操作是_____________________________________。
该实验的原理是___________________________________。
(4)如果只提供图2的装置,
请说明引发喷泉的方法。
打开止水夹,挤出胶头滴管中的水。 氨气极易溶解于水,致使烧瓶内气体压强迅速减小。 打开夹子,用手(或热毛巾等)将烧瓶捂热,氢气受热膨胀,赶出玻璃导管内的空气,氨气与水接触,即发生喷泉。
