周期律
图片预览



文档简介
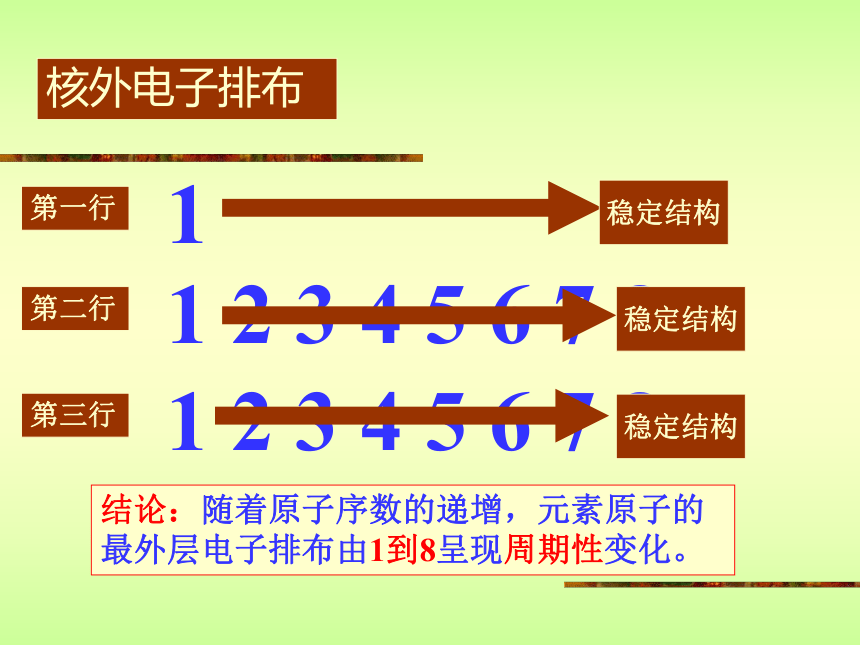
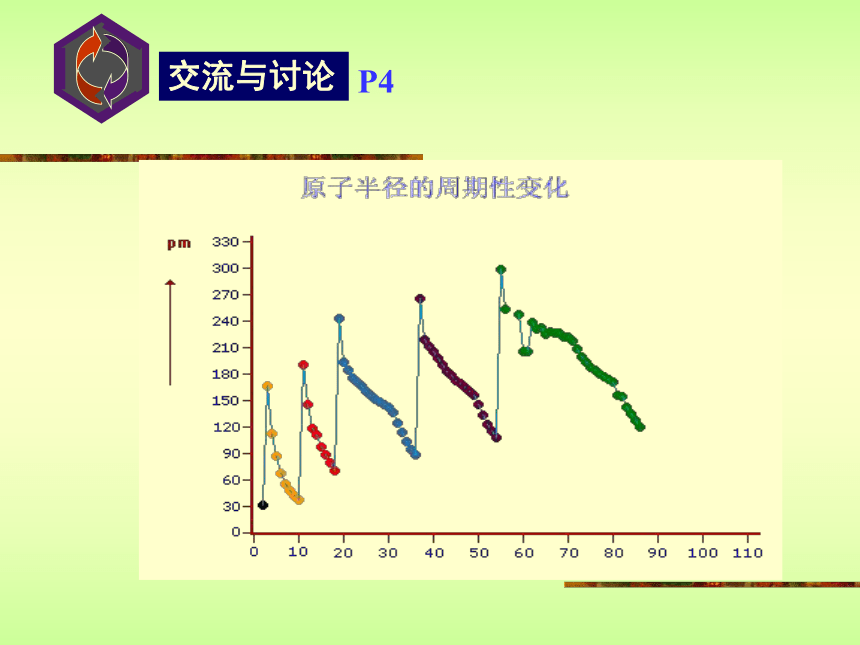
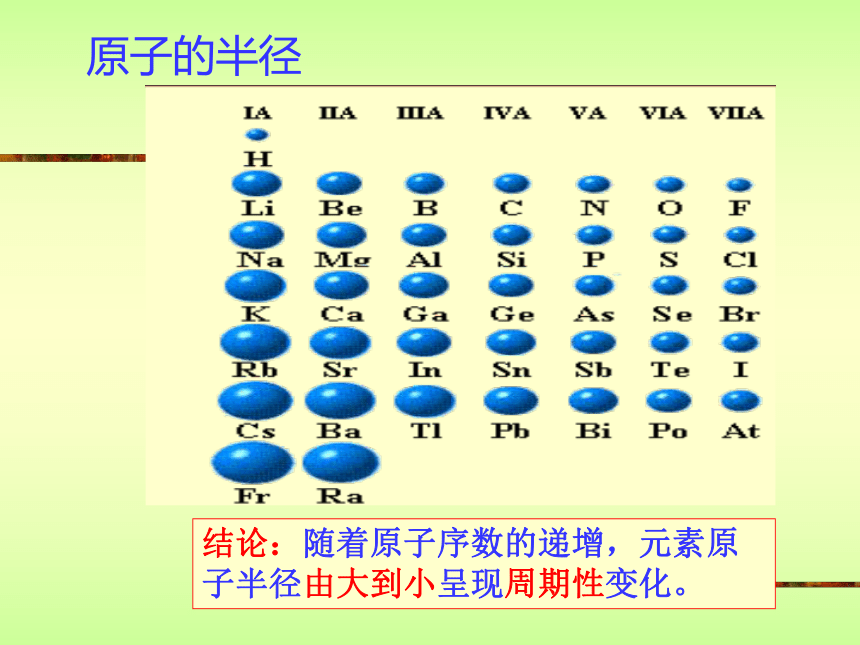
课件13张PPT。元素周期律1 2 3 4 5 6 7 8核外电子排布第一行121 2 3 4 5 6 7 8第二行第三行稳定结构稳定结构稳定结构结论:随着原子序数的递增,元素原子的最外层电子排布由1到8呈现周期性变化。 P4原子的半径结论:随着原子序数的递增,元素原子半径由大到小呈现周期性变化。元素主要化合价结论:随着原子序数的递增,元素主要化合价(正价由+1到+7;负价由-4到-1)呈现周期性变化。?最高正价?+ ?最低负价?=8 F元素无正价,O最高+2价 最高正价=最外层电子数小结:随着原子序数的递增原子半径元素的主要化合价(大?小)(正价:+1?+7)元素原子核外电子排布(最外层电子1?8)(负价:-4?-1)元素周期律的实质:元素原子核外电子排布的周期性变化。门捷列夫的第一张周期表元素周期律的发现者 ——门捷列夫元素周期律是化学元素的第一个科学分类法门捷列夫依据元素周期律大胆指出了当时某些元素相对原子质量的测定是不准确的门捷列夫依据元素周期律还大胆预言了当时尚未发现的11种元素门捷列夫—化学之父恩格斯高度评价:
门捷列夫完成了科学
史上的一个勋业。【练习】1、在下列元素中,原子半径最小的是( )?
A.N B.F C.Mg D.Cl?2.在下列元素中,最高正化合价数值最大的是( )?A.Na B.P C.Cl D.Ar3.原子序数从3~9的元素,随着核电荷数的递增而逐渐增大的是( )?
A.电子层数 B.电子数 C.原子半径 D.化合价BCB5、某元素的最高价氧化物为R2O5,则其气态氢化物
化学式为____________。RH36、某非金属元素的最高价氧化物水化物为HnRO2n,则R元素的最低负价为___________,其气态氢化物的分子式为______________________。-(8 - 3n)H8-3nR 或 RH8-3n4.元素X原子的最外层有3个电子,元素Y原子的最外层有6个电子,这两种元素形成的化合物的化学式可能是( )?
A.XY2 B.X2Y3 C.X3Y2 D.X2YB再见
门捷列夫完成了科学
史上的一个勋业。【练习】1、在下列元素中,原子半径最小的是( )?
A.N B.F C.Mg D.Cl?2.在下列元素中,最高正化合价数值最大的是( )?A.Na B.P C.Cl D.Ar3.原子序数从3~9的元素,随着核电荷数的递增而逐渐增大的是( )?
A.电子层数 B.电子数 C.原子半径 D.化合价BCB5、某元素的最高价氧化物为R2O5,则其气态氢化物
化学式为____________。RH36、某非金属元素的最高价氧化物水化物为HnRO2n,则R元素的最低负价为___________,其气态氢化物的分子式为______________________。-(8 - 3n)H8-3nR 或 RH8-3n4.元素X原子的最外层有3个电子,元素Y原子的最外层有6个电子,这两种元素形成的化合物的化学式可能是( )?
A.XY2 B.X2Y3 C.X3Y2 D.X2YB再见
