微粒之间的相互作用力
图片预览






文档简介
课件22张PPT。第二单元 微粒之间的相互作用力你知道吗?构成物质的微粒有 、 、 等
金刚石由 构成
食盐由 和 构成
干冰由 构成分子原子离子碳原子钠离子氯离子二氧化碳分子想一想:不同的物质含有不同的微粒,
这些微粒是如何彼此结合而构成物质
的?1、氯化钠和氯化镁是由阴、阳离子构成的,离子间存在强烈的相互作用;2、干冰是由许多二氧化碳分子构成的,分子中碳原子与氧原子间存在着强烈的相互作用;3、金刚石是由许多碳原子彼此结合形成的空间网状晶体,在晶体中,直接相邻的碳原子间存在强烈的相互作用。 从上述讨论中,我们可以看到,由原子结合成分子时,或由离子构成化合物时,原子或离子之间存在着强烈的相互作用,这种强烈的相互作用存在于直接相邻的原子或离子之间。通常我们把物质中直接相邻的原子或离子之间存在的强烈的相互作用叫做化学键。化学键一、化学键物质中直接相邻的原子或离子之间存在的强烈的相互作用
注: 1、直接相邻
2、强烈的相互作用
3、化学键的分类:a、离子键 b、共价键 c、金属键二、离子键 知识目标2. 会正确书写原子、简单离子和常见离子
化合物的电子式; 3. 能认识用电子式表示离子化合物的形成
过程。 理解离子键的概念;通过分析初步懂得
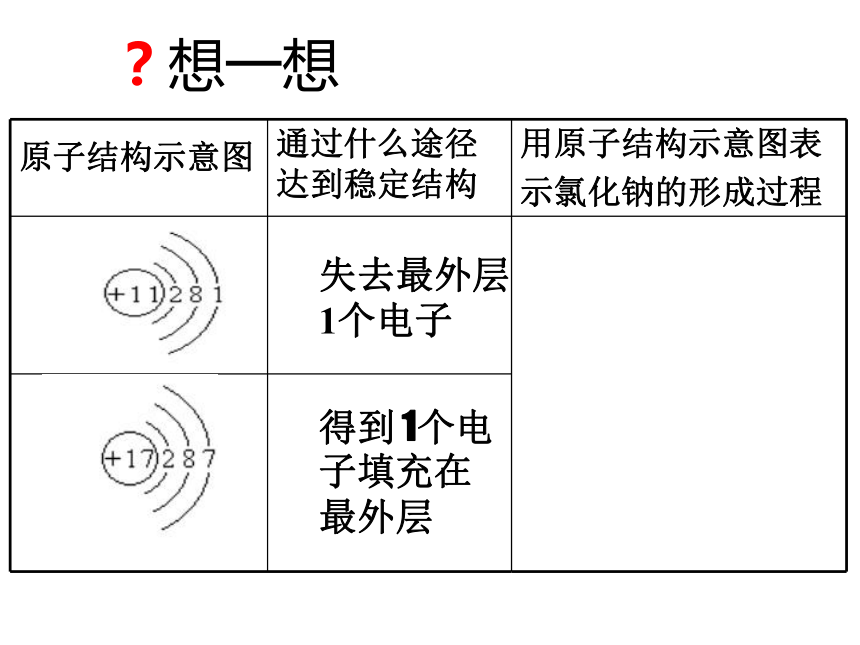
离子键的成键特点和成键规律; 回顾实验:钠在氯气中燃烧 ?想一想失去最外层1个电子
得到 1个电子填充在最外层
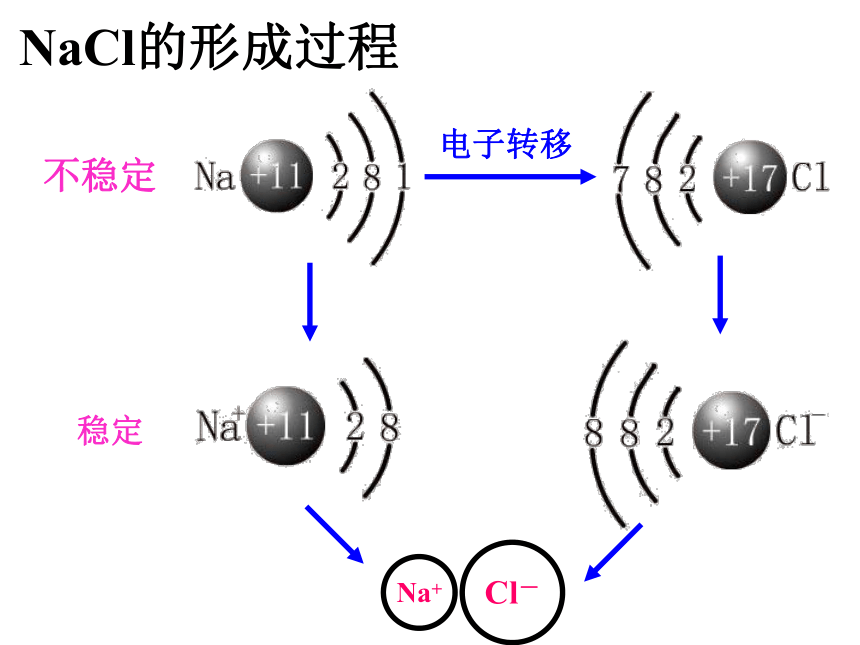
电子转移不稳定稳定NaCl的形成过程思考在氯化钠晶体中,Na+和Cl- 间存在哪些力? Na+离子和Cl-离子间的静电相互吸引作用不可能!因阴阳离子接近到某一定距离时,吸引
和排斥作用达到平衡,阴阳离子间形成稳定的化
学键。阴阳离子结合在一起,彼此电荷是否会抵消呢? 阴阳离子间、电子与电子、原子核与原子核间的相互排斥作用1、定义: 使带相反电荷的阴阳离子结合的相与作用,做为离子键。成键微粒:阴阳离子相互作用:静电作用(静电引力和斥力)成键过程:阴阳离子接近到某一定距离时,吸引和排斥达到平衡,就形成了离子键。含有离子键的化合物就是离子化合物。二、离子键思考 哪些物质能形成离子键? 活泼的金属元素(IA,IIA)和活泼的非金属
元素(VIA,VIIA)之间的化合物。 活泼的金属元素和酸根离子形成的盐 铵根离子和酸根离子(或活泼非金属元素离子)形成的盐。2、电子式 在元素符号周围用“ · ”或“×”来表示原子最外层电子的式子,叫电子式。H ·Na · ·Mg · ·Ca · 原子的电子式: 离子的电子式:H+Na+Mg2+Ca2+[ O ]2- : :(1)原子的电子式:常把其最外层电子数用小黑点“.”或小叉“×”来表示。(2)阳离子的电子式:不要求画出离子最外层电子数,只要在元素、符号右上角标出“n+”电荷字样。(3)阴离子的电子式:不但要画出最外层电子数,而且还应用于括号“[ ]”括起来,并在右上角标出“n·-”电荷字样。电子式1、写出下列微粒的电子式:
(1)氟原子,(2)溴原子,(3)硫原子, (4)氧原子,(5)氮原子,(6)磷原子, (7)硅原子,(7)钙原子,(8)铝原子2、写出下列微粒的电子式:
(1)氟离子,(2)溴离子,(3)硫离子, (4)氧离子,(5)氮离子,(6)磷离子, (7)硅离子,(7)钙离子,(8)铝离子[ 练习]3、请根据离子化合物的定义,判断下列哪些化合物属于离子化合物? NaCl MgO CO2 CaF2 NH3 NO2随堂练习4、下列不是离子化合物的是( )
A.H2O B.CaBr2
C. KOH D.NaNO3
5、下列各数值表示有关元素的原子序数,其所表示的各原子间能以离子键形成稳定化合物的是( )
A.10与19 B.6与16
C.14与8 D.11与17 AD
6、下列微粒电子式错误的是( )
7、下列化合物电子式书写正确的是( )
?
BD离子化合物的电子式:AB型AB2型A2B型NaClNa2SNa2OMgCl2注:阴、阳离子的电子式相间写,相同离子不能合并。用 电子式 表示 离子化合物 的 形成过程 用电子式表示氯化钠的形成过程 用电子式表示溴化钙的形成过程 同学们:再见!
金刚石由 构成
食盐由 和 构成
干冰由 构成分子原子离子碳原子钠离子氯离子二氧化碳分子想一想:不同的物质含有不同的微粒,
这些微粒是如何彼此结合而构成物质
的?1、氯化钠和氯化镁是由阴、阳离子构成的,离子间存在强烈的相互作用;2、干冰是由许多二氧化碳分子构成的,分子中碳原子与氧原子间存在着强烈的相互作用;3、金刚石是由许多碳原子彼此结合形成的空间网状晶体,在晶体中,直接相邻的碳原子间存在强烈的相互作用。 从上述讨论中,我们可以看到,由原子结合成分子时,或由离子构成化合物时,原子或离子之间存在着强烈的相互作用,这种强烈的相互作用存在于直接相邻的原子或离子之间。通常我们把物质中直接相邻的原子或离子之间存在的强烈的相互作用叫做化学键。化学键一、化学键物质中直接相邻的原子或离子之间存在的强烈的相互作用
注: 1、直接相邻
2、强烈的相互作用
3、化学键的分类:a、离子键 b、共价键 c、金属键二、离子键 知识目标2. 会正确书写原子、简单离子和常见离子
化合物的电子式; 3. 能认识用电子式表示离子化合物的形成
过程。 理解离子键的概念;通过分析初步懂得
离子键的成键特点和成键规律; 回顾实验:钠在氯气中燃烧 ?想一想失去最外层1个电子
得到 1个电子填充在最外层
电子转移不稳定稳定NaCl的形成过程思考在氯化钠晶体中,Na+和Cl- 间存在哪些力? Na+离子和Cl-离子间的静电相互吸引作用不可能!因阴阳离子接近到某一定距离时,吸引
和排斥作用达到平衡,阴阳离子间形成稳定的化
学键。阴阳离子结合在一起,彼此电荷是否会抵消呢? 阴阳离子间、电子与电子、原子核与原子核间的相互排斥作用1、定义: 使带相反电荷的阴阳离子结合的相与作用,做为离子键。成键微粒:阴阳离子相互作用:静电作用(静电引力和斥力)成键过程:阴阳离子接近到某一定距离时,吸引和排斥达到平衡,就形成了离子键。含有离子键的化合物就是离子化合物。二、离子键思考 哪些物质能形成离子键? 活泼的金属元素(IA,IIA)和活泼的非金属
元素(VIA,VIIA)之间的化合物。 活泼的金属元素和酸根离子形成的盐 铵根离子和酸根离子(或活泼非金属元素离子)形成的盐。2、电子式 在元素符号周围用“ · ”或“×”来表示原子最外层电子的式子,叫电子式。H ·Na · ·Mg · ·Ca · 原子的电子式: 离子的电子式:H+Na+Mg2+Ca2+[ O ]2- : :(1)原子的电子式:常把其最外层电子数用小黑点“.”或小叉“×”来表示。(2)阳离子的电子式:不要求画出离子最外层电子数,只要在元素、符号右上角标出“n+”电荷字样。(3)阴离子的电子式:不但要画出最外层电子数,而且还应用于括号“[ ]”括起来,并在右上角标出“n·-”电荷字样。电子式1、写出下列微粒的电子式:
(1)氟原子,(2)溴原子,(3)硫原子, (4)氧原子,(5)氮原子,(6)磷原子, (7)硅原子,(7)钙原子,(8)铝原子2、写出下列微粒的电子式:
(1)氟离子,(2)溴离子,(3)硫离子, (4)氧离子,(5)氮离子,(6)磷离子, (7)硅离子,(7)钙离子,(8)铝离子[ 练习]3、请根据离子化合物的定义,判断下列哪些化合物属于离子化合物? NaCl MgO CO2 CaF2 NH3 NO2随堂练习4、下列不是离子化合物的是( )
A.H2O B.CaBr2
C. KOH D.NaNO3
5、下列各数值表示有关元素的原子序数,其所表示的各原子间能以离子键形成稳定化合物的是( )
A.10与19 B.6与16
C.14与8 D.11与17 AD
6、下列微粒电子式错误的是( )
7、下列化合物电子式书写正确的是( )
?
BD离子化合物的电子式:AB型AB2型A2B型NaClNa2SNa2OMgCl2注:阴、阳离子的电子式相间写,相同离子不能合并。用 电子式 表示 离子化合物 的 形成过程 用电子式表示氯化钠的形成过程 用电子式表示溴化钙的形成过程 同学们:再见!
