共价键模型第一课时课件
图片预览




文档简介
课件33张PPT。第二章 化学键与分子间作用力第1节 共价键模型【回顾】回忆化学必修课程中有关化学
键的知识,回答以下几个问题:(1)化学键的定义及基本分类
(2)离子键、共价键的定义
(3)离子化合物、共价化合物的定义一.共价键形成和本质
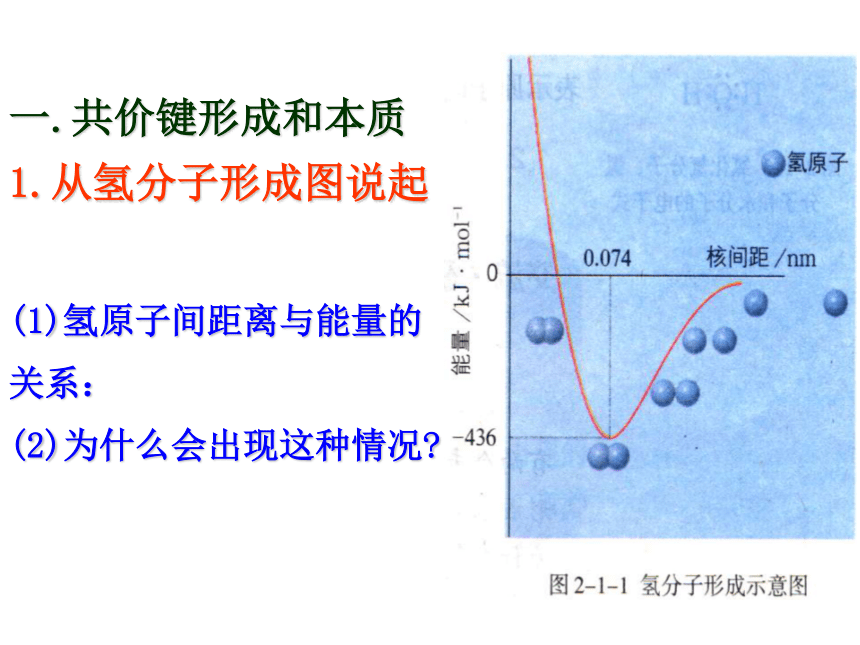
1.从氢分子形成图说起(1)氢原子间距离与能量的
关系:
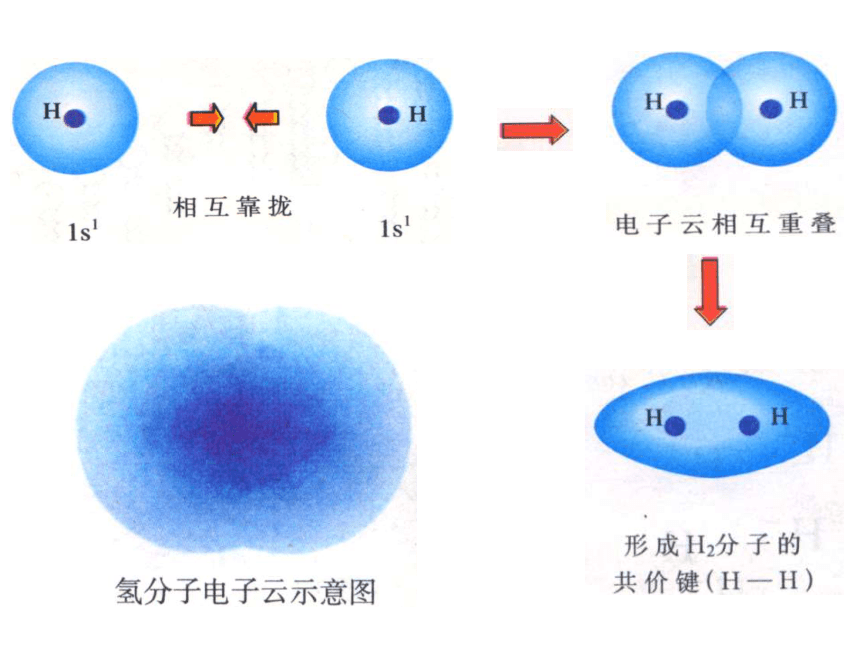
(2)为什么会出现这种情况?2.共价键的本质:
高概率地出现在两个原子核间的电子与
两个原子核之间的电性作用是共价键的本质.
如:H2 是H原子间1s电子
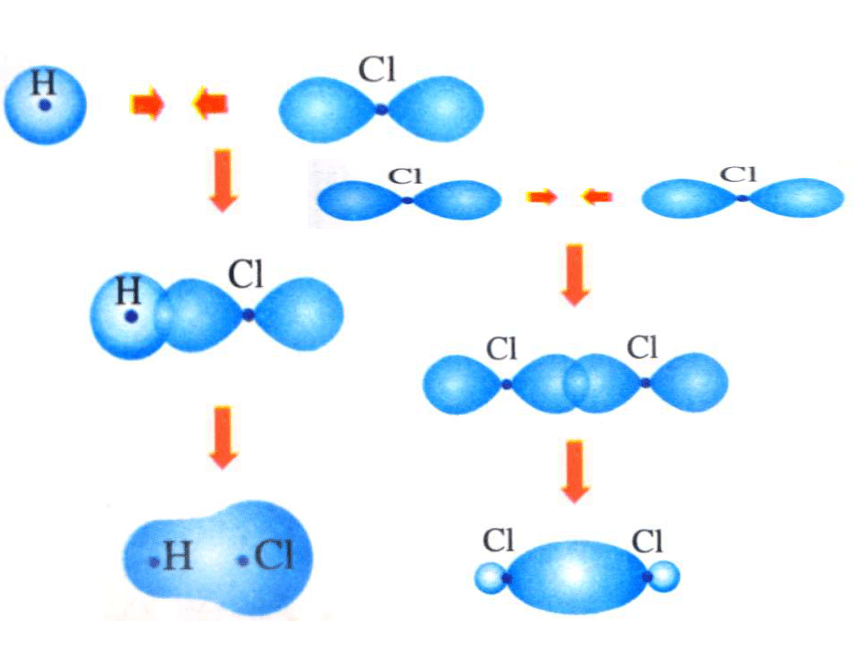
HCl是H的1s电子与Cl的3p电子
Cl2 是两个Cl原子3p轨道上的一个电子。1.通常电负性相同或差值小的非金属元素原子形成的化学键;
2.成键原子一般有未成对电子,用来相互配对成键(自旋反向);
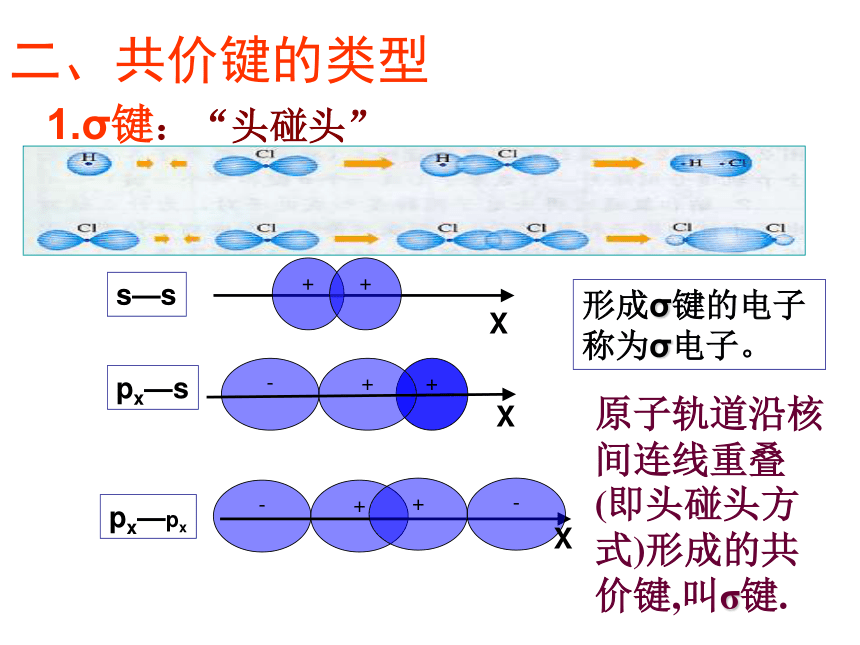
3.成键原子的原子轨道在空间重叠使体系能量降低。3.共价键的形成条件 1.σ键:“头碰头”X++s—sX+px—sXpx—px形成σ键的电子
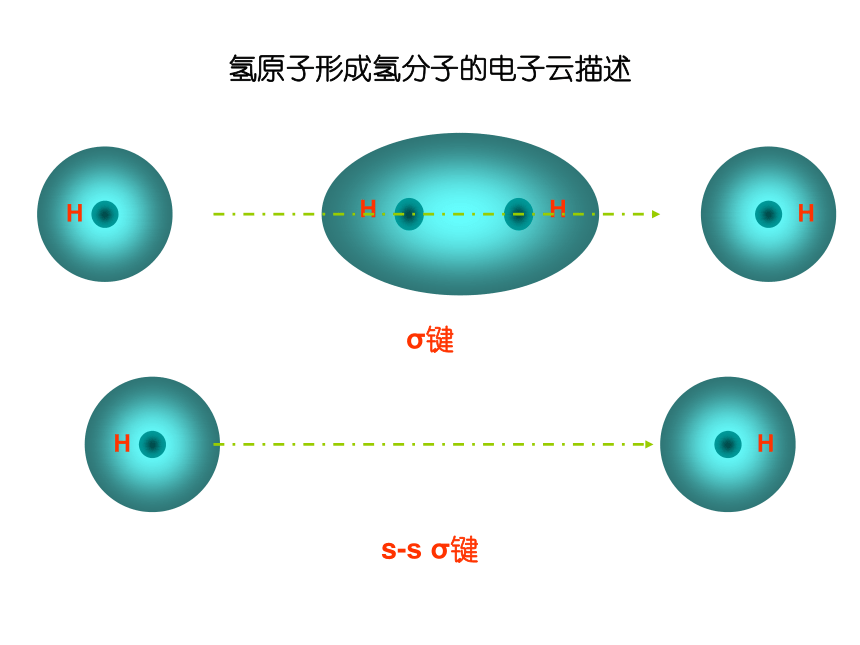
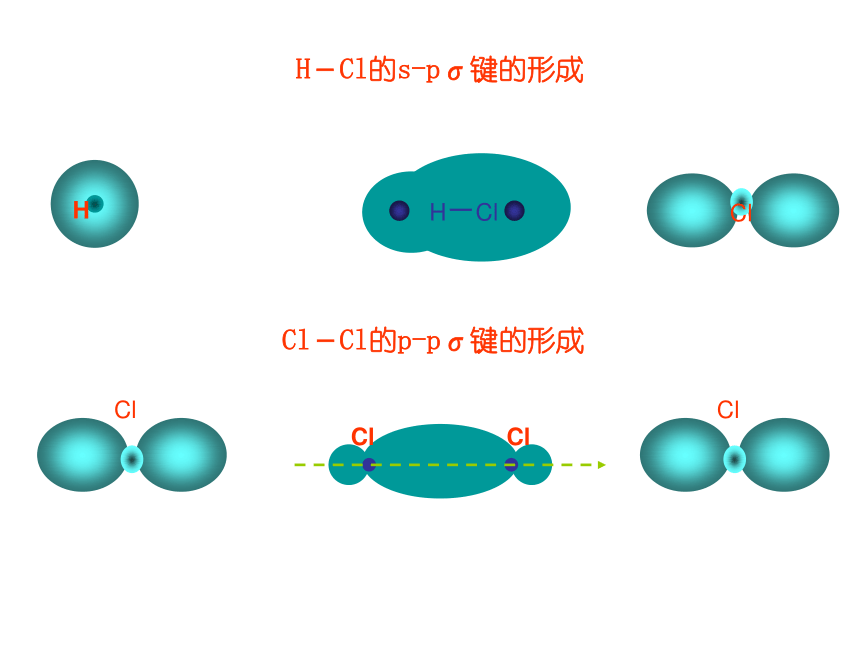
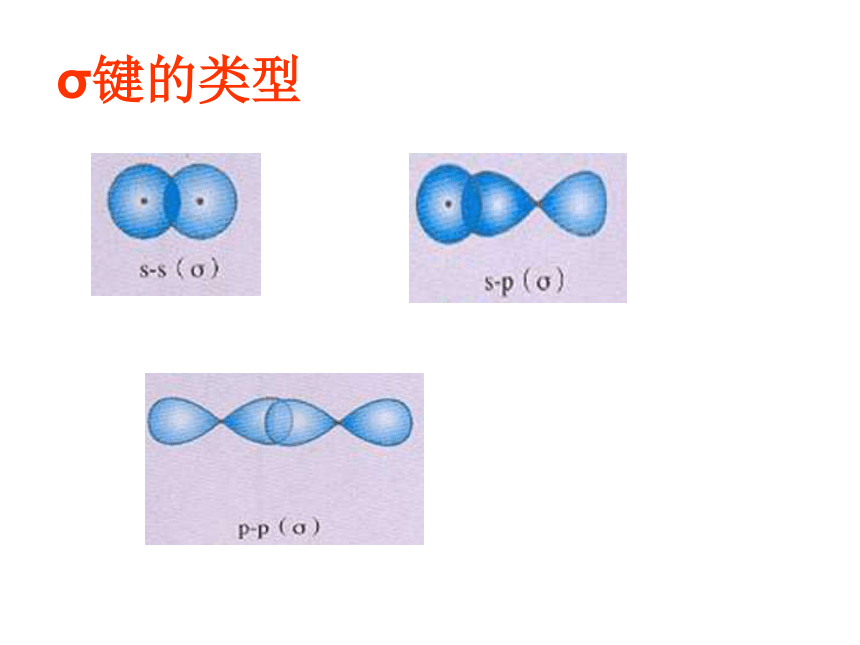
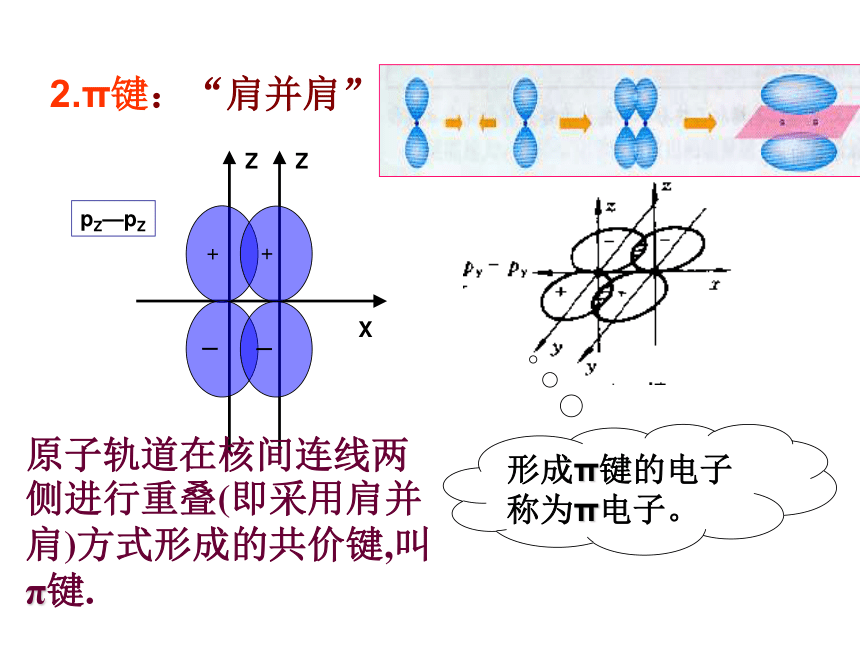
称为σ电子。原子轨道沿核间连线重叠(即头碰头方式)形成的共价键,叫σ键.二、共价键的类型氢原子形成氢分子的电子云描述σ键s-s σ键Cl-Cl的p-pσ键的形成H-Cl的s-pσ键的形成σ键的类型 2.π键:“肩并肩”XZZpZ—pZ形成π键的电子称为π电子。原子轨道在核间连线两侧进行重叠(即采用肩并肩)方式形成的共价键,叫π键.p-pπ键的形成π键的类型N2中p-pσ键和p-pπ键的形成过程N2N≡N分子结构【提出问题】
1.非金属元素氢,氯比较,谁的非金属性强?
2.非金属性强弱有什么表现?【讨论分析】
1.H2、HCl分子中共用电子对与原子的位置关系
及原子的电性情况
2.判断下列分子中键的极性:
①O2 ②H2O ③HF ④O=C=O ⑤H–O–O–H⑥非极性键——共用电子对不偏向任何原子的共价键,同种非金属元素的原子形成的共价键。
极性键——共用电子对发生偏向的共价键,不同种非金属元素的原子形成的共价键。成键原子的电负性相差越大,键的极性越强。
3.极性键和非极性键三、共价键的特征(1)、饱和性:原子有几个未成对电子就形成几个共价键。因为S轨道是球形对称的,所以S轨道与S轨道形成的共价键没有方向性。(2)方向性:是不是所有的共价键都具有方向性?问题:四、键参数1、键能:在101.3kpa,298K条件下,断开1molAB(g)分子中的化学键,使其分别生成气态A原子和气态B原子所吸收的能量称为A-B的键能
键能的大小可以定量地表示化学键的强弱程度。键能越大,化学键就越牢固。
某些共价键键能 / kJ·mol-1四、键参数2、键长:两个成键原子的原子核间的距离叫做该化学键的键长。
一般而言,化学键的键长越短,化学键越强,化学键就越牢固。
某些共价键键能(kJ/mol) 键长 / pm (1pm=10-12m)思考与交流试利用键能数据进行计算,1 mol H2分别跟1mol Cl2、1 mol Br2(g)反应,分别生成2 mol HCl分子和2 mol HBr分子,哪一个反应释放的能量更多?如何用计算结果说明HCl分子和HBr分子哪个更容易发生热分解反应生成相应的单质?
N2、O2、F2跟H2的反应能力依次增强,从键能的角度应如何理解这一化学事实?
通过上例子,你认为键长、键能对分子的化学性质有什么影响?四、键参数3、键角:在多原子分子中,两个化学键的夹角叫键角。
键角常用于描述多原子分子的空间构型。
CH3-CH3分子结构CH2=CH2分子结构CH≡CH分子结构CO2 180°CH4 109°28’H2O 105°NH3 107°课堂小结一、共价键的形成及本质
1、定义 2、本质
3、形成条件
4、表示方法:电子式 结构式
二、共价键的类型
1.σ键:“头碰头”
2.π键:“肩并肩”
三、共价键的特征 饱和性 方向性
四、键参数 键长 键能 键角
键的知识,回答以下几个问题:(1)化学键的定义及基本分类
(2)离子键、共价键的定义
(3)离子化合物、共价化合物的定义一.共价键形成和本质
1.从氢分子形成图说起(1)氢原子间距离与能量的
关系:
(2)为什么会出现这种情况?2.共价键的本质:
高概率地出现在两个原子核间的电子与
两个原子核之间的电性作用是共价键的本质.
如:H2 是H原子间1s电子
HCl是H的1s电子与Cl的3p电子
Cl2 是两个Cl原子3p轨道上的一个电子。1.通常电负性相同或差值小的非金属元素原子形成的化学键;
2.成键原子一般有未成对电子,用来相互配对成键(自旋反向);
3.成键原子的原子轨道在空间重叠使体系能量降低。3.共价键的形成条件 1.σ键:“头碰头”X++s—sX+px—sXpx—px形成σ键的电子
称为σ电子。原子轨道沿核间连线重叠(即头碰头方式)形成的共价键,叫σ键.二、共价键的类型氢原子形成氢分子的电子云描述σ键s-s σ键Cl-Cl的p-pσ键的形成H-Cl的s-pσ键的形成σ键的类型 2.π键:“肩并肩”XZZpZ—pZ形成π键的电子称为π电子。原子轨道在核间连线两侧进行重叠(即采用肩并肩)方式形成的共价键,叫π键.p-pπ键的形成π键的类型N2中p-pσ键和p-pπ键的形成过程N2N≡N分子结构【提出问题】
1.非金属元素氢,氯比较,谁的非金属性强?
2.非金属性强弱有什么表现?【讨论分析】
1.H2、HCl分子中共用电子对与原子的位置关系
及原子的电性情况
2.判断下列分子中键的极性:
①O2 ②H2O ③HF ④O=C=O ⑤H–O–O–H⑥非极性键——共用电子对不偏向任何原子的共价键,同种非金属元素的原子形成的共价键。
极性键——共用电子对发生偏向的共价键,不同种非金属元素的原子形成的共价键。成键原子的电负性相差越大,键的极性越强。
3.极性键和非极性键三、共价键的特征(1)、饱和性:原子有几个未成对电子就形成几个共价键。因为S轨道是球形对称的,所以S轨道与S轨道形成的共价键没有方向性。(2)方向性:是不是所有的共价键都具有方向性?问题:四、键参数1、键能:在101.3kpa,298K条件下,断开1molAB(g)分子中的化学键,使其分别生成气态A原子和气态B原子所吸收的能量称为A-B的键能
键能的大小可以定量地表示化学键的强弱程度。键能越大,化学键就越牢固。
某些共价键键能 / kJ·mol-1四、键参数2、键长:两个成键原子的原子核间的距离叫做该化学键的键长。
一般而言,化学键的键长越短,化学键越强,化学键就越牢固。
某些共价键键能(kJ/mol) 键长 / pm (1pm=10-12m)思考与交流试利用键能数据进行计算,1 mol H2分别跟1mol Cl2、1 mol Br2(g)反应,分别生成2 mol HCl分子和2 mol HBr分子,哪一个反应释放的能量更多?如何用计算结果说明HCl分子和HBr分子哪个更容易发生热分解反应生成相应的单质?
N2、O2、F2跟H2的反应能力依次增强,从键能的角度应如何理解这一化学事实?
通过上例子,你认为键长、键能对分子的化学性质有什么影响?四、键参数3、键角:在多原子分子中,两个化学键的夹角叫键角。
键角常用于描述多原子分子的空间构型。
CH3-CH3分子结构CH2=CH2分子结构CH≡CH分子结构CO2 180°CH4 109°28’H2O 105°NH3 107°课堂小结一、共价键的形成及本质
1、定义 2、本质
3、形成条件
4、表示方法:电子式 结构式
二、共价键的类型
1.σ键:“头碰头”
2.π键:“肩并肩”
三、共价键的特征 饱和性 方向性
四、键参数 键长 键能 键角
