21世纪教育网2010年备考中考化学系列专题--陕西中考化学高频考点透析之专题十 物质的构成与组成(教学案)
文档属性
| 名称 | 21世纪教育网2010年备考中考化学系列专题--陕西中考化学高频考点透析之专题十 物质的构成与组成(教学案) |

|
|
| 格式 | rar | ||
| 文件大小 | 705.6KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2010-04-03 00:00:00 | ||
图片预览



文档简介
登陆21世纪教育 助您教考全无忧
21世纪教育网2010年备考中考化学系列专题
陕西中考化学高频考点透析
专题十 物质的构成与组成
【陕西五年中考】
1、(2005·陕西) 当前食品安全成为人们关注的一个焦点。近期某些食品中发现的“苏丹红I号”是有毒的工业染料,严禁作为食品添加剂。关于“苏丹红I号”(化学式C16H12N2O )的下列叙述不正确的是( )
A. C16H12N2O 是由四种元素组成的化合物
B. “苏丹红I号”由31个原子构成
C. C16H12N2O 中H、N元素的质量比为3:7
D. C16H12N2O 中氮元素的质量分数约为11.3%
2、(2006· 陕西) 齐药二厂违规用二甘醇(化学式为C4H10O3)代替丙二醇(化学式为C3H8O2)作溶剂生产的“亮菌甲素注射液,对患者造成了严重的健康损害。下列关于二甘醇和丙二醇的说法正确的是( )
A.相对分子质量相同 B.所含元素种类相同
C.各元素质量比相同 D分子中所含原子数目相同
3、(2007·陕西)今年四月因遭受“倒春寒”导致部分地区小麦生长发育不良,出现了叶片干枯等症状,对此专家提出使用KH2PO4溶液喷洒小麦叶片。下列说法中正确的是( )
A.KH2PO4由三种元素组成 B.KH2PO4属于氧化物
C.KH2PO4中含有氢分子 D.KH2PO4是一种复合化肥
4、(2007·陕西)杨凌农科城使用的某种无土栽培营养液中含有硝酸钾。硝酸钾受热易分解,发生的反应是: KNO3 2KNO2 + O2↑
(1)在上面方框中填上化学计量数。
(2)KNO2中氮元素的化合价是 。
(3)氧分子由氧原子构成,氧原子的原子结构示意图为
其最外层有 个电子。
(4)根据KNO3的性质推测,其贮存方法应为 。
5、(2008·陕西)雄伟壮观的国家大剧院主体建筑表面安装了近两万块钛(Ti)金属板。下列关于钛及其化合物的说法正确的是( )
A、Ti可以表示钛元素,也可以表示1个钛原子,还可以表示钛单质
B. TiO2中含有氧分子
C、Ca TiO2属于氧化物
D、Ti原子核内有22个质子,则Ti3+核外有25个电子
6、(2009·陕西)“达菲”是治疗甲型H1N1型流感的有效药物,莽草酸是生产“达菲”的关键原料,它是从中药八角中提取的物质,其化学式为C7H10O5。下列叙述正确的是( )
A.莽草酸属于混合物
B.莽草酸中碳、氢、氧元素的质量比为7:10:5
C.1个莽草酸分子中含有5个水分子
D.1个莽草酸分子中含有22个原子
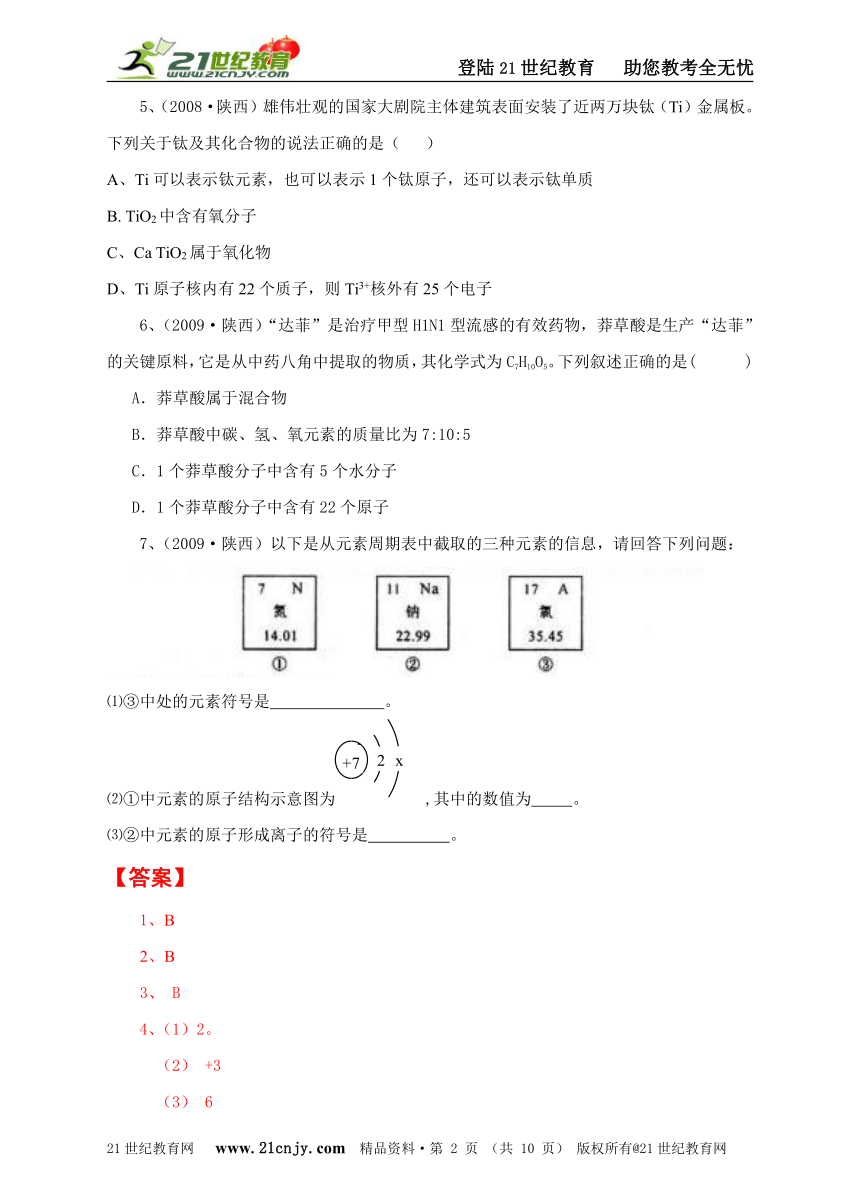
7、(2009·陕西)以下是从元素周期表中截取的三种元素的信息,请回答下列问题:
⑴③中处的元素符号是 。
⑵①中元素的原子结构示意图为 ,其中的数值为 。
⑶②中元素的原子形成离子的符号是 。
【答案】
1、B
2、B
3、 B
4、(1)2。
(2) +3
(3) 6
(4)在阴凉处保存 。
5、A
6、D
7、⑴Cl
⑵5
⑶Na+
【中考命题特点】
此考点在往年中考中所占分值在2分到5分之间,难度系数在0.8左右,是中考常考知识点,其命题的思路、内容有以下几点:
(1)以考查分子、原子的性质为内容的选择题,注重对分子不停的运动。分子间有间隔的考查
(2)以考查原子的结构为内容的选择题、填空题,其注重考查根据粒子结构推断粒子的种类,具体原子或离子的质子数、核电荷数、电子数、相对原子质量的关系等。
(3)给定原子的结构示意图或元素周期表,让学生总结相关规律的开放性试题。
【考点精讲】
一、物质的构成
1、物质构成的体系
概念:保持物质化学性质的最小微粒
分子 体积和质量都很小
特征 分子间有一定的间隔
构 构 分子在不停的运动
成 成 概念:化学变化中的最小微粒
特征:同分子的特征相似
物质 原子 质子(带正电)
构成 得 原子核(带正电)
失 结构 中子(不带电)
构 电 核外电子(带负电)
成 子
形
成 概念:带电的原子或原子团
离子 阳离子
分类
阴离子
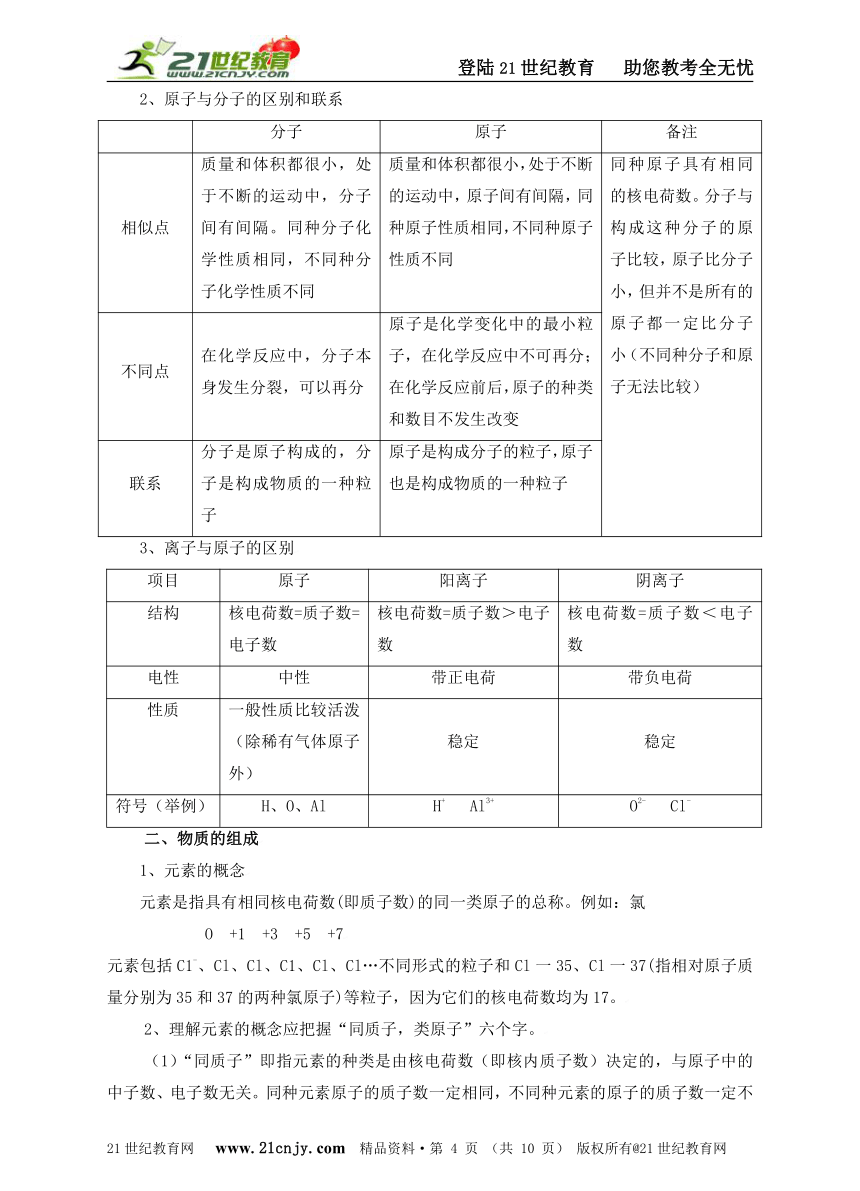
2、原子与分子的区别和联系
分子 原子 备注
相似点 质量和体积都很小,处于不断的运动中,分子间有间隔。同种分子化学性质相同,不同种分子化学性质不同 质量和体积都很小,处于不断的运动中,原子间有间隔,同种原子性质相同,不同种原子性质不同 同种原子具有相同的核电荷数。分子与构成这种分子的原子比较,原子比分子小,但并不是所有的原子都一定比分子小(不同种分子和原子无法比较)
不同点 在化学反应中,分子本身发生分裂,可以再分 原子是化学变化中的最小粒子,在化学反应中不可再分;在化学反应前后,原子的种类和数目不发生改变
联系 分子是原子构成的,分子是构成物质的一种粒子 原子是构成分子的粒子,原子也是构成物质的一种粒子
3、离子与原子的区别
项目 原子 阳离子 阴离子
结构 核电荷数=质子数=电子数 核电荷数=质子数>电子数 核电荷数=质子数<电子数
电性 中性 带正电荷 带负电荷
性质 一般性质比较活泼(除稀有气体原子外) 稳定 稳定
符号(举例) H、O、Al H+ Al3+ O2- Cl-
二、物质的组成
1、元素的概念
元素是指具有相同核电荷数(即质子数)的同一类原子的总称。例如:氯
O +1 +3 +5 +7
元素包括C1-、Cl、Cl、C1、Cl、Cl…不同形式的粒子和Cl一35、Cl一37(指相对原子质量分别为35和37的两种氯原子)等粒子,因为它们的核电荷数均为17。
2、理解元素的概念应把握“同质子,类原子”六个字。
(1)“同质子”即指元素的种类是由核电荷数(即核内质子数)决定的,与原子中的中子数、电子数无关。同种元素原子的质子数一定相同,不同种元素的原子的质子数一定不相同。
(2)“类原子”是指一种元素可能不止一种原子。它包括质子数相同、中子数不同的原子(如:氢元素有三种原子:氕、氘、氚,它们的质子数相同,但中子数不同);也包括质子数相同,而电子数不同的原子和离子(如:铁原子通常有三种存在形式即Fe、Fe2+、Fe3+,它们都属于铁元素)。
3、理解元素概念时的注意事项
(1)元素是以核电荷数(即质子数)为标准对原子分类。只论种类,不讲个数。
(2)质子数是划分元素种类的标准。质子数相同的原子和单核离子都属同一种元素。如Na+与Na都属钠元素,但Na+与NH4+不属于同一种元素。
(3)同种元素可以有不同的存在状态。如单质中和化合物中。
(4)同种元素的离子因带电荷数不同,性质也不同。如Fe2+与Fe3+。
(5)自然界中目前已知的元素有112种,可分为金属元素、非金属元素、稀有气体元素。
4、元素与原子的比较
元素 原子
区别 是宏观概念,只表示种类不表示个数 是微观概念,既分种类,又表示个数
适用范围 表示物质的宏观组成。常用来表示物质由哪几种元素组成 表示物质的微观构成。常用来表示物质的分子由哪些及几个原子构成
联系 只要核电荷数相同的一类原子就是同一种元素,原子是元素的最小单位,而元素是原子的一个归类“集体”。
【解题技巧和方法】
【例1】(2009·宿迁)下列有关分子、原子、离子说法正确的是( )
A.分子是化学变化中最小的粒子
B.一切原子的原子核都是由质子、中子构成的
C.分子的质量总比原子质量大
D.分子、原子、离子都能直接构成物质
【答案】D
【解析】化学变化中的最小粒子是原子,氢原子中没有中子,分子的质量比构成其原子的质量大,不能理解成分子的质量比原子的质量大,如氢分子的质量小于氧原子的质量。
【规律总结】分子、原子、离子都可以构成物质,金属单质和稀有气体单质是由原子直接构成的,共价化合物和一般气体大都是由分子构成的,离子化合物是由离子构成的。
【例2】(2009·福州)海水是重要的资源,每千克海水中约含有钠10.62 g、镁1.28 g、钙0.40 g等。这里的“钠、镁、钙”指的是( )
A.原子 B.分子 C.元素 D.单质
【答案】C
【解析】此题是元素概念在实际生活中的应用。生活中的物质成分比较复杂,我们通常所说的物质组成都是指物质的元素组成,是通过元素组成来说明其成分或比较其含量的。
【规律小结】物质是由分子、原子或离子构成,由元素组成。
【例3】 (2008·北京)下图a是两种元素在元素周期表中的信息,下图b是氟原子的原子结构示意图。
(1)图a方框的横线上填的是 ;图b方框横线上的数字是 。
(2)请将“元素”、“原子”、“分子”填入图c适当的圆圈内,从而完成元素、原子、分子与物质之间的正确的关系图。
分子
【答案】(1)Na ;7 ; 元素
原子
【解析】图a中两图相比较知:方框内应是钠元素的元素符号,图b是氟原子的结构示意图,所以放框内的数字应是7,物质是由分子、原子构成的,分子是由原子构成的,物质是有元素组成的。
【规律总结】两种元素在元素周期表中的信息是:方框的左上角是元素序数(即原子的质子数),右上角是元素符号,中间是元素名称,下方是相对原子质量;原子结构示意图中,圆圈内的数字是原子的质子数,弧线表示电子层,弧线上的数字表示该电子层上的电子数;任何物质都是由分子、原子或离子构成的,分子是由原子构成的,原子得失电子变为离子,物质是有元素组成的。
【强化训练】
1、(2009·潍坊)榴莲被誉为“果中之王”。切开榴莲时可闻到特殊香味,这说明( )
A.分子在不断运动 B.分子质量很小
C.分子体积很小 D.分子间有间隔
2、(2009·烟台)下列对一些事实的解释不正确的是( )
事 实 解 释
A 物质的热胀冷缩 分子或原子间的间隔随温度的改变而改变。
B 一氧化碳有可燃性,而二氧化碳不具有可燃性 物质组成元素不同,分子结构也不同
C 0℃时水结成冰,而海水在-1.9℃才会结冰 海水中含有盐,是混合物,其凝固点比水低
D 盐酸和稀硫酸都能使紫色石蕊试液变红色 盐酸和稀硫酸中都含有大量的氢离子
3、(2009·苏州)用分子的相关知识解释下列生活中的现象,其中错误的是( )
A.热胀冷缩,说明分子的大小随温度升降而改娈
B.“酒香不怕巷子深”,说明分子在不停地运动
C.10mL酒精和10mL水混合后,体积小于20mL,说明分子间有空隙
D.湿衣服在夏天比冬天容易晾干,说明分子的运动速率随温度升高而加快
4、(2009·安徽)我国著名化学家徐光宪因在稀土元素等研究领域做出杰出贡献,荣获2008年度“国家最高科学技术奖”。铈(Ce)是一种常见的稀土元素,下列关于铈的说法错误的是( )
A.原子序数是58 B.相对原子质量是140.1
C.质子数为58 D.铈元素是非金属元素
5、(2009·福州)右图是钠元素的原子结构示意图,下列
有关钠原子的叙述不正确的是( )
A.质子数是11 B.最外层电子数为1
C.核外有3个电子层 D.核外电子总数为10
6、(2009·烟台)雄伟壮观的国家大剧院主体建筑表面安装了近2万块钛(Ti)金属板。已知Ti原子核内有22个质子,则下列叙述正确的是( )
A. Ti可以表示一个钛原子 B. Ti4+核外有26个电子
C. TiO2中含有氧分子 D. CaTiO3属于金属氧化物
7、(2009·青岛)下图是元素周期表中的一格,依据图中的信息得到的下列认识错误的是( )
A.该元素原子的质子数为14
B.该元素属于非金属元素
C.该元素一个原子的原子核外有14个电子
D.该元素的相对原子质量为28.09
8、(2009·苏州)参考下列物质的微观结构图示,其中由阴,阳离子构成的物质是( )
A.铜 B.干冰 C.氯化钠 D.金刚石
9、(2009·雅安)结构示意图 所表示的粒子是( )
A.原子 B.分子 C. 阴离子 D.阳离子
10、(2009·南京)原子序数为94的钚(Pu)是一种核原料,该元素一种原子的质子数和中子数之和为239,下列关于该原子的说法不正确的是( )
A.中子数为145 B.核外电子数为94
C.质子数为94 D.核电荷数为239
二、填空题
二、填空题
11、(2009·重庆)(1)用数字和化学符号表示:2个氧原子 ,3个钠离子 。
(2)镁的原子结构示意图为 ,Mg原子在化学反应中容
易 (填“得到”或“失去”)2个电子。
12、(2009·苏州)形态各异的物质可按一定规律分类。现有以下八种物质,请选用各物质名称前的字母序号填涂在答题卡相应位置。
A.盐酸 B.氯化钾 C.氧化铜 D.淀粉
E.五氧化二磷 F.氮气 G.氢氧化钙 H.甲烷
题号 物质分类标准 字母序号 题号 物质分类标准 字母序号
(1) 金属氧化物 (5) 非金属单质
(2) 非金属氧化物 (6) 挥发性酸
(3) 易溶性盐 (7) 最简单的有机物
(4) 微溶性碱 (8) 糖类
13、(2009·眉山)化学是研究物质的结构、性质以及变化规律的科学,研究元素知识是学好化学的基础。下表包含部分元素的相关信息,完成以下填空:
(1)1869年,科学家 发现了元素周期律和元素周期表。
(2)请画出17号元素原子结构示意图 ,该元素在化学反应中比较容易 (填“得到”或“失去”)电子变成离子。
(3)上表中最活泼的金属元素与地壳中含量最多的元素组成的化合物是
(填化学式)。
【解析及答案】
一、选择题
1、A 解析:由于分子不断的运动,才能被人接触闻到
2、B 解析:一氧化碳和二氧化碳都是由碳元素和氧元素组成。
3、A 解析:热胀冷缩是由于分子间的间隔变大引起的,分子的大小是不变的。
4、D 解析:金属元素的名称都有“钅”字旁,铈属于金属元素。
5、D 解析:从结构示意图中可知核外电子总数为2+8+1=11个。
6、A
7、D 解析:相对原子质量是针对原子而言的,不能理解成元素的相对原子质量。
8、C 解析:铜和金刚石由原子构成,干冰由分子构成。
9、D 解析:原子核外由18个电子,核内由17个质子,所以其带一个单位的负电荷,属于阴离子。
10、D 解析:原子中原子序数=质子数=电子数=核电荷数。
二、填空题
11、(1)2O 3Na+ (2)失去
解析:镁原子的最外层电子数为2,小于4个,易失去电子形成稳定结构。
12、(1)C (2)E (3)B (4)G (5)F (6)A (7)H (8)D
13、(1)门捷列夫 (2) 得到 (3)Na2O(Na2O2)
8
2
14 Si
硅
28.09
x
2
+7
2
+12
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网 www.21cnjy.com 精品资料·第 1 页 (共 10 页) 版权所有@21世纪教育网
21世纪教育网2010年备考中考化学系列专题
陕西中考化学高频考点透析
专题十 物质的构成与组成
【陕西五年中考】
1、(2005·陕西) 当前食品安全成为人们关注的一个焦点。近期某些食品中发现的“苏丹红I号”是有毒的工业染料,严禁作为食品添加剂。关于“苏丹红I号”(化学式C16H12N2O )的下列叙述不正确的是( )
A. C16H12N2O 是由四种元素组成的化合物
B. “苏丹红I号”由31个原子构成
C. C16H12N2O 中H、N元素的质量比为3:7
D. C16H12N2O 中氮元素的质量分数约为11.3%
2、(2006· 陕西) 齐药二厂违规用二甘醇(化学式为C4H10O3)代替丙二醇(化学式为C3H8O2)作溶剂生产的“亮菌甲素注射液,对患者造成了严重的健康损害。下列关于二甘醇和丙二醇的说法正确的是( )
A.相对分子质量相同 B.所含元素种类相同
C.各元素质量比相同 D分子中所含原子数目相同
3、(2007·陕西)今年四月因遭受“倒春寒”导致部分地区小麦生长发育不良,出现了叶片干枯等症状,对此专家提出使用KH2PO4溶液喷洒小麦叶片。下列说法中正确的是( )
A.KH2PO4由三种元素组成 B.KH2PO4属于氧化物
C.KH2PO4中含有氢分子 D.KH2PO4是一种复合化肥
4、(2007·陕西)杨凌农科城使用的某种无土栽培营养液中含有硝酸钾。硝酸钾受热易分解,发生的反应是: KNO3 2KNO2 + O2↑
(1)在上面方框中填上化学计量数。
(2)KNO2中氮元素的化合价是 。
(3)氧分子由氧原子构成,氧原子的原子结构示意图为
其最外层有 个电子。
(4)根据KNO3的性质推测,其贮存方法应为 。
5、(2008·陕西)雄伟壮观的国家大剧院主体建筑表面安装了近两万块钛(Ti)金属板。下列关于钛及其化合物的说法正确的是( )
A、Ti可以表示钛元素,也可以表示1个钛原子,还可以表示钛单质
B. TiO2中含有氧分子
C、Ca TiO2属于氧化物
D、Ti原子核内有22个质子,则Ti3+核外有25个电子
6、(2009·陕西)“达菲”是治疗甲型H1N1型流感的有效药物,莽草酸是生产“达菲”的关键原料,它是从中药八角中提取的物质,其化学式为C7H10O5。下列叙述正确的是( )
A.莽草酸属于混合物
B.莽草酸中碳、氢、氧元素的质量比为7:10:5
C.1个莽草酸分子中含有5个水分子
D.1个莽草酸分子中含有22个原子
7、(2009·陕西)以下是从元素周期表中截取的三种元素的信息,请回答下列问题:
⑴③中处的元素符号是 。
⑵①中元素的原子结构示意图为 ,其中的数值为 。
⑶②中元素的原子形成离子的符号是 。
【答案】
1、B
2、B
3、 B
4、(1)2。
(2) +3
(3) 6
(4)在阴凉处保存 。
5、A
6、D
7、⑴Cl
⑵5
⑶Na+
【中考命题特点】
此考点在往年中考中所占分值在2分到5分之间,难度系数在0.8左右,是中考常考知识点,其命题的思路、内容有以下几点:
(1)以考查分子、原子的性质为内容的选择题,注重对分子不停的运动。分子间有间隔的考查
(2)以考查原子的结构为内容的选择题、填空题,其注重考查根据粒子结构推断粒子的种类,具体原子或离子的质子数、核电荷数、电子数、相对原子质量的关系等。
(3)给定原子的结构示意图或元素周期表,让学生总结相关规律的开放性试题。
【考点精讲】
一、物质的构成
1、物质构成的体系
概念:保持物质化学性质的最小微粒
分子 体积和质量都很小
特征 分子间有一定的间隔
构 构 分子在不停的运动
成 成 概念:化学变化中的最小微粒
特征:同分子的特征相似
物质 原子 质子(带正电)
构成 得 原子核(带正电)
失 结构 中子(不带电)
构 电 核外电子(带负电)
成 子
形
成 概念:带电的原子或原子团
离子 阳离子
分类
阴离子
2、原子与分子的区别和联系
分子 原子 备注
相似点 质量和体积都很小,处于不断的运动中,分子间有间隔。同种分子化学性质相同,不同种分子化学性质不同 质量和体积都很小,处于不断的运动中,原子间有间隔,同种原子性质相同,不同种原子性质不同 同种原子具有相同的核电荷数。分子与构成这种分子的原子比较,原子比分子小,但并不是所有的原子都一定比分子小(不同种分子和原子无法比较)
不同点 在化学反应中,分子本身发生分裂,可以再分 原子是化学变化中的最小粒子,在化学反应中不可再分;在化学反应前后,原子的种类和数目不发生改变
联系 分子是原子构成的,分子是构成物质的一种粒子 原子是构成分子的粒子,原子也是构成物质的一种粒子
3、离子与原子的区别
项目 原子 阳离子 阴离子
结构 核电荷数=质子数=电子数 核电荷数=质子数>电子数 核电荷数=质子数<电子数
电性 中性 带正电荷 带负电荷
性质 一般性质比较活泼(除稀有气体原子外) 稳定 稳定
符号(举例) H、O、Al H+ Al3+ O2- Cl-
二、物质的组成
1、元素的概念
元素是指具有相同核电荷数(即质子数)的同一类原子的总称。例如:氯
O +1 +3 +5 +7
元素包括C1-、Cl、Cl、C1、Cl、Cl…不同形式的粒子和Cl一35、Cl一37(指相对原子质量分别为35和37的两种氯原子)等粒子,因为它们的核电荷数均为17。
2、理解元素的概念应把握“同质子,类原子”六个字。
(1)“同质子”即指元素的种类是由核电荷数(即核内质子数)决定的,与原子中的中子数、电子数无关。同种元素原子的质子数一定相同,不同种元素的原子的质子数一定不相同。
(2)“类原子”是指一种元素可能不止一种原子。它包括质子数相同、中子数不同的原子(如:氢元素有三种原子:氕、氘、氚,它们的质子数相同,但中子数不同);也包括质子数相同,而电子数不同的原子和离子(如:铁原子通常有三种存在形式即Fe、Fe2+、Fe3+,它们都属于铁元素)。
3、理解元素概念时的注意事项
(1)元素是以核电荷数(即质子数)为标准对原子分类。只论种类,不讲个数。
(2)质子数是划分元素种类的标准。质子数相同的原子和单核离子都属同一种元素。如Na+与Na都属钠元素,但Na+与NH4+不属于同一种元素。
(3)同种元素可以有不同的存在状态。如单质中和化合物中。
(4)同种元素的离子因带电荷数不同,性质也不同。如Fe2+与Fe3+。
(5)自然界中目前已知的元素有112种,可分为金属元素、非金属元素、稀有气体元素。
4、元素与原子的比较
元素 原子
区别 是宏观概念,只表示种类不表示个数 是微观概念,既分种类,又表示个数
适用范围 表示物质的宏观组成。常用来表示物质由哪几种元素组成 表示物质的微观构成。常用来表示物质的分子由哪些及几个原子构成
联系 只要核电荷数相同的一类原子就是同一种元素,原子是元素的最小单位,而元素是原子的一个归类“集体”。
【解题技巧和方法】
【例1】(2009·宿迁)下列有关分子、原子、离子说法正确的是( )
A.分子是化学变化中最小的粒子
B.一切原子的原子核都是由质子、中子构成的
C.分子的质量总比原子质量大
D.分子、原子、离子都能直接构成物质
【答案】D
【解析】化学变化中的最小粒子是原子,氢原子中没有中子,分子的质量比构成其原子的质量大,不能理解成分子的质量比原子的质量大,如氢分子的质量小于氧原子的质量。
【规律总结】分子、原子、离子都可以构成物质,金属单质和稀有气体单质是由原子直接构成的,共价化合物和一般气体大都是由分子构成的,离子化合物是由离子构成的。
【例2】(2009·福州)海水是重要的资源,每千克海水中约含有钠10.62 g、镁1.28 g、钙0.40 g等。这里的“钠、镁、钙”指的是( )
A.原子 B.分子 C.元素 D.单质
【答案】C
【解析】此题是元素概念在实际生活中的应用。生活中的物质成分比较复杂,我们通常所说的物质组成都是指物质的元素组成,是通过元素组成来说明其成分或比较其含量的。
【规律小结】物质是由分子、原子或离子构成,由元素组成。
【例3】 (2008·北京)下图a是两种元素在元素周期表中的信息,下图b是氟原子的原子结构示意图。
(1)图a方框的横线上填的是 ;图b方框横线上的数字是 。
(2)请将“元素”、“原子”、“分子”填入图c适当的圆圈内,从而完成元素、原子、分子与物质之间的正确的关系图。
分子
【答案】(1)Na ;7 ; 元素
原子
【解析】图a中两图相比较知:方框内应是钠元素的元素符号,图b是氟原子的结构示意图,所以放框内的数字应是7,物质是由分子、原子构成的,分子是由原子构成的,物质是有元素组成的。
【规律总结】两种元素在元素周期表中的信息是:方框的左上角是元素序数(即原子的质子数),右上角是元素符号,中间是元素名称,下方是相对原子质量;原子结构示意图中,圆圈内的数字是原子的质子数,弧线表示电子层,弧线上的数字表示该电子层上的电子数;任何物质都是由分子、原子或离子构成的,分子是由原子构成的,原子得失电子变为离子,物质是有元素组成的。
【强化训练】
1、(2009·潍坊)榴莲被誉为“果中之王”。切开榴莲时可闻到特殊香味,这说明( )
A.分子在不断运动 B.分子质量很小
C.分子体积很小 D.分子间有间隔
2、(2009·烟台)下列对一些事实的解释不正确的是( )
事 实 解 释
A 物质的热胀冷缩 分子或原子间的间隔随温度的改变而改变。
B 一氧化碳有可燃性,而二氧化碳不具有可燃性 物质组成元素不同,分子结构也不同
C 0℃时水结成冰,而海水在-1.9℃才会结冰 海水中含有盐,是混合物,其凝固点比水低
D 盐酸和稀硫酸都能使紫色石蕊试液变红色 盐酸和稀硫酸中都含有大量的氢离子
3、(2009·苏州)用分子的相关知识解释下列生活中的现象,其中错误的是( )
A.热胀冷缩,说明分子的大小随温度升降而改娈
B.“酒香不怕巷子深”,说明分子在不停地运动
C.10mL酒精和10mL水混合后,体积小于20mL,说明分子间有空隙
D.湿衣服在夏天比冬天容易晾干,说明分子的运动速率随温度升高而加快
4、(2009·安徽)我国著名化学家徐光宪因在稀土元素等研究领域做出杰出贡献,荣获2008年度“国家最高科学技术奖”。铈(Ce)是一种常见的稀土元素,下列关于铈的说法错误的是( )
A.原子序数是58 B.相对原子质量是140.1
C.质子数为58 D.铈元素是非金属元素
5、(2009·福州)右图是钠元素的原子结构示意图,下列
有关钠原子的叙述不正确的是( )
A.质子数是11 B.最外层电子数为1
C.核外有3个电子层 D.核外电子总数为10
6、(2009·烟台)雄伟壮观的国家大剧院主体建筑表面安装了近2万块钛(Ti)金属板。已知Ti原子核内有22个质子,则下列叙述正确的是( )
A. Ti可以表示一个钛原子 B. Ti4+核外有26个电子
C. TiO2中含有氧分子 D. CaTiO3属于金属氧化物
7、(2009·青岛)下图是元素周期表中的一格,依据图中的信息得到的下列认识错误的是( )
A.该元素原子的质子数为14
B.该元素属于非金属元素
C.该元素一个原子的原子核外有14个电子
D.该元素的相对原子质量为28.09
8、(2009·苏州)参考下列物质的微观结构图示,其中由阴,阳离子构成的物质是( )
A.铜 B.干冰 C.氯化钠 D.金刚石
9、(2009·雅安)结构示意图 所表示的粒子是( )
A.原子 B.分子 C. 阴离子 D.阳离子
10、(2009·南京)原子序数为94的钚(Pu)是一种核原料,该元素一种原子的质子数和中子数之和为239,下列关于该原子的说法不正确的是( )
A.中子数为145 B.核外电子数为94
C.质子数为94 D.核电荷数为239
二、填空题
二、填空题
11、(2009·重庆)(1)用数字和化学符号表示:2个氧原子 ,3个钠离子 。
(2)镁的原子结构示意图为 ,Mg原子在化学反应中容
易 (填“得到”或“失去”)2个电子。
12、(2009·苏州)形态各异的物质可按一定规律分类。现有以下八种物质,请选用各物质名称前的字母序号填涂在答题卡相应位置。
A.盐酸 B.氯化钾 C.氧化铜 D.淀粉
E.五氧化二磷 F.氮气 G.氢氧化钙 H.甲烷
题号 物质分类标准 字母序号 题号 物质分类标准 字母序号
(1) 金属氧化物 (5) 非金属单质
(2) 非金属氧化物 (6) 挥发性酸
(3) 易溶性盐 (7) 最简单的有机物
(4) 微溶性碱 (8) 糖类
13、(2009·眉山)化学是研究物质的结构、性质以及变化规律的科学,研究元素知识是学好化学的基础。下表包含部分元素的相关信息,完成以下填空:
(1)1869年,科学家 发现了元素周期律和元素周期表。
(2)请画出17号元素原子结构示意图 ,该元素在化学反应中比较容易 (填“得到”或“失去”)电子变成离子。
(3)上表中最活泼的金属元素与地壳中含量最多的元素组成的化合物是
(填化学式)。
【解析及答案】
一、选择题
1、A 解析:由于分子不断的运动,才能被人接触闻到
2、B 解析:一氧化碳和二氧化碳都是由碳元素和氧元素组成。
3、A 解析:热胀冷缩是由于分子间的间隔变大引起的,分子的大小是不变的。
4、D 解析:金属元素的名称都有“钅”字旁,铈属于金属元素。
5、D 解析:从结构示意图中可知核外电子总数为2+8+1=11个。
6、A
7、D 解析:相对原子质量是针对原子而言的,不能理解成元素的相对原子质量。
8、C 解析:铜和金刚石由原子构成,干冰由分子构成。
9、D 解析:原子核外由18个电子,核内由17个质子,所以其带一个单位的负电荷,属于阴离子。
10、D 解析:原子中原子序数=质子数=电子数=核电荷数。
二、填空题
11、(1)2O 3Na+ (2)失去
解析:镁原子的最外层电子数为2,小于4个,易失去电子形成稳定结构。
12、(1)C (2)E (3)B (4)G (5)F (6)A (7)H (8)D
13、(1)门捷列夫 (2) 得到 (3)Na2O(Na2O2)
8
2
14 Si
硅
28.09
x
2
+7
2
+12
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网 www.21cnjy.com 精品资料·第 1 页 (共 10 页) 版权所有@21世纪教育网
同课章节目录
