化学:2.2《分子的立体结构》课件(第三课时)(新人教版选修3)
文档属性
| 名称 | 化学:2.2《分子的立体结构》课件(第三课时)(新人教版选修3) |

|
|
| 格式 | rar | ||
| 文件大小 | 99.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2010-03-31 00:00:00 | ||
图片预览






文档简介
课件17张PPT。配合物理论简介天蓝色天蓝色天蓝色无色无色无色思考:前三种溶液呈天蓝色大概与什么物质有关?依据是什么?结论:上述实验中呈天蓝色的物质叫做四水合铜离子,可表示为[Cu(H2O) 4]2+。在四水合铜离子中,铜离子与水分子之间的化学键是由水分子中的O原子提供孤对电子对给予铜离子(铜离子提供空轨道),铜离子接受水分子的孤对电子形成的,这类“电子对给予—接受键”被称为配位键。1、配位键:共用电子对由一个原子单方面提供给另一个原子共用所形成的共价键叫配位键。是一种特殊的共价键。2、配位化合物:中心离子(或原子) 与配位体(某些分子或离子) 以配位键的形式结合而成的化合物。①可用A→B表示
A表示提供孤对电子的原子,叫电子给予体或配体,常为N、O、P、S、卤素的原子或离子
B表示接受电子的原子,叫接受体,一般为过渡金属
②形成配位键的条件:一个原子提供孤对电子,另一原子提供空轨道例题一:下列分子中的中心原子杂化轨道的类型相同的是 ( )
A.CO2与SO2 B.CH4与NH3
C.BeCl2与BF3 D.C2H2与C2H4B例题二:下列分子或离子中都存在着配位键的是 ( )
A.NH3、H2O B.NH4 + 、H3O+
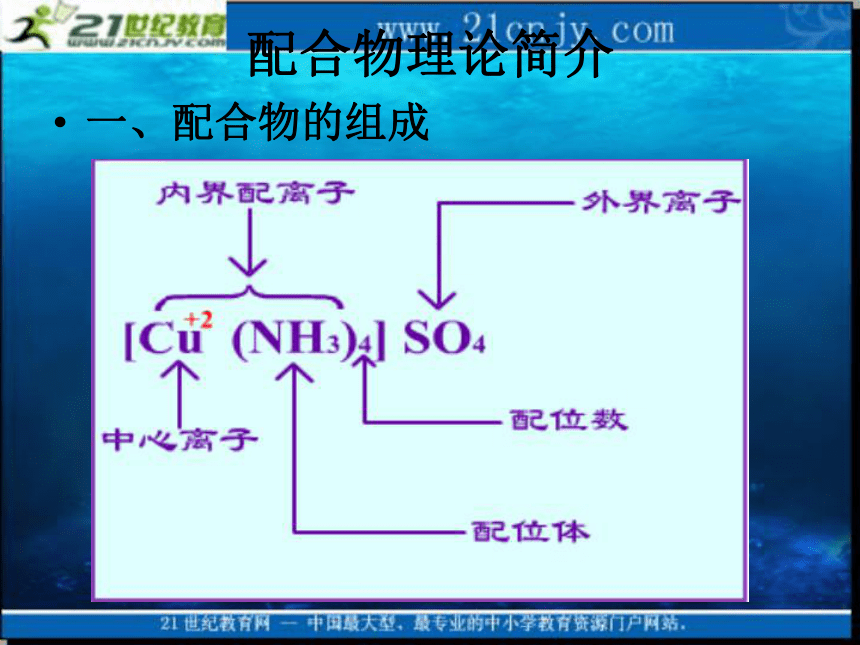
C.N2、HClO D. [Cu(NH3) 4]2+ 、PCI3B 由于该离子的颜色极似血液,常被用于电影特技和魔术表演。配合物理论简介一、配合物的组成
1. 中心离子或原子(也称形成体) 有空轨道 主要是一些过渡金属,如铁、钴、镍、铜、银、金、铂等金 属元素的离子; 或是具有高氧化数的非金属元素,硼,硅、磷等,如Na[BF4] 中的B(Ⅲ)、K2[SiF6]中的Si(Ⅳ)和NH4[PF6]中的P(Ⅴ); 或是不带电荷的中性原子,如[Ni(CO)4], [Fe(CO)5]中的Ni, Fe都是中性原子, 碱金属、碱土金属等可作为螯合物的形成体。 [Cu(NH3)4]SO4中,NH3是配位体,N为配位原子。2. 配位体和配位原子 有孤对电子a. 单齿配位体(一个配位体中只有一个配位原子)
含氮配位体 NH3 , NCS - ;含硫配位体 SCN- ;
含卤素配位体 F- , Cl- , Br- , I- ; 含碳配位体 CN- , CO
含氧配位体 H2O, OH- ,羧酸,醇,醚等
b. 多齿配位体(有两个或两个以上的配位原子)
乙二胺 NH2一CH2一CH2一NH2 简写为en,
乙二胺四乙酸根(EDTA)等。 3.配位数
与中心离子直接以配位键结合的配位原子个数。例:[AlF6]3- 配位数6 、 [Cu(NH3)4]SO4 配位数4 、
[Co(NH3)2(en)2](NO3)3 配位数6 *中心离子的电荷高,对配位体的吸引力较强,有利于形成配位数较高的配合物。 常见的配位数与中心离子的电荷数有如下的关系:
中心离子的电荷:+1 +2 +3 +4
常见的配位数: 2 4(或6) 6(或4) 6(或8)*中心离子半径越大,其周围可容纳配体就越多,
配位数越大。[AlF6]3- [AlCl4]- [BF4]- [AgI2]- [AgI4]2-
从这些配离子你看出配位数有什么规律? 4. 配离子的电荷配离子的电荷等于中心离子电荷与配位体总电荷的代数和。 如 K2[PtCl4] 8.1.2 配位化合物的命名配位数—配位体名称—合—中心离子(用罗马数字表示氧化数),
用二、三、四等数字表示配位体数。不同配位名称之间用圆点“·”分开。 阴离子次序为:简单离子——复杂离子——有机酸根离子。
中性分子次序为:NH3—H2O—有机分子。 1.配位阴离子配合物--配位阴离子“酸”外界 2.配位阳离子配合物—— “某化某”或“某酸某” 3.中性配合物K2[SiF6] 六氟合硅(Ⅳ)酸钾
K[PtCl5(NH3)] 五氯·一氨合铂(Ⅳ)酸钾[Co(NH3)6]Br3 三溴化六氨合钴(Ⅲ)
[Co(NH3)2(en)2](NO3)3 硝酸二氨·二(乙二胺)合钴(Ⅲ)[PtCl2(NH3)2] 二氯·二氨合铂(Ⅱ)
[Ni(CO)4] 四羰基合镍(0) 配合物的盐与复盐的比较 复盐, 能电离出两种或两种以上阳离子的盐如明矾 KAl(SO4)2·12H2O、光卤石 KCl · MgCl2· 6H2O等,仅在固态时稳定存在,一旦溶于水,几乎全部解离成各组分离子:
KAl(SO4)2·12H2O (溶于水) → K+ +Al3++ 2SO42- +12 H2O
KCl · MgCl2 · 6H2O (溶于水) → K+ +Mg2+ + 3Cl- + 6H2O 配合物盐,是在配合物的溶液或晶体中,十分明确地存在着 含有配位键的、能独立存在的复杂组成的离子:
[Cu(NH3)4]SO4·H2O → [Cu(NH3)4]2+ + SO42- + H2O形成配合物时性质的改变1、颜色的改变
Fe3+ + nNCS- == [Fe(NCS)n](n-3)-2、溶解度的改变:
AgCl + HCl =[AgCl2]- + H+
AgCl + 2NH3 == [Ag(NH3)2]+ + Cl-
Au + HNO3 + 4HCl == H[AuCl4] + NO + 2H2O
3Pt + 4HNO3 + 18HCl = 3H2[PtCl6] + 4NO + 8H2O 例题一:下列分子或离子中都存在着配位键的是 ( )
A.NH3、H2O B.NH4 + 、H3O+
C.N2、HClO D. [Cu(NH3) 4]2+ 、PCI3B 例题二:下列各种说法中错误的是( )
A、形成配位键的条件是一方有空轨道一方有孤对电子。
B、配位键是一种特殊的共价键。
C、配位化合物中的配体可以是分子也可以是阴离子。
D、共价键的形成条件是成键原子必须有未成对电子。D
A表示提供孤对电子的原子,叫电子给予体或配体,常为N、O、P、S、卤素的原子或离子
B表示接受电子的原子,叫接受体,一般为过渡金属
②形成配位键的条件:一个原子提供孤对电子,另一原子提供空轨道例题一:下列分子中的中心原子杂化轨道的类型相同的是 ( )
A.CO2与SO2 B.CH4与NH3
C.BeCl2与BF3 D.C2H2与C2H4B例题二:下列分子或离子中都存在着配位键的是 ( )
A.NH3、H2O B.NH4 + 、H3O+
C.N2、HClO D. [Cu(NH3) 4]2+ 、PCI3B 由于该离子的颜色极似血液,常被用于电影特技和魔术表演。配合物理论简介一、配合物的组成
1. 中心离子或原子(也称形成体) 有空轨道 主要是一些过渡金属,如铁、钴、镍、铜、银、金、铂等金 属元素的离子; 或是具有高氧化数的非金属元素,硼,硅、磷等,如Na[BF4] 中的B(Ⅲ)、K2[SiF6]中的Si(Ⅳ)和NH4[PF6]中的P(Ⅴ); 或是不带电荷的中性原子,如[Ni(CO)4], [Fe(CO)5]中的Ni, Fe都是中性原子, 碱金属、碱土金属等可作为螯合物的形成体。 [Cu(NH3)4]SO4中,NH3是配位体,N为配位原子。2. 配位体和配位原子 有孤对电子a. 单齿配位体(一个配位体中只有一个配位原子)
含氮配位体 NH3 , NCS - ;含硫配位体 SCN- ;
含卤素配位体 F- , Cl- , Br- , I- ; 含碳配位体 CN- , CO
含氧配位体 H2O, OH- ,羧酸,醇,醚等
b. 多齿配位体(有两个或两个以上的配位原子)
乙二胺 NH2一CH2一CH2一NH2 简写为en,
乙二胺四乙酸根(EDTA)等。 3.配位数
与中心离子直接以配位键结合的配位原子个数。例:[AlF6]3- 配位数6 、 [Cu(NH3)4]SO4 配位数4 、
[Co(NH3)2(en)2](NO3)3 配位数6 *中心离子的电荷高,对配位体的吸引力较强,有利于形成配位数较高的配合物。 常见的配位数与中心离子的电荷数有如下的关系:
中心离子的电荷:+1 +2 +3 +4
常见的配位数: 2 4(或6) 6(或4) 6(或8)*中心离子半径越大,其周围可容纳配体就越多,
配位数越大。[AlF6]3- [AlCl4]- [BF4]- [AgI2]- [AgI4]2-
从这些配离子你看出配位数有什么规律? 4. 配离子的电荷配离子的电荷等于中心离子电荷与配位体总电荷的代数和。 如 K2[PtCl4] 8.1.2 配位化合物的命名配位数—配位体名称—合—中心离子(用罗马数字表示氧化数),
用二、三、四等数字表示配位体数。不同配位名称之间用圆点“·”分开。 阴离子次序为:简单离子——复杂离子——有机酸根离子。
中性分子次序为:NH3—H2O—有机分子。 1.配位阴离子配合物--配位阴离子“酸”外界 2.配位阳离子配合物—— “某化某”或“某酸某” 3.中性配合物K2[SiF6] 六氟合硅(Ⅳ)酸钾
K[PtCl5(NH3)] 五氯·一氨合铂(Ⅳ)酸钾[Co(NH3)6]Br3 三溴化六氨合钴(Ⅲ)
[Co(NH3)2(en)2](NO3)3 硝酸二氨·二(乙二胺)合钴(Ⅲ)[PtCl2(NH3)2] 二氯·二氨合铂(Ⅱ)
[Ni(CO)4] 四羰基合镍(0) 配合物的盐与复盐的比较 复盐, 能电离出两种或两种以上阳离子的盐如明矾 KAl(SO4)2·12H2O、光卤石 KCl · MgCl2· 6H2O等,仅在固态时稳定存在,一旦溶于水,几乎全部解离成各组分离子:
KAl(SO4)2·12H2O (溶于水) → K+ +Al3++ 2SO42- +12 H2O
KCl · MgCl2 · 6H2O (溶于水) → K+ +Mg2+ + 3Cl- + 6H2O 配合物盐,是在配合物的溶液或晶体中,十分明确地存在着 含有配位键的、能独立存在的复杂组成的离子:
[Cu(NH3)4]SO4·H2O → [Cu(NH3)4]2+ + SO42- + H2O形成配合物时性质的改变1、颜色的改变
Fe3+ + nNCS- == [Fe(NCS)n](n-3)-2、溶解度的改变:
AgCl + HCl =[AgCl2]- + H+
AgCl + 2NH3 == [Ag(NH3)2]+ + Cl-
Au + HNO3 + 4HCl == H[AuCl4] + NO + 2H2O
3Pt + 4HNO3 + 18HCl = 3H2[PtCl6] + 4NO + 8H2O 例题一:下列分子或离子中都存在着配位键的是 ( )
A.NH3、H2O B.NH4 + 、H3O+
C.N2、HClO D. [Cu(NH3) 4]2+ 、PCI3B 例题二:下列各种说法中错误的是( )
A、形成配位键的条件是一方有空轨道一方有孤对电子。
B、配位键是一种特殊的共价键。
C、配位化合物中的配体可以是分子也可以是阴离子。
D、共价键的形成条件是成键原子必须有未成对电子。D
