原电池的工作原理学案(附有答案)
图片预览
文档简介
登陆21世纪教育 助您教考全无忧
原电池的工作原理学案
一、课前预习
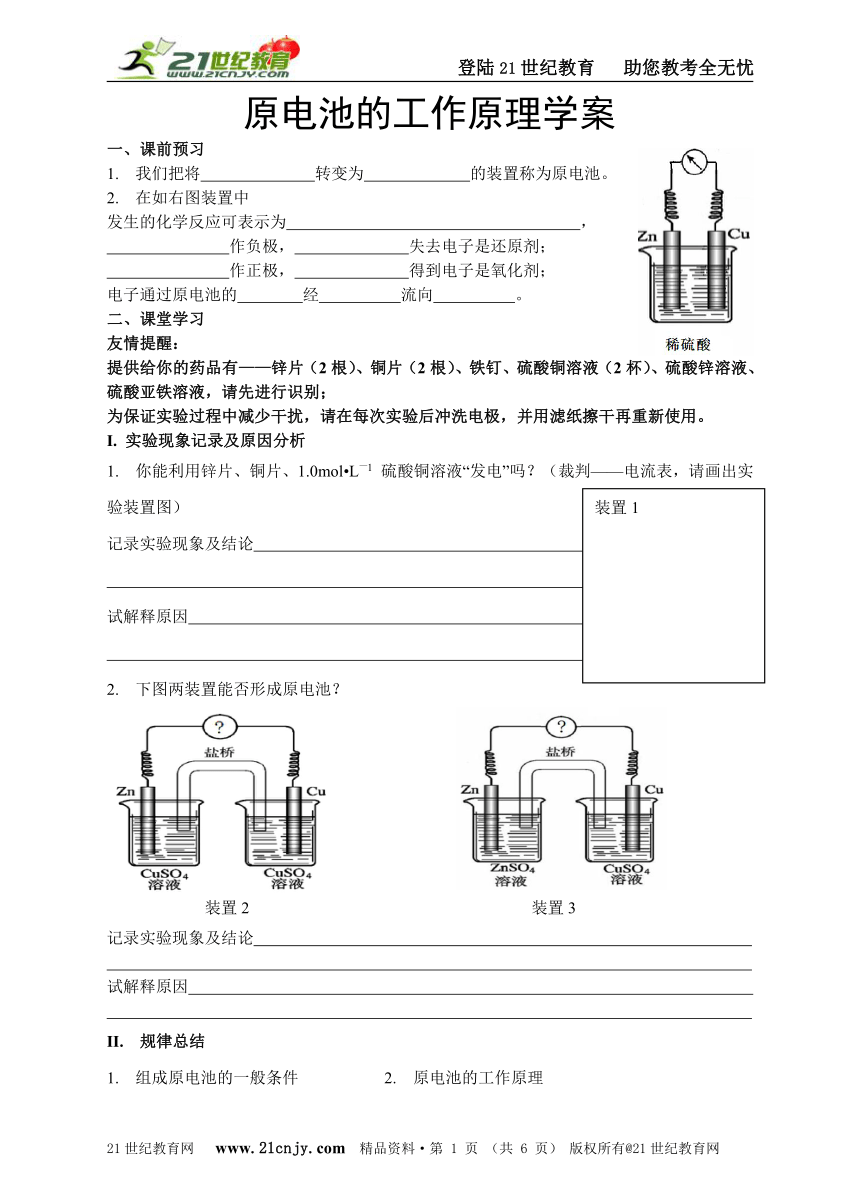
1. 我们把将 转变为 的装置称为原电池。
2. 在如右图装置中
发生的化学反应可表示为 ,
作负极, 失去电子是还原剂;
作正极, 得到电子是氧化剂;
电子通过原电池的 经 流向 。
二、课堂学习
友情提醒:
提供给你的药品有——锌片(2根)、铜片(2根)、铁钉、硫酸铜溶液(2杯)、硫酸锌溶液、硫酸亚铁溶液,请先进行识别;
为保证实验过程中减少干扰,请在每次实验后冲洗电极,并用滤纸擦干再重新使用。
I. 实验现象记录及原因分析
1. 你能利用锌片、铜片、1.0mol L—1 硫酸铜溶液“发电”吗?(裁判——电流表,请画出实验装置图)
记录实验现象及结论
试解释原因
2. 下图两装置能否形成原电池?
装置2 装置3
记录实验现象及结论
试解释原因
II. 规律总结
1. 组成原电池的一般条件 2. 原电池的工作原理
III. 活动与探究
1. 请根据离子反应Fe + Cu2+ = Fe2+ + Cu设计一个原电池,并与同学讨论解决下列问题
① 请画出原电池构造示意图,指出正、负极
② 写出该原电池的电极反应式、电池反应方程式
③ 制作上述原电池并进行实验
2. 请你在下列三个反应中任选一个将其设计为原电池,并指出在正、负极发生反应的物质 正极反应物质 负极反应物质
① Cu + 2Fe3+ = Cu2+ + 2Fe2+
② Li + MnO2 = LiMnO2
③ 2H2 + O2 = 2H2O
IV. 课堂练习
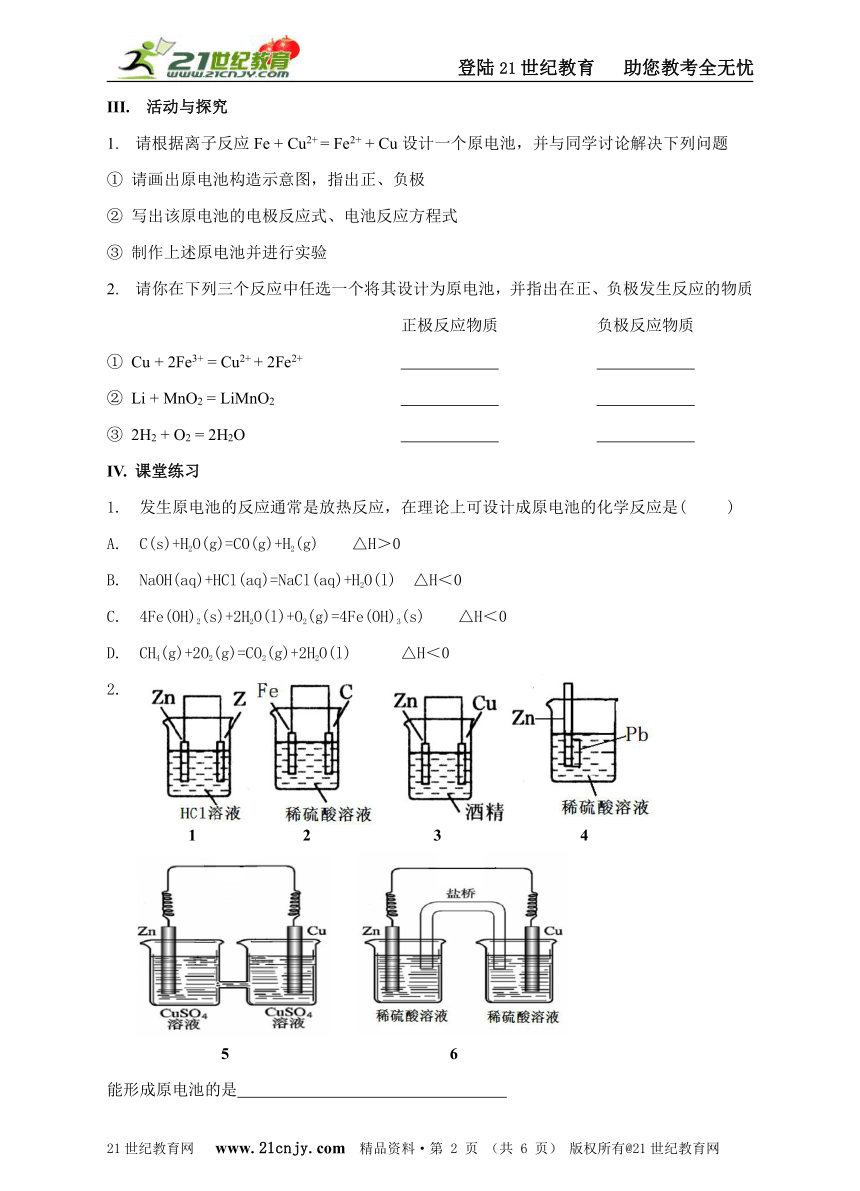
1. 发生原电池的反应通常是放热反应,在理论上可设计成原电池的化学反应是( )
A. C(s)+H2O(g)=CO(g)+H2(g) △H>0
B. NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) △H<0
C. 4Fe(OH)2(s)+2H2O(l)+O2(g)=4Fe(OH)3(s) △H<0
D. CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H<0
2.
1 2 3 4
5 6
能形成原电池的是
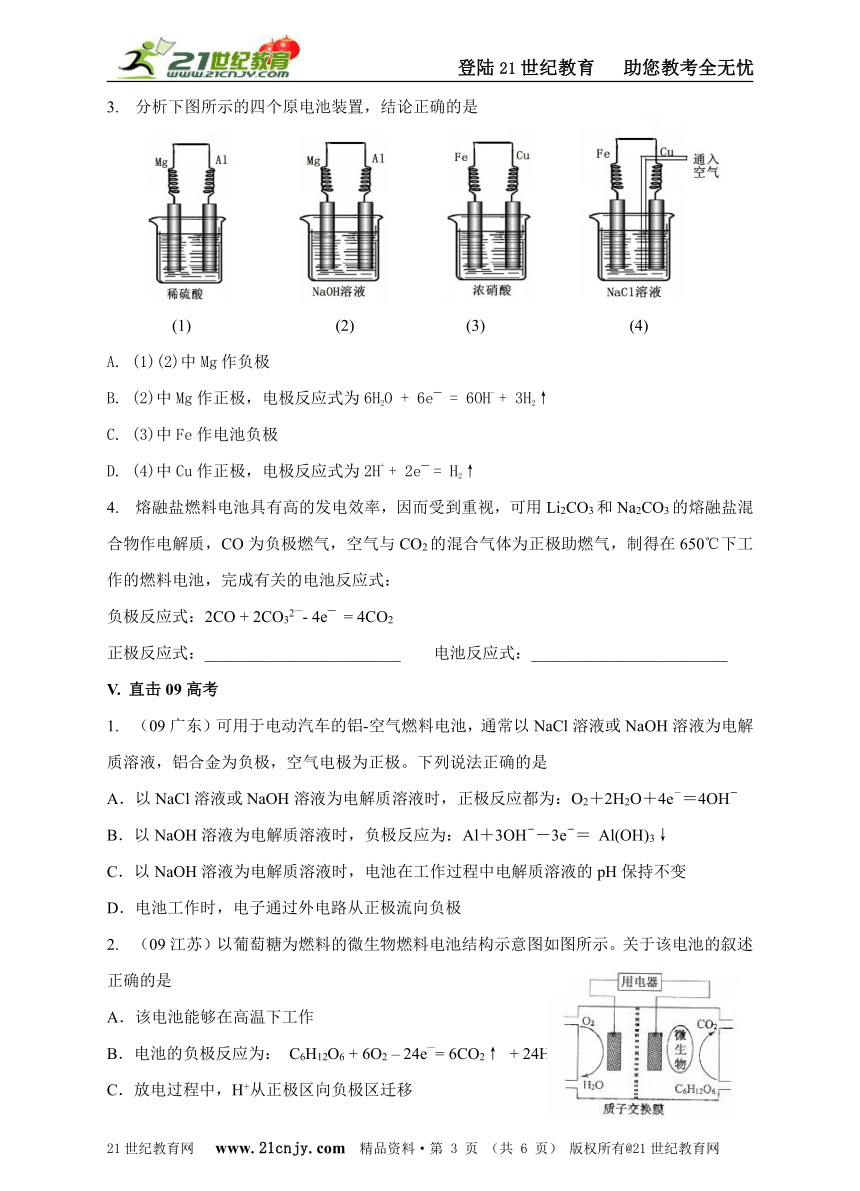
3. 分析下图所示的四个原电池装置,结论正确的是
(1) (2) (3) (4)
A. (1)(2)中Mg作负极
B. (2)中Mg作正极,电极反应式为6H2O + 6e— = 6OH- + 3H2↑
C. (3)中Fe作电池负极
D. (4)中Cu作正极,电极反应式为2H+ + 2e— = H2↑
4. 熔融盐燃料电池具有高的发电效率,因而受到重视,可用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为负极燃气,空气与CO2的混合气体为正极助燃气,制得在650℃下工作的燃料电池,完成有关的电池反应式:
负极反应式:2CO + 2CO32—- 4e— = 4CO2
正极反应式:________________________ 电池反应式:________________________
V. 直击09高考
1. (09广东)可用于电动汽车的铝-空气燃料电池,通常以NaCl溶液或NaOH溶液为电解质溶液,铝合金为负极,空气电极为正极。下列说法正确的是
A.以NaCl溶液或NaOH溶液为电解质溶液时,正极反应都为:O2+2H2O+4e-=4OH-
B.以NaOH溶液为电解质溶液时,负极反应为:Al+3OH--3e-= Al(OH)3↓
C.以NaOH溶液为电解质溶液时,电池在工作过程中电解质溶液的pH保持不变
D.电池工作时,电子通过外电路从正极流向负极
2. (09江苏)以葡萄糖为燃料的微生物燃料电池结构示意图如图所示。关于该电池的叙述正确的是
A.该电池能够在高温下工作
B.电池的负极反应为: C6H12O6 + 6O2 – 24e—= 6CO2↑ + 24H+
C.放电过程中,H+从正极区向负极区迁移
D.在电池反应中,每消耗1mol氧气,理论上能生成标准状况下CO2气体 22.4/6 L
3. (09海南)Li—SOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是LiAlCl4—SOCl2。电池的总反应可表示为:4Li + 2SOCl2 = 4LiCl +S +SO2。请回答下列问题:
(1)电池的负极材料为 ,发生的电极反应为 ;
(2)电池正极发生的电极反应为 ;
(3)SOCl2易挥发,实验室中常用 NaOH 溶液吸收 SOCl2,有Na2SO3和NaCl生成。 如果把少量水滴到SOCl2中,实验现象是 ,
反应的化学方程式为 ;
(4)组装该电池必须在无水、无氧的条件下进行,原因是 。
三、课后作业
课本第21页 第4题
四、课后思考
如图装置能否形成原电池?为什么?
装置4 装置5
参考答案:
一、1.化学能 电能
2.Zn+H2SO4=ZnSO4+H2↑ 锌片 锌 铜片 氢离子 锌极 导线 铜极
二、I.
1.锌片表面有气泡且逐渐溶解 铜片表面产生气泡 电流计指针发生偏转。
铜片表面产生气泡的原因是由于氢离子在铜片表面得到电子转化为氢气,电
流计指针偏转是由于电子在定向通过电流计,证明实验中产生了电流。
装置图为:
2.电流计指针发生偏转,都能产生电流
装置2中因左半部分相当于铜锌简易原电池,右半部分相当于精炼铜的电解装置,右图为构造原电池。两个装置都符合原电池的构成条件。
II. 规律总结
组成原电池的一般条件是:两个活动性不同的电极并用导线相连(不同金属或金属和非金属如炭棒)、电解质溶液、构成闭合回路、有自发进行的氧化还原反应。
工作原理:
负极: 锌片 Zn-2e-=Zn2+
正极: 铜片 2H++2e-=H2↑
电池反应方程式为:Zn+H2SO4=ZnSO4+H2↑
III. 活动与探究
1.装置如右图:
负极: 铁片 Fe-2e-=Fe2+
正极: 铜片 Cu2++2e-=Cu
电池反应方程式为:Fe+CuCl2=Cu+FeCl2
2.
正极反应物质 负极反应物质
① C Cu
② C Li
③ C C
IV. 课堂练习
1.CD 理由:必须为自发进行的氧化还原反应
2.2、4、5、6
3.B
4.正极反应式:2CO2+O2+4e-=2CO32-电池反应式为:2CO+O2=2CO2
V. 直击09高考
1.A 【解析】电解质溶液显碱性或中性, 该燃料电极的正极发生反应为:O2+2H2O+4e-=4OH-,A对;铝作负极,负极反应应该是铝失去电子变为铝离子,在氢氧化钠的溶液中铝离子继续与过量的碱反应生成偏铝酸根,因此负极反应为:Al+4OH--3e=AlO2——+ 2H2O,B错; 该电池在碱性条件下消耗了碱,反应式为4Al+3O2+4OH-= 4AlO2——+ 2H2O溶液PH降低,C错;电池工作时,电子从负极出来经过外电路流到正极,D错.
2.B 【解析】A项,高温条件下微生物会变性,所以A错;B项,负极是葡萄糖失电子生成二氧化碳,所以B对;C项,原电池内部阳离子应向正极移动,所以C错;D项,消耗1mol氧气生成1mol二氧化碳,标准状况下体积是22.4L,D错。
3.(1)负极材料为Li(还原剂),Li – e- = Li+
(2)2SOCl2 + 4 e- = 4Cl- + S + SO2
(3)出现白雾,有刺激性气体生成SOCl2 + H2O = SO2 ↑+ 2HCl↑
(4)因为构成电池的两个主要成份Li能和氧气水反应,且SOCl2也与水反应
【解析】分析反应的化合价变化,可得Li为还原剂 ,SOCl2为氧化剂。
(1)负极材料为Li(还原剂),Li – e- = Li+
(2)负极反应式可由总反应减去负极反应式得到:2SOCl2 + 4 e- = 4Cl- + S + SO2
(3)题中给出有碱液吸收时的产物,则没有碱液吸收时的产物应为SO2和HCl,所以现象应该为出现白雾和有刺激性气体生成。
(4)因为构成电池的两个主要成份Li能和氧气水反应,且SOCl2也与水反应
四、课后思考
两种装置都能形成原电池,都符合原电池构成的条件。
装置1
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网 www.21cnjy.com 精品资料·第 6 页 (共 6 页) 版权所有@21世纪教育网
原电池的工作原理学案
一、课前预习
1. 我们把将 转变为 的装置称为原电池。
2. 在如右图装置中
发生的化学反应可表示为 ,
作负极, 失去电子是还原剂;
作正极, 得到电子是氧化剂;
电子通过原电池的 经 流向 。
二、课堂学习
友情提醒:
提供给你的药品有——锌片(2根)、铜片(2根)、铁钉、硫酸铜溶液(2杯)、硫酸锌溶液、硫酸亚铁溶液,请先进行识别;
为保证实验过程中减少干扰,请在每次实验后冲洗电极,并用滤纸擦干再重新使用。
I. 实验现象记录及原因分析
1. 你能利用锌片、铜片、1.0mol L—1 硫酸铜溶液“发电”吗?(裁判——电流表,请画出实验装置图)
记录实验现象及结论
试解释原因
2. 下图两装置能否形成原电池?
装置2 装置3
记录实验现象及结论
试解释原因
II. 规律总结
1. 组成原电池的一般条件 2. 原电池的工作原理
III. 活动与探究
1. 请根据离子反应Fe + Cu2+ = Fe2+ + Cu设计一个原电池,并与同学讨论解决下列问题
① 请画出原电池构造示意图,指出正、负极
② 写出该原电池的电极反应式、电池反应方程式
③ 制作上述原电池并进行实验
2. 请你在下列三个反应中任选一个将其设计为原电池,并指出在正、负极发生反应的物质 正极反应物质 负极反应物质
① Cu + 2Fe3+ = Cu2+ + 2Fe2+
② Li + MnO2 = LiMnO2
③ 2H2 + O2 = 2H2O
IV. 课堂练习
1. 发生原电池的反应通常是放热反应,在理论上可设计成原电池的化学反应是( )
A. C(s)+H2O(g)=CO(g)+H2(g) △H>0
B. NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) △H<0
C. 4Fe(OH)2(s)+2H2O(l)+O2(g)=4Fe(OH)3(s) △H<0
D. CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H<0
2.
1 2 3 4
5 6
能形成原电池的是
3. 分析下图所示的四个原电池装置,结论正确的是
(1) (2) (3) (4)
A. (1)(2)中Mg作负极
B. (2)中Mg作正极,电极反应式为6H2O + 6e— = 6OH- + 3H2↑
C. (3)中Fe作电池负极
D. (4)中Cu作正极,电极反应式为2H+ + 2e— = H2↑
4. 熔融盐燃料电池具有高的发电效率,因而受到重视,可用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为负极燃气,空气与CO2的混合气体为正极助燃气,制得在650℃下工作的燃料电池,完成有关的电池反应式:
负极反应式:2CO + 2CO32—- 4e— = 4CO2
正极反应式:________________________ 电池反应式:________________________
V. 直击09高考
1. (09广东)可用于电动汽车的铝-空气燃料电池,通常以NaCl溶液或NaOH溶液为电解质溶液,铝合金为负极,空气电极为正极。下列说法正确的是
A.以NaCl溶液或NaOH溶液为电解质溶液时,正极反应都为:O2+2H2O+4e-=4OH-
B.以NaOH溶液为电解质溶液时,负极反应为:Al+3OH--3e-= Al(OH)3↓
C.以NaOH溶液为电解质溶液时,电池在工作过程中电解质溶液的pH保持不变
D.电池工作时,电子通过外电路从正极流向负极
2. (09江苏)以葡萄糖为燃料的微生物燃料电池结构示意图如图所示。关于该电池的叙述正确的是
A.该电池能够在高温下工作
B.电池的负极反应为: C6H12O6 + 6O2 – 24e—= 6CO2↑ + 24H+
C.放电过程中,H+从正极区向负极区迁移
D.在电池反应中,每消耗1mol氧气,理论上能生成标准状况下CO2气体 22.4/6 L
3. (09海南)Li—SOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是LiAlCl4—SOCl2。电池的总反应可表示为:4Li + 2SOCl2 = 4LiCl +S +SO2。请回答下列问题:
(1)电池的负极材料为 ,发生的电极反应为 ;
(2)电池正极发生的电极反应为 ;
(3)SOCl2易挥发,实验室中常用 NaOH 溶液吸收 SOCl2,有Na2SO3和NaCl生成。 如果把少量水滴到SOCl2中,实验现象是 ,
反应的化学方程式为 ;
(4)组装该电池必须在无水、无氧的条件下进行,原因是 。
三、课后作业
课本第21页 第4题
四、课后思考
如图装置能否形成原电池?为什么?
装置4 装置5
参考答案:
一、1.化学能 电能
2.Zn+H2SO4=ZnSO4+H2↑ 锌片 锌 铜片 氢离子 锌极 导线 铜极
二、I.
1.锌片表面有气泡且逐渐溶解 铜片表面产生气泡 电流计指针发生偏转。
铜片表面产生气泡的原因是由于氢离子在铜片表面得到电子转化为氢气,电
流计指针偏转是由于电子在定向通过电流计,证明实验中产生了电流。
装置图为:
2.电流计指针发生偏转,都能产生电流
装置2中因左半部分相当于铜锌简易原电池,右半部分相当于精炼铜的电解装置,右图为构造原电池。两个装置都符合原电池的构成条件。
II. 规律总结
组成原电池的一般条件是:两个活动性不同的电极并用导线相连(不同金属或金属和非金属如炭棒)、电解质溶液、构成闭合回路、有自发进行的氧化还原反应。
工作原理:
负极: 锌片 Zn-2e-=Zn2+
正极: 铜片 2H++2e-=H2↑
电池反应方程式为:Zn+H2SO4=ZnSO4+H2↑
III. 活动与探究
1.装置如右图:
负极: 铁片 Fe-2e-=Fe2+
正极: 铜片 Cu2++2e-=Cu
电池反应方程式为:Fe+CuCl2=Cu+FeCl2
2.
正极反应物质 负极反应物质
① C Cu
② C Li
③ C C
IV. 课堂练习
1.CD 理由:必须为自发进行的氧化还原反应
2.2、4、5、6
3.B
4.正极反应式:2CO2+O2+4e-=2CO32-电池反应式为:2CO+O2=2CO2
V. 直击09高考
1.A 【解析】电解质溶液显碱性或中性, 该燃料电极的正极发生反应为:O2+2H2O+4e-=4OH-,A对;铝作负极,负极反应应该是铝失去电子变为铝离子,在氢氧化钠的溶液中铝离子继续与过量的碱反应生成偏铝酸根,因此负极反应为:Al+4OH--3e=AlO2——+ 2H2O,B错; 该电池在碱性条件下消耗了碱,反应式为4Al+3O2+4OH-= 4AlO2——+ 2H2O溶液PH降低,C错;电池工作时,电子从负极出来经过外电路流到正极,D错.
2.B 【解析】A项,高温条件下微生物会变性,所以A错;B项,负极是葡萄糖失电子生成二氧化碳,所以B对;C项,原电池内部阳离子应向正极移动,所以C错;D项,消耗1mol氧气生成1mol二氧化碳,标准状况下体积是22.4L,D错。
3.(1)负极材料为Li(还原剂),Li – e- = Li+
(2)2SOCl2 + 4 e- = 4Cl- + S + SO2
(3)出现白雾,有刺激性气体生成SOCl2 + H2O = SO2 ↑+ 2HCl↑
(4)因为构成电池的两个主要成份Li能和氧气水反应,且SOCl2也与水反应
【解析】分析反应的化合价变化,可得Li为还原剂 ,SOCl2为氧化剂。
(1)负极材料为Li(还原剂),Li – e- = Li+
(2)负极反应式可由总反应减去负极反应式得到:2SOCl2 + 4 e- = 4Cl- + S + SO2
(3)题中给出有碱液吸收时的产物,则没有碱液吸收时的产物应为SO2和HCl,所以现象应该为出现白雾和有刺激性气体生成。
(4)因为构成电池的两个主要成份Li能和氧气水反应,且SOCl2也与水反应
四、课后思考
两种装置都能形成原电池,都符合原电池构成的条件。
装置1
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网 www.21cnjy.com 精品资料·第 6 页 (共 6 页) 版权所有@21世纪教育网
