高二化学月考试题
图片预览



文档简介
高二化学月考试题
说明:1、本试卷分第I卷(选择题)和第II卷(非选择题)两部分。考试时间90分钟,满分100分。
2、可能用到的原子量:H 1 C 12 N 14 O 16 Na 23 Cu 64 Al 27 S 32 Cl 35.5
第Ⅰ卷(共42分)
一、选择题(本题包括6小题,每小题3分,共18分,每小题只有一个选项符合题意)
1.在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ,下列热化学方程式正确的是( )
A.CH3OH(l) + 3/2O2(g) == CO2(g) + 2H2O(l);△H=+725.8kJ/mol
B.2CH3OH(l) + 3O2(g) == 2CO2(g) + 4H2O(l);△H=-1452kJ/mol
C.2CH3OH(l) + 3O2(g) == 2CO2(g) + 4H2O(l);△H=-725.8kJ/mol
D.2CH3OH(l) + 3O2(g) ==2 CO2(g) + 4H2O(l);△H=+1452kJ/mol
2.100℃时,将0.1 mol N2O4置于1L密闭的烧瓶中,然后将烧瓶放入100℃ 的恒温槽中,烧瓶内的气体逐渐变为红棕色:N2O4(g) 2NO2 (g)。下列结论不能说明上述反应在该条件下已经达到平衡状态的是
①N2O4的消耗速率与NO2的生成速率之比为1:2 ②NO2生成速率与NO2消耗速率相等
③烧瓶内气体的压强不再变化 ④烧瓶内气体的质量不再变化 ⑤NO2的物质的量浓度不再改变 ⑥烧瓶内气体的颜色不再加深 ⑦烧瓶内气体的平均相对分子质量不再变化 ⑧烧瓶内气体的密度不再变化。
A.②③⑥⑦ B.①④⑧ C.只有①④ D.只有⑦⑧
3.在2L密闭容器中加入4molA和6molB,发生以下反应:4A(g)+6B(g) 4C(g) +5D(g)。若经5s后,剩下的A是2.5mol,则B的反应速率是
A.0.45 mol / (L s)) B.0.15 mol /(L s))
C.0.225 mol /(L s) D.0.9 mol /(L s))
4.下列各组热化学方程式程中,化学反应的△H前者大于后者的是
①C(s)+O2(g)=CO2(g);△H1 C(s)+1/2O2(g)=CO(g);△H2
②S(s)+O2(g)=SO2(g);△H3 S(g)+O2(g)=SO2(g);△H4
③H2(s)+1/2O2(g)=H2O(g);△H5 H2(g)+O2(g)=2H2O(l);△H6
④CaCO3(s)=CaO(s)+CO2(g);△H7 CaO(s)+H2O(l)=Ca(OH)2(s);△H8
A. ① B. ④ C. ②③④ D. ①②③
5.在一定体积pH=12的Ba(OH)2溶液中,逐滴加入一定物质的量浓度的NaHSO4溶液,当溶液中的Ba2+恰好完全沉淀时,溶液pH=11。若反应后溶液的体积等于Ba(OH)2溶液与NaHSO4溶液的体积之和,则Ba(OH)2溶液与NaHSO4溶液的体积比是
A. 1∶9 B. 1∶1 C. 1∶2 D. 1∶4
6.pH=1的两种酸溶液A、B各1mL,分别加水稀释到1000mL,其pH与溶液体积(V)的关系如图示,
下列说法不正确的是( )
A.A、B两种酸溶液的物质的量浓度一定相等
B.稀释后,A酸溶液的酸性比B酸溶液弱
C.若a=4,则A是强酸,B是弱酸
D.若1二.选择题(本题包括6小题,每小题4分,共24分,每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得4分,但只要选错一个,该小题就为0分)
7.一定温度下,在恒容密闭容器中发生如下反应:2A(g)+B(g)3C(g),若反应开始时充入2 mol A和2 mol B,达平衡后A的体积分数为a%。其他条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数大于a%的是:
A. 2 mol C B. 2 mol A 1 mol B和1 mol He(不参加反应)
C. 1 mol B和1 mol C D. 2 mol A 3 mol B和3 mol C
8.室温下,下列溶液等体积混合后,所得溶液的pH一定大于7的是
A 0.1mol/L的盐酸和0.1mol/L的氢氧化钠溶液
B 0.1mol/L的盐酸和0.1mol/L的氢氧化钡溶液
C pH=4的醋酸溶液和pH=10的氢氧化钠溶液
D pH=4的盐酸和pH=l0的氨水
9.右图是温度和压强对X+Y2Z反应
影响的示意图。图中横坐标表示平衡混合气
体中Z的体积分数。下列叙述正确的是
A.X和Y中只有一种为气态,Z为气态
B.X、Y、Z均为气态
C.上述可逆反应的正反应为放热反应
D.上述可逆反应的正反应的ΔH>0
10.为确定某溶液的离子组成,进行如下实验:
①测定溶液的pH,溶液显强碱性。
②取少量溶液加入稀盐酸至溶液呈酸性,产生无刺激性、能使澄清石灰水变浑浊的气体。
③在上述溶液中再滴加Ba(NO3)2溶液,产生白色沉淀。
④取上层清液继续滴加Ba(NO3)2溶液至无沉淀时,再滴加Ag NO3溶液,产生白色沉淀。
根据实验以下推测正确的是
A.一定有SO32-离子 B.一定有CO32-离子
C.不能确定Cl-离子是否存在 D.不能确定HCO3-离子是否存在
11.一定能在下列溶液中大量共存的离子组是
A. 含有大量Al3+的溶液:Na+、NH4+、SO42-、Cl-
B. c(H+)=1×10—13mol·L—1的溶液:Na+、Ca2+、SO42-、CO32-
C. 含有大量Fe3+的溶液:Na+、Mg2+、NO3-、SCN-
D. 含有大量NO3-的溶液:H+、Fe2+、SO42-、Cl-
12.关于小苏打水溶液的表述正确的是
A cNa+=c+c+cH2CO3
B cNa++cH+=c+c+cOH
C 的电离程度大于的水解程度
D 存在的电离有:NaHCO3=Na++,+H+。
H2OH++OH
第Ⅱ卷(共58分)
13.ⅰ.(12分)某学生为测定未知浓度的硫酸溶液,实验如下:用1.00mL待测硫酸配制100 mL稀H2SO4溶液;以0.14mol/L的NaOH溶液滴定上述稀 H2SO425mL,滴定终止时消耗NaOH溶液15mL。
(1)该学生用标准0.14 mol/L NaOH溶液滴定硫酸的实验操作如下:
A.用酸式滴定管取稀H2SO4 25 mL,注入锥形瓶中,加入指示剂。
B.用待测定的溶液润洗酸式滴定管。
C.用蒸馏水洗干净滴定管。
D.取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管刻度“0”以上2~3 cm处,再把碱式滴定管固定好,调节液面至刻度“0”或“0”刻度以下。
E.检查滴定管是否漏水。
F.另取锥形瓶,再重复操作一次。
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度。
①滴定操作的正确顺序是(用序号填写): 。
②该滴定操作中应选用的指示剂是: 。
③在G操作中如何确定终点
。
(2)碱式滴定管用蒸馏水润洗后,未用标准液润洗导致滴定结果(填“偏小”、“偏大”或“恰好合适”) ,原因是 。
(3)计算待测硫酸(稀释前的硫酸)溶液的物质的量浓度为 mol/L(计算出结果到小数点后二位)
ⅱ.(10分)已知:(A)Cu2+,Fe2+在pH值为4~5的条件中不水解而Fe3+却几乎全部水解;
(B) 双氧水(H2O2)是强氧化剂,在酸性条件下,它的还原产物是H2O。
用粗氧化铜(CuO中含少量Fe)制取CuCl2溶液过程如下:
① 取50毫升纯净的盐酸,加入一定量的粗CuO,加热搅拌,充分反应后过滤,经测定溶液的pH值是3
② 向滤液中加入双氧水,搅拌。
③ 向②中加入过量纯CuO,微热,搅拌,此时测定溶液的pH值为4,过滤。
④ 把③所得滤液浓缩。
填空:
(I)②中发生反应的离子方程式是__________ ___________________。
(Ⅱ)③中过滤后滤渣的成分是__________________________________。
(Ⅲ)①③中如何用pH试纸测定溶液的pH值:
_____________ ___________________。
(Ⅳ)③中pH值升高的原因是:____________ _____________。(用离子式表示)
14.(12分)(1)把NH4Cl晶体溶入水中,得到饱和NH4Cl溶液。若在该溶液中加入镁条,则观察到有气泡产生,点燃有爆鸣声,此气体是 ,产生该气体的原因是
__________________(用离子方程式表示)。微热后,能放出有刺激性气味的气体,它能使湿润的红色石蕊试纸变蓝,该气体是 。
(2)已知下列化学键的键能: C-H:416 kJ/mol; C-C:342 kJ/mol;C=C:613kJ/mol,H-H:436 kJ/mol,则反应CH3-CH3(g)=C2H4(g)+H2(g)的反应热△H = 。
(3)pH=12的NaOH溶液100mL,要使它的pH为11。(体积变化忽略不计)
①如果加入蒸馏水,应加 mL;
②如果加入pH=10的NaOH溶液,应加 mL;
③如果加0.01mol/L HCl,应加 mL。
15.(14分)在一定条件下,二氧化硫和氧气发生如
下反应: 2SO2(g)+ O2 (g) 2SO3(g);△H<0
(1)写出该反应的化学平衡常数表达式
K=
(2)降低温度,该反应K值 ,二氧化硫转化率 ,化学反应速率 。(以上均填增大、减小或不变)
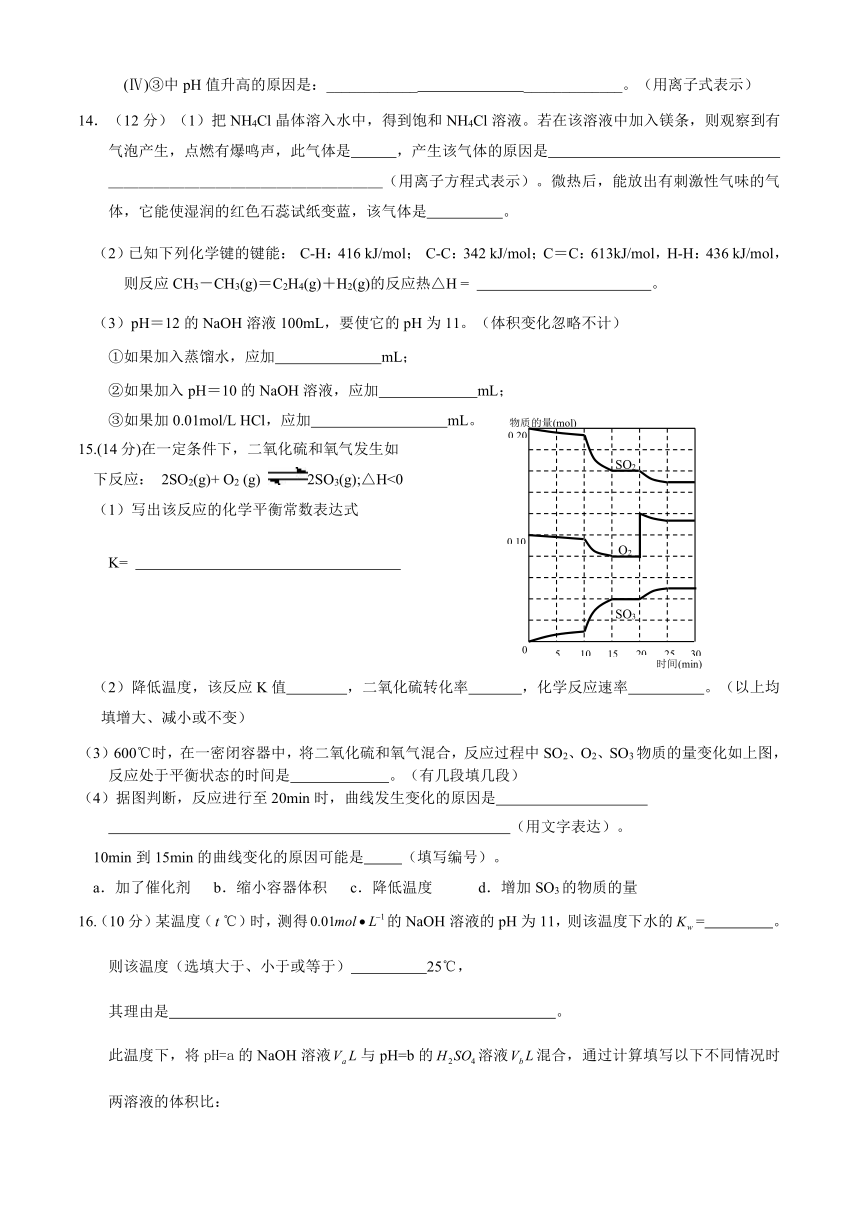
(3)600℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如上图,反应处于平衡状态的时间是 。(有几段填几段)
(4)据图判断,反应进行至20min时,曲线发生变化的原因是
(用文字表达)。
10min到15min的曲线变化的原因可能是 (填写编号)。
a.加了催化剂 b.缩小容器体积 c.降低温度 d.增加SO3的物质的量
16.(10分)某温度(℃)时,测得的NaOH溶液的pH为11,则该温度下水的= 。则该温度(选填大于、小于或等于) 25℃,
其理由是 。
此温度下,将pH=a的NaOH溶液与pH=b的溶液混合,通过计算填写以下不同情况时两溶液的体积比:
(1)若所得混合液为中性,且a=12,b=2,则= ;
(2)若所得混合液为中性,且a+b=12,则= ;
(3)若所得混合液的pH=10,且a=12,b=2,则= ;
高二化学第二次月考试题参考答案(2009-12)
第Ⅰ卷(共42分)
一、二 选择题(共42分)
1 2 3 4 5 6 7 8 9 10 11 12
B B C C D A AB B D AD BC A A D
第Ⅱ卷(共58分)
13.ⅰ(12分)答案:(1)①ECDBAGF 3分 ②酚酞 1分③滴入最后一滴NaOH溶液,溶液突然变成浅红色,且半分钟不褪色 2分 (2)偏大 1分 滴定管内壁上的水膜,将标准液稀释,使体积读数偏大 2分 (3)4.20 3分
ⅱ.(10分)(Ⅰ)2Fe2++H2O2+2H+=2Fe3++2H2O, (2分)(Ⅱ) CuO, Fe(OH) 3 , (2分) (Ⅲ)取一张pH试纸,放在洁净的玻璃片上(1分),用洁净的玻璃棒蘸取待测液沾在试纸的中部(1分),待一会儿(1分),与标准比色卡对比,测出其pH(1分),记下数值。(Ⅳ)CuO+2H+=Cu2++H2O (2分)
14.(12分)(1)H2 (1分)NH4++H2O NH3·H2O+H+ (1分),Mg+2 H+=Mg2++H2↑(1分);NH3 (1分)(2)125KJ∕mol (2分) (3)① 900 (2分)② 1000 (2分)③ 81.8 (2分)
15(14分)(1) K=C2(SO3)/(C2(SO2)·C(O2) (2分) (2)增大 增大 减慢 (6分) (3) 15~20min (1分) 25~30min(1分) (4)增大O2的物质的量 (2分)a b(2分)
16.10分)
;(1分)大于;(1分)水的电离是吸热的,升温促进水的电离,Kw增大,因该温度下的Kw大于25℃时水的;所以该温度大于25℃。(2分)
(1)1∶10 (2分) (2)10∶1(2分) (3)1∶9(2分)
高二化学第二次月考试题答卷
(考试时间:90分钟 总分值:100分)
一、选择题(本题共6小题,每小题3分,共18分。每小题只有一个选项符合题意。)
1 2 3 4 5 6
二、选择题(本题共6小题,每题4分,共24分。每小题有一个或两个选项符合题意。)
7 8 9 10 11 12
第II卷(非选择题 共58分)
三、本题包括3小题,共32分
13.a(1)①滴定操作的正确顺序是(用序号填写):
②该滴定操作中应选用的指示剂是:
③在G操作中如何确定终点
。
;
(2) ,原因是 。
(3)计算待测硫酸(稀释前的硫酸)溶液的物质的量浓度为 mol/L(计算出结果到小数点后二位)
b.(I) 。
(Ⅱ)__________________________________。
(Ⅲ) _____________ ___________________。
(Ⅳ) ____________ _____________ _____________。
14.(12分)(1) ,
__________________(用离子方程式表示)。 。
(2)△H = 。
(3)① mL;
② mL;
③ mL。
15.(14分)
(1) K=
(2) , , 。(以上均填增大、减小或不变)
(3) 。(有几段填几段)
(4) (用文字表达)。
(填写编号)。
16.(10分)= 。
。
(1)= ;
(2)= ;
(3)= ;
1000/mL
pH
物质的量(mol)
时间(min)
0
0.10
0.20
5
105
15
20
25
30
SO2
O2
SO3
班级 姓名 座号
说明:1、本试卷分第I卷(选择题)和第II卷(非选择题)两部分。考试时间90分钟,满分100分。
2、可能用到的原子量:H 1 C 12 N 14 O 16 Na 23 Cu 64 Al 27 S 32 Cl 35.5
第Ⅰ卷(共42分)
一、选择题(本题包括6小题,每小题3分,共18分,每小题只有一个选项符合题意)
1.在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ,下列热化学方程式正确的是( )
A.CH3OH(l) + 3/2O2(g) == CO2(g) + 2H2O(l);△H=+725.8kJ/mol
B.2CH3OH(l) + 3O2(g) == 2CO2(g) + 4H2O(l);△H=-1452kJ/mol
C.2CH3OH(l) + 3O2(g) == 2CO2(g) + 4H2O(l);△H=-725.8kJ/mol
D.2CH3OH(l) + 3O2(g) ==2 CO2(g) + 4H2O(l);△H=+1452kJ/mol
2.100℃时,将0.1 mol N2O4置于1L密闭的烧瓶中,然后将烧瓶放入100℃ 的恒温槽中,烧瓶内的气体逐渐变为红棕色:N2O4(g) 2NO2 (g)。下列结论不能说明上述反应在该条件下已经达到平衡状态的是
①N2O4的消耗速率与NO2的生成速率之比为1:2 ②NO2生成速率与NO2消耗速率相等
③烧瓶内气体的压强不再变化 ④烧瓶内气体的质量不再变化 ⑤NO2的物质的量浓度不再改变 ⑥烧瓶内气体的颜色不再加深 ⑦烧瓶内气体的平均相对分子质量不再变化 ⑧烧瓶内气体的密度不再变化。
A.②③⑥⑦ B.①④⑧ C.只有①④ D.只有⑦⑧
3.在2L密闭容器中加入4molA和6molB,发生以下反应:4A(g)+6B(g) 4C(g) +5D(g)。若经5s后,剩下的A是2.5mol,则B的反应速率是
A.0.45 mol / (L s)) B.0.15 mol /(L s))
C.0.225 mol /(L s) D.0.9 mol /(L s))
4.下列各组热化学方程式程中,化学反应的△H前者大于后者的是
①C(s)+O2(g)=CO2(g);△H1 C(s)+1/2O2(g)=CO(g);△H2
②S(s)+O2(g)=SO2(g);△H3 S(g)+O2(g)=SO2(g);△H4
③H2(s)+1/2O2(g)=H2O(g);△H5 H2(g)+O2(g)=2H2O(l);△H6
④CaCO3(s)=CaO(s)+CO2(g);△H7 CaO(s)+H2O(l)=Ca(OH)2(s);△H8
A. ① B. ④ C. ②③④ D. ①②③
5.在一定体积pH=12的Ba(OH)2溶液中,逐滴加入一定物质的量浓度的NaHSO4溶液,当溶液中的Ba2+恰好完全沉淀时,溶液pH=11。若反应后溶液的体积等于Ba(OH)2溶液与NaHSO4溶液的体积之和,则Ba(OH)2溶液与NaHSO4溶液的体积比是
A. 1∶9 B. 1∶1 C. 1∶2 D. 1∶4
6.pH=1的两种酸溶液A、B各1mL,分别加水稀释到1000mL,其pH与溶液体积(V)的关系如图示,
下列说法不正确的是( )
A.A、B两种酸溶液的物质的量浓度一定相等
B.稀释后,A酸溶液的酸性比B酸溶液弱
C.若a=4,则A是强酸,B是弱酸
D.若1
7.一定温度下,在恒容密闭容器中发生如下反应:2A(g)+B(g)3C(g),若反应开始时充入2 mol A和2 mol B,达平衡后A的体积分数为a%。其他条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数大于a%的是:
A. 2 mol C B. 2 mol A 1 mol B和1 mol He(不参加反应)
C. 1 mol B和1 mol C D. 2 mol A 3 mol B和3 mol C
8.室温下,下列溶液等体积混合后,所得溶液的pH一定大于7的是
A 0.1mol/L的盐酸和0.1mol/L的氢氧化钠溶液
B 0.1mol/L的盐酸和0.1mol/L的氢氧化钡溶液
C pH=4的醋酸溶液和pH=10的氢氧化钠溶液
D pH=4的盐酸和pH=l0的氨水
9.右图是温度和压强对X+Y2Z反应
影响的示意图。图中横坐标表示平衡混合气
体中Z的体积分数。下列叙述正确的是
A.X和Y中只有一种为气态,Z为气态
B.X、Y、Z均为气态
C.上述可逆反应的正反应为放热反应
D.上述可逆反应的正反应的ΔH>0
10.为确定某溶液的离子组成,进行如下实验:
①测定溶液的pH,溶液显强碱性。
②取少量溶液加入稀盐酸至溶液呈酸性,产生无刺激性、能使澄清石灰水变浑浊的气体。
③在上述溶液中再滴加Ba(NO3)2溶液,产生白色沉淀。
④取上层清液继续滴加Ba(NO3)2溶液至无沉淀时,再滴加Ag NO3溶液,产生白色沉淀。
根据实验以下推测正确的是
A.一定有SO32-离子 B.一定有CO32-离子
C.不能确定Cl-离子是否存在 D.不能确定HCO3-离子是否存在
11.一定能在下列溶液中大量共存的离子组是
A. 含有大量Al3+的溶液:Na+、NH4+、SO42-、Cl-
B. c(H+)=1×10—13mol·L—1的溶液:Na+、Ca2+、SO42-、CO32-
C. 含有大量Fe3+的溶液:Na+、Mg2+、NO3-、SCN-
D. 含有大量NO3-的溶液:H+、Fe2+、SO42-、Cl-
12.关于小苏打水溶液的表述正确的是
A cNa+=c+c+cH2CO3
B cNa++cH+=c+c+cOH
C 的电离程度大于的水解程度
D 存在的电离有:NaHCO3=Na++,+H+。
H2OH++OH
第Ⅱ卷(共58分)
13.ⅰ.(12分)某学生为测定未知浓度的硫酸溶液,实验如下:用1.00mL待测硫酸配制100 mL稀H2SO4溶液;以0.14mol/L的NaOH溶液滴定上述稀 H2SO425mL,滴定终止时消耗NaOH溶液15mL。
(1)该学生用标准0.14 mol/L NaOH溶液滴定硫酸的实验操作如下:
A.用酸式滴定管取稀H2SO4 25 mL,注入锥形瓶中,加入指示剂。
B.用待测定的溶液润洗酸式滴定管。
C.用蒸馏水洗干净滴定管。
D.取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管刻度“0”以上2~3 cm处,再把碱式滴定管固定好,调节液面至刻度“0”或“0”刻度以下。
E.检查滴定管是否漏水。
F.另取锥形瓶,再重复操作一次。
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度。
①滴定操作的正确顺序是(用序号填写): 。
②该滴定操作中应选用的指示剂是: 。
③在G操作中如何确定终点
。
(2)碱式滴定管用蒸馏水润洗后,未用标准液润洗导致滴定结果(填“偏小”、“偏大”或“恰好合适”) ,原因是 。
(3)计算待测硫酸(稀释前的硫酸)溶液的物质的量浓度为 mol/L(计算出结果到小数点后二位)
ⅱ.(10分)已知:(A)Cu2+,Fe2+在pH值为4~5的条件中不水解而Fe3+却几乎全部水解;
(B) 双氧水(H2O2)是强氧化剂,在酸性条件下,它的还原产物是H2O。
用粗氧化铜(CuO中含少量Fe)制取CuCl2溶液过程如下:
① 取50毫升纯净的盐酸,加入一定量的粗CuO,加热搅拌,充分反应后过滤,经测定溶液的pH值是3
② 向滤液中加入双氧水,搅拌。
③ 向②中加入过量纯CuO,微热,搅拌,此时测定溶液的pH值为4,过滤。
④ 把③所得滤液浓缩。
填空:
(I)②中发生反应的离子方程式是__________ ___________________。
(Ⅱ)③中过滤后滤渣的成分是__________________________________。
(Ⅲ)①③中如何用pH试纸测定溶液的pH值:
_____________ ___________________。
(Ⅳ)③中pH值升高的原因是:____________ _____________。(用离子式表示)
14.(12分)(1)把NH4Cl晶体溶入水中,得到饱和NH4Cl溶液。若在该溶液中加入镁条,则观察到有气泡产生,点燃有爆鸣声,此气体是 ,产生该气体的原因是
__________________(用离子方程式表示)。微热后,能放出有刺激性气味的气体,它能使湿润的红色石蕊试纸变蓝,该气体是 。
(2)已知下列化学键的键能: C-H:416 kJ/mol; C-C:342 kJ/mol;C=C:613kJ/mol,H-H:436 kJ/mol,则反应CH3-CH3(g)=C2H4(g)+H2(g)的反应热△H = 。
(3)pH=12的NaOH溶液100mL,要使它的pH为11。(体积变化忽略不计)
①如果加入蒸馏水,应加 mL;
②如果加入pH=10的NaOH溶液,应加 mL;
③如果加0.01mol/L HCl,应加 mL。
15.(14分)在一定条件下,二氧化硫和氧气发生如
下反应: 2SO2(g)+ O2 (g) 2SO3(g);△H<0
(1)写出该反应的化学平衡常数表达式
K=
(2)降低温度,该反应K值 ,二氧化硫转化率 ,化学反应速率 。(以上均填增大、减小或不变)
(3)600℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如上图,反应处于平衡状态的时间是 。(有几段填几段)
(4)据图判断,反应进行至20min时,曲线发生变化的原因是
(用文字表达)。
10min到15min的曲线变化的原因可能是 (填写编号)。
a.加了催化剂 b.缩小容器体积 c.降低温度 d.增加SO3的物质的量
16.(10分)某温度(℃)时,测得的NaOH溶液的pH为11,则该温度下水的= 。则该温度(选填大于、小于或等于) 25℃,
其理由是 。
此温度下,将pH=a的NaOH溶液与pH=b的溶液混合,通过计算填写以下不同情况时两溶液的体积比:
(1)若所得混合液为中性,且a=12,b=2,则= ;
(2)若所得混合液为中性,且a+b=12,则= ;
(3)若所得混合液的pH=10,且a=12,b=2,则= ;
高二化学第二次月考试题参考答案(2009-12)
第Ⅰ卷(共42分)
一、二 选择题(共42分)
1 2 3 4 5 6 7 8 9 10 11 12
B B C C D A AB B D AD BC A A D
第Ⅱ卷(共58分)
13.ⅰ(12分)答案:(1)①ECDBAGF 3分 ②酚酞 1分③滴入最后一滴NaOH溶液,溶液突然变成浅红色,且半分钟不褪色 2分 (2)偏大 1分 滴定管内壁上的水膜,将标准液稀释,使体积读数偏大 2分 (3)4.20 3分
ⅱ.(10分)(Ⅰ)2Fe2++H2O2+2H+=2Fe3++2H2O, (2分)(Ⅱ) CuO, Fe(OH) 3 , (2分) (Ⅲ)取一张pH试纸,放在洁净的玻璃片上(1分),用洁净的玻璃棒蘸取待测液沾在试纸的中部(1分),待一会儿(1分),与标准比色卡对比,测出其pH(1分),记下数值。(Ⅳ)CuO+2H+=Cu2++H2O (2分)
14.(12分)(1)H2 (1分)NH4++H2O NH3·H2O+H+ (1分),Mg+2 H+=Mg2++H2↑(1分);NH3 (1分)(2)125KJ∕mol (2分) (3)① 900 (2分)② 1000 (2分)③ 81.8 (2分)
15(14分)(1) K=C2(SO3)/(C2(SO2)·C(O2) (2分) (2)增大 增大 减慢 (6分) (3) 15~20min (1分) 25~30min(1分) (4)增大O2的物质的量 (2分)a b(2分)
16.10分)
;(1分)大于;(1分)水的电离是吸热的,升温促进水的电离,Kw增大,因该温度下的Kw大于25℃时水的;所以该温度大于25℃。(2分)
(1)1∶10 (2分) (2)10∶1(2分) (3)1∶9(2分)
高二化学第二次月考试题答卷
(考试时间:90分钟 总分值:100分)
一、选择题(本题共6小题,每小题3分,共18分。每小题只有一个选项符合题意。)
1 2 3 4 5 6
二、选择题(本题共6小题,每题4分,共24分。每小题有一个或两个选项符合题意。)
7 8 9 10 11 12
第II卷(非选择题 共58分)
三、本题包括3小题,共32分
13.a(1)①滴定操作的正确顺序是(用序号填写):
②该滴定操作中应选用的指示剂是:
③在G操作中如何确定终点
。
;
(2) ,原因是 。
(3)计算待测硫酸(稀释前的硫酸)溶液的物质的量浓度为 mol/L(计算出结果到小数点后二位)
b.(I) 。
(Ⅱ)__________________________________。
(Ⅲ) _____________ ___________________。
(Ⅳ) ____________ _____________ _____________。
14.(12分)(1) ,
__________________(用离子方程式表示)。 。
(2)△H = 。
(3)① mL;
② mL;
③ mL。
15.(14分)
(1) K=
(2) , , 。(以上均填增大、减小或不变)
(3) 。(有几段填几段)
(4) (用文字表达)。
(填写编号)。
16.(10分)= 。
。
(1)= ;
(2)= ;
(3)= ;
1000/mL
pH
物质的量(mol)
时间(min)
0
0.10
0.20
5
105
15
20
25
30
SO2
O2
SO3
班级 姓名 座号
