沉淀溶解平衡课件
图片预览









文档简介
课件36张PPT。沉淀平衡10-1 溶度积原理
10-2 沉淀与溶解
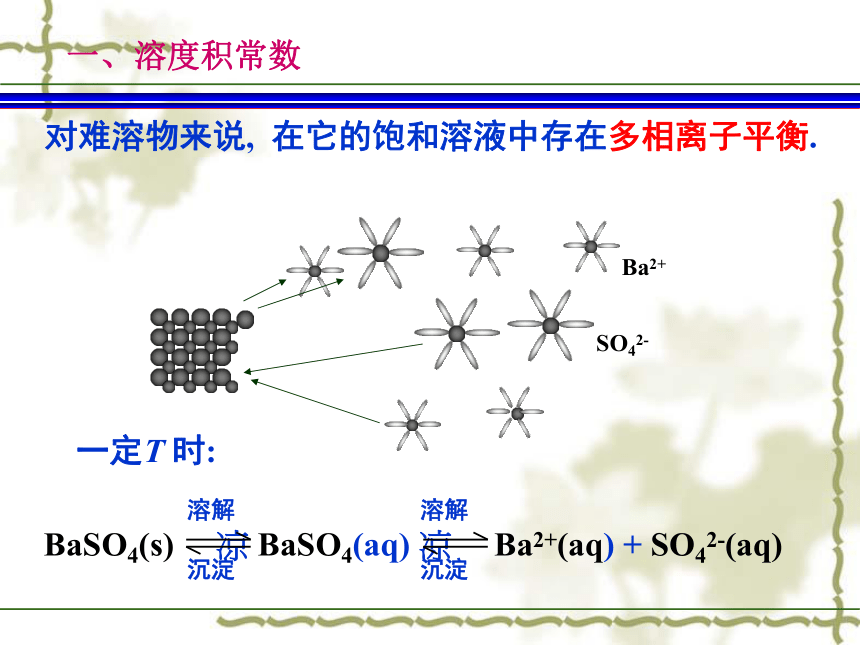
习题§10-1 溶度积原理一般可用溶解度的大小来衡量物质在水中溶解能力的大小. 物质 溶解度(g/100g水)?易溶物> 0.1?微溶物0.01~0.1?难溶物< 0.01 对难溶物来说, 在它的饱和溶液中存在多相离子平衡.一定T 时: 溶解 溶解
BaSO4(s) ? BaSO4(aq) ? Ba2+(aq) + SO42-(aq)
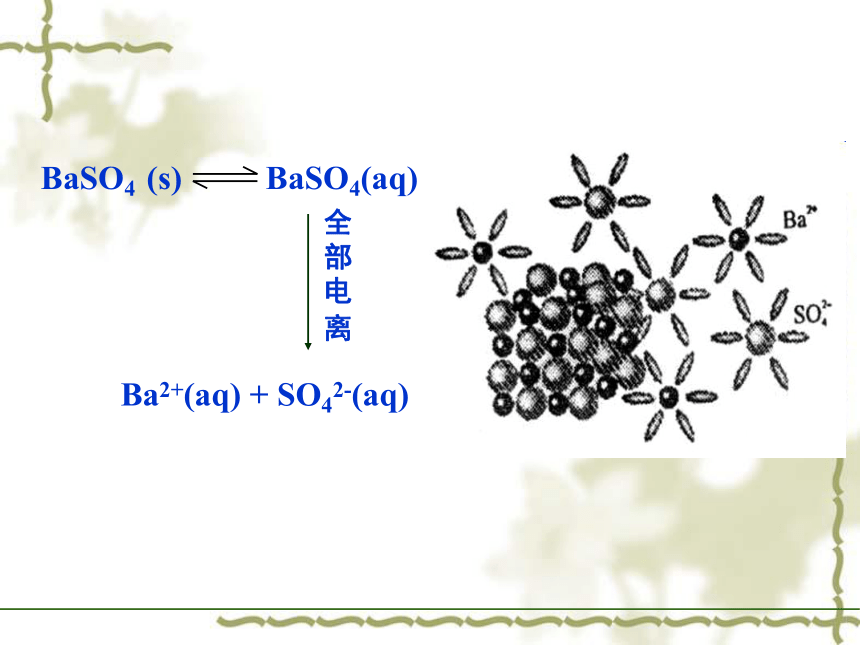
沉淀 沉淀一、溶度积常数 BaSO4 (s) BaSO4(aq)全
部
电
离Ba2+(aq) + SO42-(aq)平衡时 Ksp =[Ba2+ ][SO42- ] Ksp称为溶度积常数,简称溶度积(solubility product).
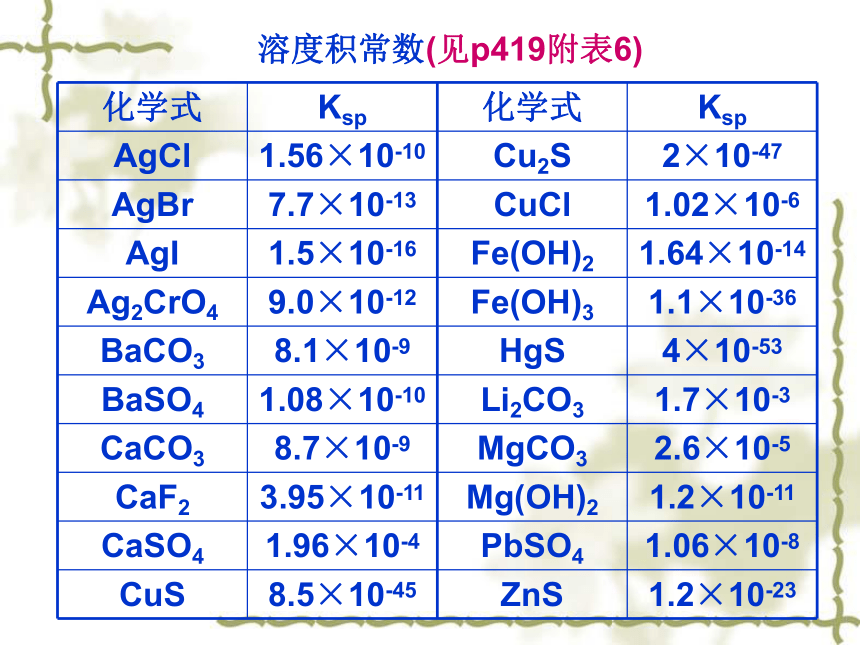
表示一定温度下,难溶电解质的饱和溶液中,各离子平衡浓度幂的乘积为一常数。Ba2+ + SO42- BaSO4 (s)Ba2+(aq) + SO42-(aq)简写为 BaSO4 (s)设 AmBn (s) mAn+ + nBm-Ksp = [ An+]m[ Bm-]n溶度积常数(见p419附表6) Ksp越大则难溶电解质在溶液中溶解趋势越大,反之越小。
二、溶度积与溶解度的相互换算
溶解度s的单位g/L或mol/L,即饱和时的浓度。
AmBn(s)?mAn++nBm-
s ms ns
Ksp=[An+]m[Bm-]n=[ms]m[ns]n=mmnnsm+n 例1:室温下,AgCl的溶解度是1.93×10-3g/L,求AgCl的溶度积。已知AgCl的摩尔质量为143.3g/mol。
解:
①把AgCl溶解度单位(g/L)换算成mol·L-1
s=1.93×10-3g/L÷143.3g/mol
=1.35×10-5mol·L-1
②求Ksp
AgCl(s) ? Ag+ + Cl-
饱和、平衡 1.35×10-5 1.35×10-5
Ksp(AgCl)=[Ag+][Cl-]
=(1.35×10-5)2
=1.82×10-10
答:AgCl的Ksp为1.82×10-10例2:Mg(OH)2的Ksp=1.20×10-11在298K时,Mg(OH)2的溶解度为多少?
解:Mg(OH)2(s) ?Mg2++2OH-
设溶解度为s
平衡时 s 2s
Ksp=[Mg2+][OH-]2
=s(2s)2
=4s3
=1.2×10-11
∴ s=1.44×10-4mol·L-1
答:氢氧化镁在298K时的溶解度为
1.44×10-4mol·L-1。例3:Ag2CrO4在298K时溶解度s=1.34×10-4mol·L-1求:Ksp
解:
Ag2CrO4(s) ?2Ag+ + CrO42-
平衡时 2×1.34×10-4 1.34×10-4
Ksp=[Ag+]2[CrO42-]
=(2×1.34×10-4)2×1.34×10-4
=9.62×10-12
答:铬酸银在298K时的Ksp=9.62×10-12
由以上三个例题的结果可得到如下结论:
①同种类型的难溶电解质,在一定温度下,Ksp越大则溶解度越大。
②不同类型则不能用Ksp的大小来比较溶解度的大小,必须经过换算才能得出结论。三、溶度积原理
根据溶度积常数可以判断沉淀、溶解反应进行的方向。
某难溶电解质溶液中,其离子浓度系数次方之积称离子积。用J表示。
如:Ag2CrO4
任意情况下的离子积为:
J=c2(Ag+)×c(CrO42-)
①当J=Ksp是饱和溶液无沉淀析出即平衡状态;
②当J ③当J>Ksp是过饱和溶液,向生成沉淀的方向移动。 例 在20mL 0.0020mol·L-1Na2SO4溶液中加入 20 mL 0.020mol·L-1 BaCl2溶液,有无BaSO4沉淀生成?并判断 SO42- 离子是否沉淀完全?已知BaSO4的Ksp= 1.07×10-10 .解:(1)∴ 有BaSO4沉淀生成即 1.07×10-10 ≈ 0.0090 x
∴ x = [SO42-] ≈ 1.2×10-8 mol· L-1⑵ 设平衡时 [SO42-] = x mol·L-1沉淀完全是指离子残留量 ≤ 10-5 mol· L-1故加入BaCl2 可使SO42- 沉淀完全Ksp = [Ba2+][SO42-] = ( 0.0090 + x ) x起始浓度/mol·L-1 0.010 0.0010
平衡浓度/ mol·L-1 0.010﹣(0.0010- x) xBaSO4 (s) Ba 2+ + SO42-∴ 0.0090 + x ≈ 0.0090 ∵ x 很小四、同离子效应和盐效应⒈ 同离子效应PbI2 饱和溶液 + KI (aq) → 黄↓ 在难溶电解质溶液中加入含有 共同离子的易溶强电解质,使 难溶电解质溶解度降低的现象。2.盐效应在难溶电解质饱和溶液中加入不含相同离子的强电解质,将使难溶电解质的溶解度略为增大的现象。例:298K时硫酸钡的溶解度为1.04×10-5mol·L-1,如果在0.010mol·L-1的硫酸钠溶液中的溶解度是多少?
解:①先求Ksp
BaSO4?Ba2+ + SO42-
1.04×10-5 1.04×10-5
Ksp=[Ba2+][SO42-]
=1.04×10-5×1.04×10-5
=1.08×10-10 ②求s
Na2SO4→2Na+ + SO42-
BaSO4 ? Ba2+ + SO42-
初 0 0.01
平衡 s s+0.01≈0.01
Ksp=[Ba2+][SO42-]
=s×0.01
s=Ksp/0.01
=1.08×10-10/0.01
=1.08×10-8mol·L-1
s<<0.01,即前面的近似是合理的。
答:溶解度是1.08×10-8mol·L-1。
可见在溶液中离子的浓度不可能为零,我们通常当溶液中被沉淀离子浓度小于10-5mol·L-1时即可认为沉淀完全了。§10-2 沉淀与溶解 一、沉淀的生成?
欲使某物质析出沉淀,必须使其离子积大于溶度积,即增大离子浓度可反应向着生成沉淀的方向转化。
例:将等体积的4×10-3mol·L-1的AgNO3和4×10-3mol·L-1的K2CrO4溶液混合是否能析出Ag2CrO4沉淀?Ksp(Ag2CrO4)=1.0×10-12
解:混合后因Ag2CrO4?2Ag++CrO42-
c(Ag+)=2×10-3mol·L-1,
c(CrO42-)=2×10-3mol·L-1
J=c2(Ag+)×c(CrO42-)
=(2×10-3)2×2×10-3=8×10-9
J>Ksp ∴有沉淀析出。
答:能析出Ag2CrO4沉淀。例:向1.0 × 10-3 mol?L-1 的K2CrO4溶液中滴加AgNO3溶液,求开始有Ag2CrO4沉淀生成时的[Ag+]? CrO42-沉淀完全时, [Ag+]= ? 假设反应前后体积不变。已知Ksp(Ag2CrO4)=1.0×10-12
解: Ag2CrO4 2Ag+ + CrO42-
Ksp = [Ag+]2 [CrO42-]CrO42-沉淀完全时的浓度为1.0 ×10-5 mol?L-1,故有例:向0.1 mol?L-1 的ZnCl2溶液中通H2S气体至饱和时,溶液中刚有ZnS沉淀生成,求此时溶液的[H+] = ?已知Ksp(ZnS)=2.0×10-22,H2S 的Ka1=1.3×10-7, Ka2=7.1×10-15解: ZnS Zn2+ + S2-H2S 2H+ + S2-
= 0.21 mol?L-1
二、沉淀的溶解 J < Ksp1.生成弱电解质⑴ 生成弱酸CaCO3(s) +2H+ Ca2+ + H2CO3H2O + CO2↑ ⑵ 生成弱酸盐PbSO4(s) + 2Ac-Pb(Ac)2 + SO42-⑶ 生成弱碱Mg(OH)2(s) + 2NH4+ Mg2+ + 2NH3·H2O⑷ 生成水Fe(OH)3(s) + 3H+ Fe3+ + 3H2O⒉ 发生氧化还原反应3CuS + 8HNO3(稀)=3Cu(NO3)2+ 3S↓+ 2NO↑+ 4H2O⒊ 生成配离子AgCl + 2NH3 = [Ag(NH3)2]+ + Cl-J< Ksp ∴ 溶解[Ag+][S2-]J< Ksp ∴ 溶解课堂练习:在AgCl的饱和溶液中,有AgCl固体存在,当分别向溶液中加入下列物质时,将有何种变化? 加入物质 平衡 AgCl 溶液中浓度 引起变化
移动 溶解度 [Ag+] [Cl-] 原因 HCl(0.1 mol·L-1)AgCl(s) Ag+ + Cl-→ 不变 不变 不变 稀释→ ↑ ↓ ↑ 生成配离子→ ↑ ↑ ↑ 盐效应 ← ↓ ↑ ↓ 同离子效应AgNO3(0.1 mol·L-1) KNO3(s)NH3·H2O(2 mol·L- 1)H2O← ↓ ↓ ↑ 同离子效应三、酸度对沉淀和溶解的影响例 计算298K时使0.010mol·L-1Fe3+开始沉淀和沉淀完全时溶液的pH值。已知Fe(OH)3的Ksp=2.64×10-39。解: Fe(OH)3 (s) Fe3+ + 3OH-⑴ 开始沉淀∵ [Fe3+][OH-]3 =KsppOH = 13﹣lg 6.42 = 12.19∴ pH = 1.811.金属氢氧化物沉淀的生成和溶解⑵ 沉淀完全[Fe3+] ≤ 10-5 mol·L-1∴ pH = 14﹣(12﹣lg6.42) =2.81注:由此可见:①氢氧化物沉淀不一定在碱性环境;②不同氢氧化物的Ksp值不同,沉淀的pH值也不同,因此可通过控制pH值分离金属离子。见p344图10-3。 硫化物大部分为难溶物,硫化物的Ksp相差很大,其沉淀、溶解情况比较复杂。
在用酸溶解硫化物(或用H2S使金属离子沉淀为硫化物)时,体系中同时存在硫化物的沉淀溶解平衡及H2S的电离平衡。
MS(s) ?M2++S2- Ksp
S2-+2H+?H2S K=1/(Ka1Ka2)
其中Ka1=5.7×10-8;Ka2=1.2×10-15
MS(s)+2H+?M2++H2S
K′=Ksp/(Ka1Ka2)=[M2+][H2S]/[H+]22.难溶硫化物沉淀与溶解例: 使0.01 mol SnS溶于1 L 的盐酸中,求所需盐酸的最低起始浓度 = ?已知Ksp(SnS)=1.0×10-25,H2S 的Ka1=1.3×10-7, Ka2=7.1×10-15故所需盐酸的起始浓度为:0.96 + 0.02 = 0.98mol ?L-10.01 mol SnS溶解将产生0.01 mol的H2S解: SnS+2H+ Sn2+ + H2S四、分步沉淀
如果溶液中同时含有几种离子,当加入某种沉淀剂时,沉淀反应将依怎样的次序进行呢?
实验:取0.02mol·L-1氯化钠溶液20毫升,0.02 mol·L-1碘化钠溶液20毫升混合后,逐滴加入1mol·L-1的AgNO3溶液观察现象?
现象:先生成黄色沉淀AgI而后才生成白色沉淀AgCl。
对于同一类型的难溶电解质AgCl、AgI沉淀析出的顺序是溶度积小的AgI先沉淀,溶度积大的AgCl后沉淀,这种先后沉淀的作用叫分步沉淀。 我们通过溶度积计算来说明
已知:AgCl的Ksp=1.56×10-10,AgI的Ksp=1.56×10-16
所以生成AgCl沉淀所需Ag+离子最低浓度为:
[Ag+]=1.56×10-10/0.01=1.56×10-8(mol·L-1)
生成AgI沉淀所需Ag+离子最低浓度为:
[Ag+]=1.5×10-16/0.01=1.5×10-14(mol·L-1)
生成AgI沉淀所需Ag+离子浓度少,所以先沉淀。
当AgCl开始沉淀时,I-离子是否沉淀完全?
当AgCl开始沉淀时溶液中[Ag+]为1.56×10-8mol·L-1此时[I-]=1.5×10-16/1.56×10-8=9.6×10-9(mol·L-1)
<1×10-5(mol·L-1)
I-离子早已沉淀完全,所以利用此原理可以分离两种离子且两种沉淀的溶度积相差越大,分离越完全。例1:如果溶液中Fe3+和Mg2+的浓度均为0.10 mol?L-1, 使Fe3+定量沉淀而使Mg2+不沉淀的pH条件是什么?
已知Ksp(Fe(OH)3)=4.0×10-39,Ksp((Mg(OH)2)=1.8×10-11pOH = 11.1 , pH = 2.9解: Fe(OH)3 Fe3+ + 3OH-
Ksp = [Fe3+][OH-]3 = 4.0 ×10-39
Fe3+ 沉淀完全时的[OH-]为:Mg2+开始沉淀的pH值为:pOH = 4.9, pH =9.1
因此, 只要控制pH值在2.9 ~ 9.1之间即可使Fe3+定量沉淀而使Mg2+不沉淀。例2:如果溶液中Zn2+和Mn2+的浓度均为0.10 mol?L-1,能否利用通入H2S气体使Zn2+和Mn2+定量分离?Zn2+和Mn2+分离完全的pH值为多少?已知Ksp(ZnS)=2.93×10-25, Ksp(MnS)=4.65×10-14 ,H2S 的Ka1=5.7×10-8, Ka2=1.2×10-15解: Zn2+ + H2S ZnS + 2H+
Mn2+ + H2S MnS + 2H+Zn2+ 沉淀完全时的pH值为:pH = 1.82pH = 5.41
控制pH值在1.18-5.41之间即可将Zn2+和Mn2+分离完全。Mn2+ 开始沉淀时的pH值为:五、沉淀的转化
如在AgCl的沉淀中加入I-离子又生成了一种新
的沉淀AgI。
AgCl(s) ?Ag+ + Cl-
+
KI →I- + K+
?
AgI↓
这种在有沉淀的溶液中加入适当的试剂、生成另一种更难溶的物质,叫沉淀的转化。 本章作业p347—348的1,4,5,6,13共五大题。
上交时间:十七周星期一
上交内容:第9章和第10章的作业
10-2 沉淀与溶解
习题§10-1 溶度积原理一般可用溶解度的大小来衡量物质在水中溶解能力的大小. 物质 溶解度(g/100g水)?易溶物> 0.1?微溶物0.01~0.1?难溶物< 0.01 对难溶物来说, 在它的饱和溶液中存在多相离子平衡.一定T 时: 溶解 溶解
BaSO4(s) ? BaSO4(aq) ? Ba2+(aq) + SO42-(aq)
沉淀 沉淀一、溶度积常数 BaSO4 (s) BaSO4(aq)全
部
电
离Ba2+(aq) + SO42-(aq)平衡时 Ksp =[Ba2+ ][SO42- ] Ksp称为溶度积常数,简称溶度积(solubility product).
表示一定温度下,难溶电解质的饱和溶液中,各离子平衡浓度幂的乘积为一常数。Ba2+ + SO42- BaSO4 (s)Ba2+(aq) + SO42-(aq)简写为 BaSO4 (s)设 AmBn (s) mAn+ + nBm-Ksp = [ An+]m[ Bm-]n溶度积常数(见p419附表6) Ksp越大则难溶电解质在溶液中溶解趋势越大,反之越小。
二、溶度积与溶解度的相互换算
溶解度s的单位g/L或mol/L,即饱和时的浓度。
AmBn(s)?mAn++nBm-
s ms ns
Ksp=[An+]m[Bm-]n=[ms]m[ns]n=mmnnsm+n 例1:室温下,AgCl的溶解度是1.93×10-3g/L,求AgCl的溶度积。已知AgCl的摩尔质量为143.3g/mol。
解:
①把AgCl溶解度单位(g/L)换算成mol·L-1
s=1.93×10-3g/L÷143.3g/mol
=1.35×10-5mol·L-1
②求Ksp
AgCl(s) ? Ag+ + Cl-
饱和、平衡 1.35×10-5 1.35×10-5
Ksp(AgCl)=[Ag+][Cl-]
=(1.35×10-5)2
=1.82×10-10
答:AgCl的Ksp为1.82×10-10例2:Mg(OH)2的Ksp=1.20×10-11在298K时,Mg(OH)2的溶解度为多少?
解:Mg(OH)2(s) ?Mg2++2OH-
设溶解度为s
平衡时 s 2s
Ksp=[Mg2+][OH-]2
=s(2s)2
=4s3
=1.2×10-11
∴ s=1.44×10-4mol·L-1
答:氢氧化镁在298K时的溶解度为
1.44×10-4mol·L-1。例3:Ag2CrO4在298K时溶解度s=1.34×10-4mol·L-1求:Ksp
解:
Ag2CrO4(s) ?2Ag+ + CrO42-
平衡时 2×1.34×10-4 1.34×10-4
Ksp=[Ag+]2[CrO42-]
=(2×1.34×10-4)2×1.34×10-4
=9.62×10-12
答:铬酸银在298K时的Ksp=9.62×10-12
由以上三个例题的结果可得到如下结论:
①同种类型的难溶电解质,在一定温度下,Ksp越大则溶解度越大。
②不同类型则不能用Ksp的大小来比较溶解度的大小,必须经过换算才能得出结论。三、溶度积原理
根据溶度积常数可以判断沉淀、溶解反应进行的方向。
某难溶电解质溶液中,其离子浓度系数次方之积称离子积。用J表示。
如:Ag2CrO4
任意情况下的离子积为:
J=c2(Ag+)×c(CrO42-)
①当J=Ksp是饱和溶液无沉淀析出即平衡状态;
②当J
∴ x = [SO42-] ≈ 1.2×10-8 mol· L-1⑵ 设平衡时 [SO42-] = x mol·L-1沉淀完全是指离子残留量 ≤ 10-5 mol· L-1故加入BaCl2 可使SO42- 沉淀完全Ksp = [Ba2+][SO42-] = ( 0.0090 + x ) x起始浓度/mol·L-1 0.010 0.0010
平衡浓度/ mol·L-1 0.010﹣(0.0010- x) xBaSO4 (s) Ba 2+ + SO42-∴ 0.0090 + x ≈ 0.0090 ∵ x 很小四、同离子效应和盐效应⒈ 同离子效应PbI2 饱和溶液 + KI (aq) → 黄↓ 在难溶电解质溶液中加入含有 共同离子的易溶强电解质,使 难溶电解质溶解度降低的现象。2.盐效应在难溶电解质饱和溶液中加入不含相同离子的强电解质,将使难溶电解质的溶解度略为增大的现象。例:298K时硫酸钡的溶解度为1.04×10-5mol·L-1,如果在0.010mol·L-1的硫酸钠溶液中的溶解度是多少?
解:①先求Ksp
BaSO4?Ba2+ + SO42-
1.04×10-5 1.04×10-5
Ksp=[Ba2+][SO42-]
=1.04×10-5×1.04×10-5
=1.08×10-10 ②求s
Na2SO4→2Na+ + SO42-
BaSO4 ? Ba2+ + SO42-
初 0 0.01
平衡 s s+0.01≈0.01
Ksp=[Ba2+][SO42-]
=s×0.01
s=Ksp/0.01
=1.08×10-10/0.01
=1.08×10-8mol·L-1
s<<0.01,即前面的近似是合理的。
答:溶解度是1.08×10-8mol·L-1。
可见在溶液中离子的浓度不可能为零,我们通常当溶液中被沉淀离子浓度小于10-5mol·L-1时即可认为沉淀完全了。§10-2 沉淀与溶解 一、沉淀的生成?
欲使某物质析出沉淀,必须使其离子积大于溶度积,即增大离子浓度可反应向着生成沉淀的方向转化。
例:将等体积的4×10-3mol·L-1的AgNO3和4×10-3mol·L-1的K2CrO4溶液混合是否能析出Ag2CrO4沉淀?Ksp(Ag2CrO4)=1.0×10-12
解:混合后因Ag2CrO4?2Ag++CrO42-
c(Ag+)=2×10-3mol·L-1,
c(CrO42-)=2×10-3mol·L-1
J=c2(Ag+)×c(CrO42-)
=(2×10-3)2×2×10-3=8×10-9
J>Ksp ∴有沉淀析出。
答:能析出Ag2CrO4沉淀。例:向1.0 × 10-3 mol?L-1 的K2CrO4溶液中滴加AgNO3溶液,求开始有Ag2CrO4沉淀生成时的[Ag+]? CrO42-沉淀完全时, [Ag+]= ? 假设反应前后体积不变。已知Ksp(Ag2CrO4)=1.0×10-12
解: Ag2CrO4 2Ag+ + CrO42-
Ksp = [Ag+]2 [CrO42-]CrO42-沉淀完全时的浓度为1.0 ×10-5 mol?L-1,故有例:向0.1 mol?L-1 的ZnCl2溶液中通H2S气体至饱和时,溶液中刚有ZnS沉淀生成,求此时溶液的[H+] = ?已知Ksp(ZnS)=2.0×10-22,H2S 的Ka1=1.3×10-7, Ka2=7.1×10-15解: ZnS Zn2+ + S2-H2S 2H+ + S2-
= 0.21 mol?L-1
二、沉淀的溶解 J < Ksp1.生成弱电解质⑴ 生成弱酸CaCO3(s) +2H+ Ca2+ + H2CO3H2O + CO2↑ ⑵ 生成弱酸盐PbSO4(s) + 2Ac-Pb(Ac)2 + SO42-⑶ 生成弱碱Mg(OH)2(s) + 2NH4+ Mg2+ + 2NH3·H2O⑷ 生成水Fe(OH)3(s) + 3H+ Fe3+ + 3H2O⒉ 发生氧化还原反应3CuS + 8HNO3(稀)=3Cu(NO3)2+ 3S↓+ 2NO↑+ 4H2O⒊ 生成配离子AgCl + 2NH3 = [Ag(NH3)2]+ + Cl-J< Ksp ∴ 溶解[Ag+][S2-]J< Ksp ∴ 溶解课堂练习:在AgCl的饱和溶液中,有AgCl固体存在,当分别向溶液中加入下列物质时,将有何种变化? 加入物质 平衡 AgCl 溶液中浓度 引起变化
移动 溶解度 [Ag+] [Cl-] 原因 HCl(0.1 mol·L-1)AgCl(s) Ag+ + Cl-→ 不变 不变 不变 稀释→ ↑ ↓ ↑ 生成配离子→ ↑ ↑ ↑ 盐效应 ← ↓ ↑ ↓ 同离子效应AgNO3(0.1 mol·L-1) KNO3(s)NH3·H2O(2 mol·L- 1)H2O← ↓ ↓ ↑ 同离子效应三、酸度对沉淀和溶解的影响例 计算298K时使0.010mol·L-1Fe3+开始沉淀和沉淀完全时溶液的pH值。已知Fe(OH)3的Ksp=2.64×10-39。解: Fe(OH)3 (s) Fe3+ + 3OH-⑴ 开始沉淀∵ [Fe3+][OH-]3 =KsppOH = 13﹣lg 6.42 = 12.19∴ pH = 1.811.金属氢氧化物沉淀的生成和溶解⑵ 沉淀完全[Fe3+] ≤ 10-5 mol·L-1∴ pH = 14﹣(12﹣lg6.42) =2.81注:由此可见:①氢氧化物沉淀不一定在碱性环境;②不同氢氧化物的Ksp值不同,沉淀的pH值也不同,因此可通过控制pH值分离金属离子。见p344图10-3。 硫化物大部分为难溶物,硫化物的Ksp相差很大,其沉淀、溶解情况比较复杂。
在用酸溶解硫化物(或用H2S使金属离子沉淀为硫化物)时,体系中同时存在硫化物的沉淀溶解平衡及H2S的电离平衡。
MS(s) ?M2++S2- Ksp
S2-+2H+?H2S K=1/(Ka1Ka2)
其中Ka1=5.7×10-8;Ka2=1.2×10-15
MS(s)+2H+?M2++H2S
K′=Ksp/(Ka1Ka2)=[M2+][H2S]/[H+]22.难溶硫化物沉淀与溶解例: 使0.01 mol SnS溶于1 L 的盐酸中,求所需盐酸的最低起始浓度 = ?已知Ksp(SnS)=1.0×10-25,H2S 的Ka1=1.3×10-7, Ka2=7.1×10-15故所需盐酸的起始浓度为:0.96 + 0.02 = 0.98mol ?L-10.01 mol SnS溶解将产生0.01 mol的H2S解: SnS+2H+ Sn2+ + H2S四、分步沉淀
如果溶液中同时含有几种离子,当加入某种沉淀剂时,沉淀反应将依怎样的次序进行呢?
实验:取0.02mol·L-1氯化钠溶液20毫升,0.02 mol·L-1碘化钠溶液20毫升混合后,逐滴加入1mol·L-1的AgNO3溶液观察现象?
现象:先生成黄色沉淀AgI而后才生成白色沉淀AgCl。
对于同一类型的难溶电解质AgCl、AgI沉淀析出的顺序是溶度积小的AgI先沉淀,溶度积大的AgCl后沉淀,这种先后沉淀的作用叫分步沉淀。 我们通过溶度积计算来说明
已知:AgCl的Ksp=1.56×10-10,AgI的Ksp=1.56×10-16
所以生成AgCl沉淀所需Ag+离子最低浓度为:
[Ag+]=1.56×10-10/0.01=1.56×10-8(mol·L-1)
生成AgI沉淀所需Ag+离子最低浓度为:
[Ag+]=1.5×10-16/0.01=1.5×10-14(mol·L-1)
生成AgI沉淀所需Ag+离子浓度少,所以先沉淀。
当AgCl开始沉淀时,I-离子是否沉淀完全?
当AgCl开始沉淀时溶液中[Ag+]为1.56×10-8mol·L-1此时[I-]=1.5×10-16/1.56×10-8=9.6×10-9(mol·L-1)
<1×10-5(mol·L-1)
I-离子早已沉淀完全,所以利用此原理可以分离两种离子且两种沉淀的溶度积相差越大,分离越完全。例1:如果溶液中Fe3+和Mg2+的浓度均为0.10 mol?L-1, 使Fe3+定量沉淀而使Mg2+不沉淀的pH条件是什么?
已知Ksp(Fe(OH)3)=4.0×10-39,Ksp((Mg(OH)2)=1.8×10-11pOH = 11.1 , pH = 2.9解: Fe(OH)3 Fe3+ + 3OH-
Ksp = [Fe3+][OH-]3 = 4.0 ×10-39
Fe3+ 沉淀完全时的[OH-]为:Mg2+开始沉淀的pH值为:pOH = 4.9, pH =9.1
因此, 只要控制pH值在2.9 ~ 9.1之间即可使Fe3+定量沉淀而使Mg2+不沉淀。例2:如果溶液中Zn2+和Mn2+的浓度均为0.10 mol?L-1,能否利用通入H2S气体使Zn2+和Mn2+定量分离?Zn2+和Mn2+分离完全的pH值为多少?已知Ksp(ZnS)=2.93×10-25, Ksp(MnS)=4.65×10-14 ,H2S 的Ka1=5.7×10-8, Ka2=1.2×10-15解: Zn2+ + H2S ZnS + 2H+
Mn2+ + H2S MnS + 2H+Zn2+ 沉淀完全时的pH值为:pH = 1.82pH = 5.41
控制pH值在1.18-5.41之间即可将Zn2+和Mn2+分离完全。Mn2+ 开始沉淀时的pH值为:五、沉淀的转化
如在AgCl的沉淀中加入I-离子又生成了一种新
的沉淀AgI。
AgCl(s) ?Ag+ + Cl-
+
KI →I- + K+
?
AgI↓
这种在有沉淀的溶液中加入适当的试剂、生成另一种更难溶的物质,叫沉淀的转化。 本章作业p347—348的1,4,5,6,13共五大题。
上交时间:十七周星期一
上交内容:第9章和第10章的作业
