第一单元 化学反应速率与化学反应限度
图片预览



文档简介
课件8张PPT。新河中学 潘海军
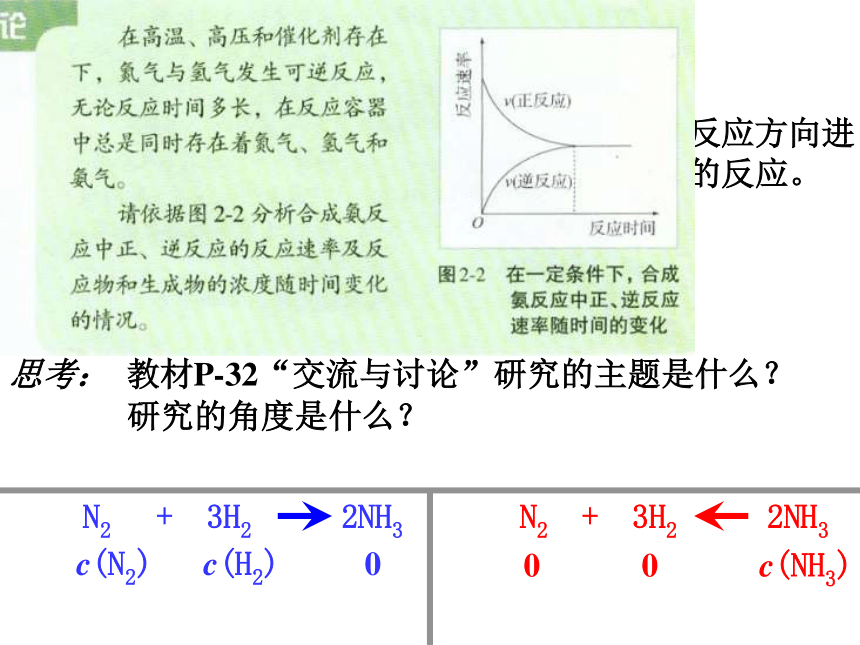
第一单元 化学反应速率与化学反应限度 ——化学反应的限度已知20滴水溶液体积约为1ml,分别计算Fe3+ 和I-的物质的量,判断过量情况。一、可逆反应存在反应的限度二、为何可逆反应存在反应的限度N2 + 3H2 2NH3c(N2) c(H2) 00 0 c(NH3)可逆反应:在同一条件下,既可以向正反应方向进
行,同时又可以向逆反应方向进行的反应。三、可逆反应如何达到反应的限度思考: 教材P-32“交流与讨论”研究的主题是什么?研究的角度是什么?开始 c(N2) c(H2) 0一、可逆反应存在反应的限度二、为何可逆反应存在反应的限度vvv正v正(N2) v正(H2) v正(NH3)v逆(N2) v逆(H2) v逆(NH3)N2 + 3H2 2NH3c(N2) c(H2) 00 0 c(NH3)可逆反应:在同一条件下,既可以向正反应方向进
行,同时又可以向逆反应方向进行的反应。三、可逆反应如何达到反应的限度开始 c(N2) c(H2) 0思考: v和v有何不同?回顾: 影响化学反应速率大小的因素有哪些?讨论: 影响v正大小因素有哪些?v逆影响v逆大小因素有哪些?一、可逆反应存在反应的限度二、为何可逆反应存在反应的限度v正v正(N2) v正(H2) v正(NH3)v逆v逆(N2) v逆(H2) v逆(NH3)N2 + 3H2 2NH3c(N2) c(H2) 00 0 c(NH3)可逆反应:在同一条件下,既可以向正反应方向进
行,同时又可以向逆反应方向进行的反应。三、可逆反应如何达到反应的限度思考:教材P-32“交流与讨论”中,影响v正,v逆大小
的因素是什么?开始 c(N2) c(H2) 0一、可逆反应存在反应的限度二、为何可逆反应存在反应的限度v正v正(N2) v正(H2) v正(NH3)v逆v逆(N2) v逆(H2) v逆(NH3)N2 + 3H2 2NH3c(N2) c(H2) 00 0 c(NH3)可逆反应:在同一条件下,既可以向正反应方向进
行,同时又可以向逆反应方向进行的反应。三、可逆反应如何达到反应的限度开始 c(N2) c(H2) 0某t c(N2)-a c(H2)-3a 2ac(N2)-a c(H2)-3a 0 0 0 2av正 = v逆化学平衡态:c不再变化一、可逆反应存在反应的限度二、为何可逆反应存在反应的限度N2 + 3H2 2NH3可逆反应:在同一条件下,既可以向正反应方向进
行,同时又可以向逆反应方向进行的反应。三、可逆反应如何达到反应的限度v正 = v逆化学平衡态:c不再变化1.判断可逆反应达化学平衡态时( )A.反应停止了,即v正 = v逆=0B.各组成浓度不变C.各组成百分比不变D.若此时,改变外界条件,使v正 ≠ v逆,
会达到新的化学平衡态。一、可逆反应存在反应的限度二、为何可逆反应存在反应的限度N2 + 3H2 2NH3可逆反应:在同一条件下,既可以向正反应方向进
行,同时又可以向逆反应方向进行的反应。三、可逆反应如何达到反应的限度v正 = v逆化学平衡态:c不再变化2.讨论合成氨反应是否达化学平衡态( )A. NH3不再分解了B. N2的浓度保持不变C.某时刻N2的浓度为1mol/LD. v正(N2) = v逆(H2)F.单位时间内生成n mol H2同时
生成2n mol NH3E. 3v正(N2) = v正(H2)
第一单元 化学反应速率与化学反应限度 ——化学反应的限度已知20滴水溶液体积约为1ml,分别计算Fe3+ 和I-的物质的量,判断过量情况。一、可逆反应存在反应的限度二、为何可逆反应存在反应的限度N2 + 3H2 2NH3c(N2) c(H2) 00 0 c(NH3)可逆反应:在同一条件下,既可以向正反应方向进
行,同时又可以向逆反应方向进行的反应。三、可逆反应如何达到反应的限度思考: 教材P-32“交流与讨论”研究的主题是什么?研究的角度是什么?开始 c(N2) c(H2) 0一、可逆反应存在反应的限度二、为何可逆反应存在反应的限度vvv正v正(N2) v正(H2) v正(NH3)v逆(N2) v逆(H2) v逆(NH3)N2 + 3H2 2NH3c(N2) c(H2) 00 0 c(NH3)可逆反应:在同一条件下,既可以向正反应方向进
行,同时又可以向逆反应方向进行的反应。三、可逆反应如何达到反应的限度开始 c(N2) c(H2) 0思考: v和v有何不同?回顾: 影响化学反应速率大小的因素有哪些?讨论: 影响v正大小因素有哪些?v逆影响v逆大小因素有哪些?一、可逆反应存在反应的限度二、为何可逆反应存在反应的限度v正v正(N2) v正(H2) v正(NH3)v逆v逆(N2) v逆(H2) v逆(NH3)N2 + 3H2 2NH3c(N2) c(H2) 00 0 c(NH3)可逆反应:在同一条件下,既可以向正反应方向进
行,同时又可以向逆反应方向进行的反应。三、可逆反应如何达到反应的限度思考:教材P-32“交流与讨论”中,影响v正,v逆大小
的因素是什么?开始 c(N2) c(H2) 0一、可逆反应存在反应的限度二、为何可逆反应存在反应的限度v正v正(N2) v正(H2) v正(NH3)v逆v逆(N2) v逆(H2) v逆(NH3)N2 + 3H2 2NH3c(N2) c(H2) 00 0 c(NH3)可逆反应:在同一条件下,既可以向正反应方向进
行,同时又可以向逆反应方向进行的反应。三、可逆反应如何达到反应的限度开始 c(N2) c(H2) 0某t c(N2)-a c(H2)-3a 2ac(N2)-a c(H2)-3a 0 0 0 2av正 = v逆化学平衡态:c不再变化一、可逆反应存在反应的限度二、为何可逆反应存在反应的限度N2 + 3H2 2NH3可逆反应:在同一条件下,既可以向正反应方向进
行,同时又可以向逆反应方向进行的反应。三、可逆反应如何达到反应的限度v正 = v逆化学平衡态:c不再变化1.判断可逆反应达化学平衡态时( )A.反应停止了,即v正 = v逆=0B.各组成浓度不变C.各组成百分比不变D.若此时,改变外界条件,使v正 ≠ v逆,
会达到新的化学平衡态。一、可逆反应存在反应的限度二、为何可逆反应存在反应的限度N2 + 3H2 2NH3可逆反应:在同一条件下,既可以向正反应方向进
行,同时又可以向逆反应方向进行的反应。三、可逆反应如何达到反应的限度v正 = v逆化学平衡态:c不再变化2.讨论合成氨反应是否达化学平衡态( )A. NH3不再分解了B. N2的浓度保持不变C.某时刻N2的浓度为1mol/LD. v正(N2) = v逆(H2)F.单位时间内生成n mol H2同时
生成2n mol NH3E. 3v正(N2) = v正(H2)
