第三节酸和碱的性质 复习
图片预览





文档简介
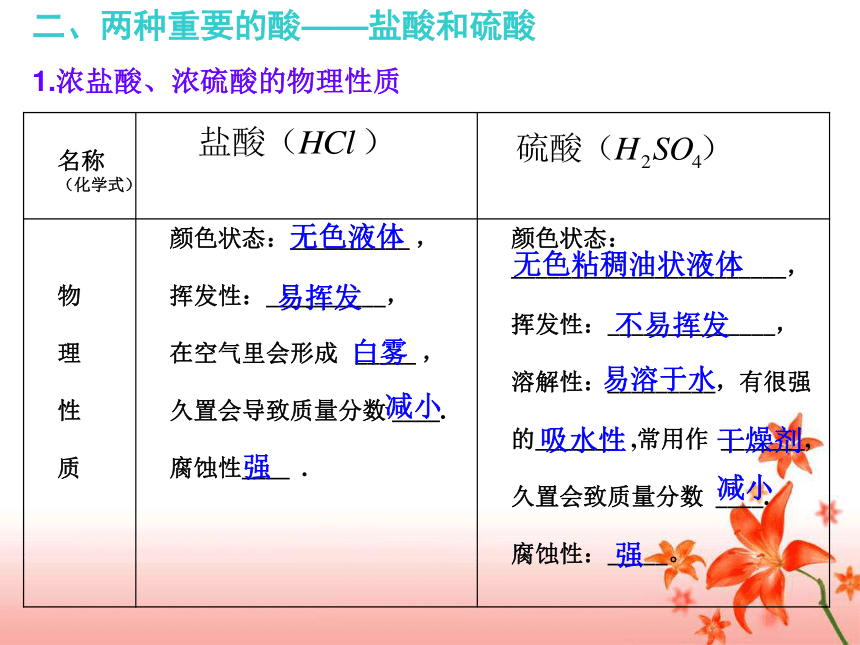
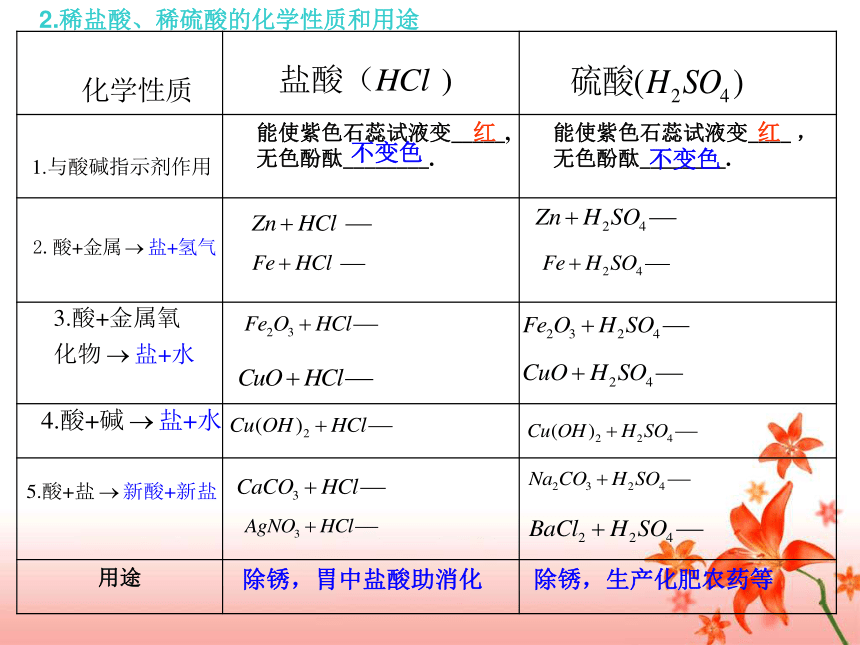
课件17张PPT。5.3 酸和碱的性质2010.04.08复习目标: 1.知道常见酸碱的主要性质和用途,认识酸和碱的腐蚀性; 2.掌握常见酸和碱的物理性质及化学性质,并能够熟练书写有关的化学方程式; 3.感悟化学与现实生活的紧密联系,进一步发展科学探究能力。 一、构建知识网络1.明确学案中所列知识点;2.分组讨论疑问点,不能解决请做好记录.分小组讨论二、两种重要的酸——盐酸和硫酸1.浓盐酸、浓硫酸的物理性质 无色液体无色粘稠油状液体易挥发白雾减小减小强不易挥发易溶于水吸水性干燥剂强2.稀盐酸、稀硫酸的化学性质和用途红红不变色不变色除锈,胃中盐酸助消化除锈,生产化肥农药等三、两种重要的碱——氢氧化钠和氢氧化钙1.氢氧化钠、氢氧化钙的物理性质 俗称:________________俗称:________________火碱、烧碱、苛性钠熟石灰、消石灰易易干燥剂碱性酸微石灰水2. 氢氧化钠、氢氧化钙的化学性质、用途与制法建筑材料、改良酸性土壤等应用于肥皂 石油 造纸 纺织 和印染等工业
蓝 红 蓝 红 氢氧化钠、氢氧化钙在水溶液中能电离出相同的_____,所以具有相似的化学性质。 问题 醋酸具有酸的通性吗?举例说明。写出醋酸( )与水垢(主要成分为
)反应的化学方程式。复分解反应典型例题分析 化学研究性学习小组的同学们发现一瓶石灰水试剂瓶瓶壁和瓶塞周围有一些白色粉末。为了弄清楚白色粉末的成分及形成原因,他们进行如下探究:
(1)对白色粉末成分的猜想和成因分析(如下表)可能是 可能是______ 石灰水与空气中 反应。化学方程式为
_________________________ 溶质的溶解度降低或溶剂蒸发,石灰水中的溶质结晶析出 经过反复思考,同学们认为白色粉末还可能是__________________的混合物。(2)设计实验:甲同学取白色粉末装入试管中,加入少量的水、震荡,发现有白色固体不溶解。于是他得出粉末中一定有 的结论。乙同学认为甲
同学的结论不严密,理由是_____________________________________.
为了得出较严密的结论,他们进行了如下表所示的实验,请完成下列实验报告:取上述试管中的上层清液,滴加1~2滴无色酚酞试液 往上述试管中残留的固体中加入稀盐酸 白色粉末中 ___(选填“有” 或“无”) 由上述实验可知白色粉末的成分是_______________________.酚酞试液变红色 有气泡产生 有 白色粉末中有 微溶于水(或可能是氢氧化钙)取上述试管中的上层清液,滴加1~2滴无色酚酞试液 往上述试管中残留的固体中加入稀盐酸 白色粉末中 ___(选填“有” 或“无”) 由上述实验可知白色粉末的成分是_________.酚酞试液变红色 无气泡产生 白色粉末中有 无 取上述试管中的上层清液,滴加1~2滴无色酚酞试液 往上述试管中残留的固体中加入稀盐酸 白色粉末中 ___(选填“有” 或“无”) 由上述实验可知白色粉末的成分是_________.酚酞试液不变色 有气泡产生 白色粉末中无有 (3)交流与反思:
①通过上述实验的探究,同学们向实验室提出保存、使
用易变质的溶液时的下列建议,合理的是__________( 选填序号)
A. 密封保存 B. 使用前,临时配制
C.禁止使用这种试剂
②实验室清洗装石灰水试剂瓶内壁上的白色粉末时,可用稀盐酸,请写出其中可能发生的反应的化学方程式(写出一个即可):A,B(3)解析:①A、B② 或 课堂小结1、本节课我们重新熟悉了常见的酸和碱的物理性质,知道了这些药品的保存方法。
2、知道了盐酸、硫酸、氢氧化钠和氢氧化钙的化学性质,从而理解了酸和碱的通性。
3、再次体会到物质的用途是由物质的性质决定的、化学知识与社会生活实际的结合。
课堂达标练习答案1.C2.B3.D4.C
蓝 红 蓝 红 氢氧化钠、氢氧化钙在水溶液中能电离出相同的_____,所以具有相似的化学性质。 问题 醋酸具有酸的通性吗?举例说明。写出醋酸( )与水垢(主要成分为
)反应的化学方程式。复分解反应典型例题分析 化学研究性学习小组的同学们发现一瓶石灰水试剂瓶瓶壁和瓶塞周围有一些白色粉末。为了弄清楚白色粉末的成分及形成原因,他们进行如下探究:
(1)对白色粉末成分的猜想和成因分析(如下表)可能是 可能是______ 石灰水与空气中 反应。化学方程式为
_________________________ 溶质的溶解度降低或溶剂蒸发,石灰水中的溶质结晶析出 经过反复思考,同学们认为白色粉末还可能是__________________的混合物。(2)设计实验:甲同学取白色粉末装入试管中,加入少量的水、震荡,发现有白色固体不溶解。于是他得出粉末中一定有 的结论。乙同学认为甲
同学的结论不严密,理由是_____________________________________.
为了得出较严密的结论,他们进行了如下表所示的实验,请完成下列实验报告:取上述试管中的上层清液,滴加1~2滴无色酚酞试液 往上述试管中残留的固体中加入稀盐酸 白色粉末中 ___(选填“有” 或“无”) 由上述实验可知白色粉末的成分是_______________________.酚酞试液变红色 有气泡产生 有 白色粉末中有 微溶于水(或可能是氢氧化钙)取上述试管中的上层清液,滴加1~2滴无色酚酞试液 往上述试管中残留的固体中加入稀盐酸 白色粉末中 ___(选填“有” 或“无”) 由上述实验可知白色粉末的成分是_________.酚酞试液变红色 无气泡产生 白色粉末中有 无 取上述试管中的上层清液,滴加1~2滴无色酚酞试液 往上述试管中残留的固体中加入稀盐酸 白色粉末中 ___(选填“有” 或“无”) 由上述实验可知白色粉末的成分是_________.酚酞试液不变色 有气泡产生 白色粉末中无有 (3)交流与反思:
①通过上述实验的探究,同学们向实验室提出保存、使
用易变质的溶液时的下列建议,合理的是__________( 选填序号)
A. 密封保存 B. 使用前,临时配制
C.禁止使用这种试剂
②实验室清洗装石灰水试剂瓶内壁上的白色粉末时,可用稀盐酸,请写出其中可能发生的反应的化学方程式(写出一个即可):A,B(3)解析:①A、B② 或 课堂小结1、本节课我们重新熟悉了常见的酸和碱的物理性质,知道了这些药品的保存方法。
2、知道了盐酸、硫酸、氢氧化钠和氢氧化钙的化学性质,从而理解了酸和碱的通性。
3、再次体会到物质的用途是由物质的性质决定的、化学知识与社会生活实际的结合。
课堂达标练习答案1.C2.B3.D4.C
同课章节目录
- 第一单元 溶液
- 1 溶液的形成
- 2 溶液组成的定量表示
- 3物质的溶解性
- 到实验室去:配制一定溶质质量分数的溶液
- 第二单元 常见的酸和碱
- 1 酸及其性质
- 2 碱及其性质
- 3 溶液的酸碱性
- 4 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 到图书馆去:分子变成离子
- 第三单元 海水中的化学
- 1 海洋化学资源
- 2 海水“晒盐”
- 3 海水“制碱”
- 到实验室去:粗盐中难溶性杂质的去除
- 第四单元 金属
- 1 常见的金属材料
- 2 金属的化学性质
- 3 钢铁的锈蚀与防护
- 到实验室去:探究金属的性质
- 第五单元 化学与健康
- 1 食物中的有机物
- 2 化学元素与人体健康
- 3 远离有毒物质
- 第六单元 化学与社会发展
- 1 化学与能源开发
- 2 化学与材料研制
- 3 化学与农业生产
- 4 化学与环境保护
