化学反应中的热量变化
图片预览




文档简介
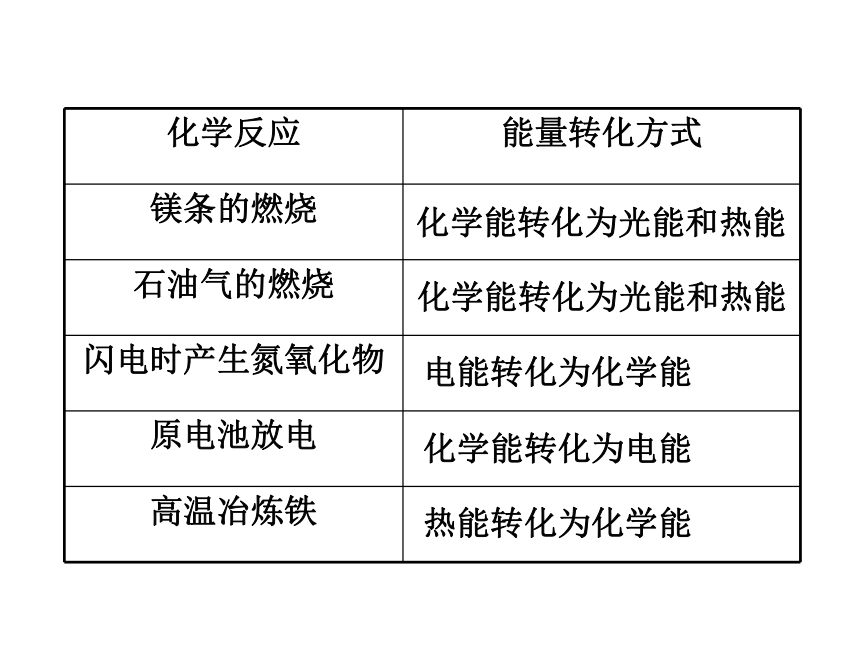
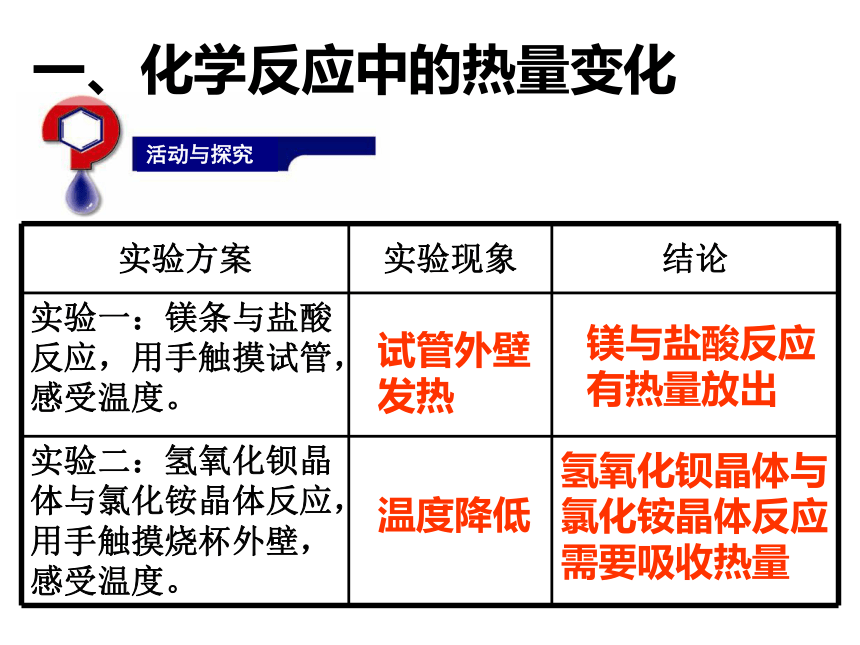
课件25张PPT。专题2 化学反应与能量转化第二单元 化学反应中的热量一、化学反应中的热量变化 生活中哪些事实说明了在化学反应中伴随着能量的变化?请说出能量转化的方式。你知道吗化学能转化为光能和热能化学能转化为光能和热能化学能转化为电能电能转化为化学能热能转化为化学能试管外壁
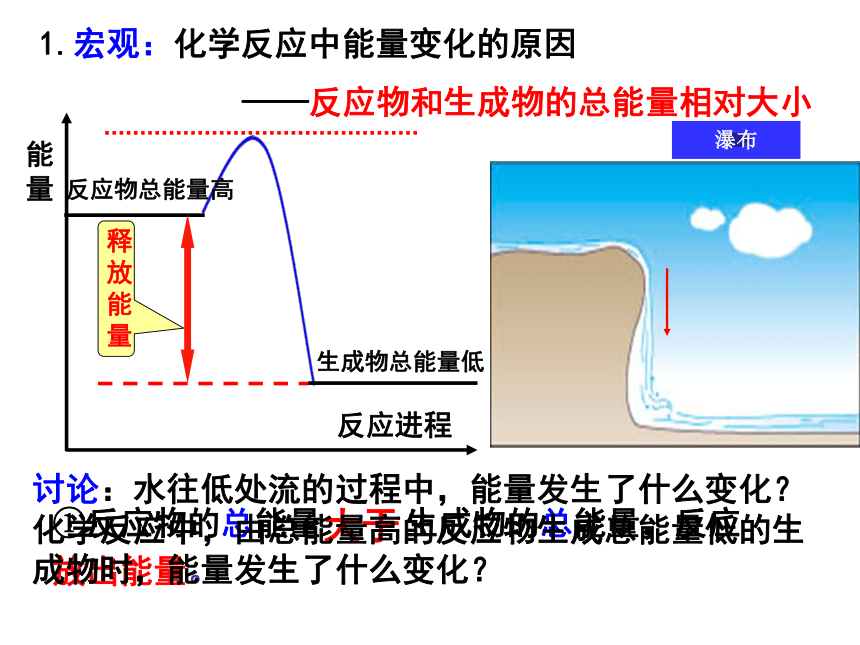
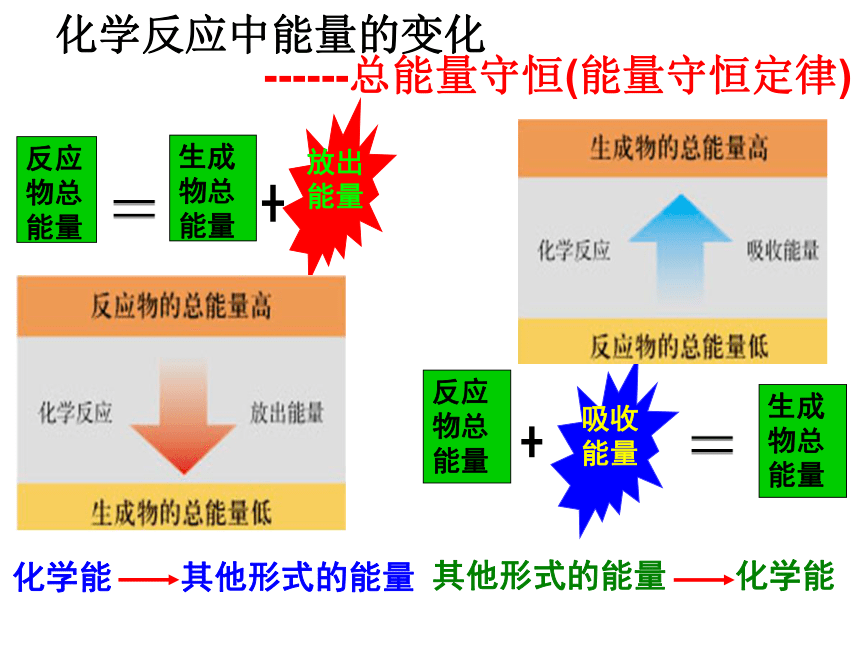
发热镁与盐酸反应有热量放出温度降低氢氧化钡晶体与氯化铵晶体反应需要吸收热量活动与探究一、化学反应中的热量变化一、化学反应中的热量变化1、放热反应与吸热反应吸热反应:有吸收热量 的化学反应放热反应:有热量 放出的化学反应 为什么有的反应会放出热量有的需要吸收热量呢?问题探究一①反应物的总能量 生成物的总能量,反应放出能量。1.宏观:化学反应中能量变化的原因
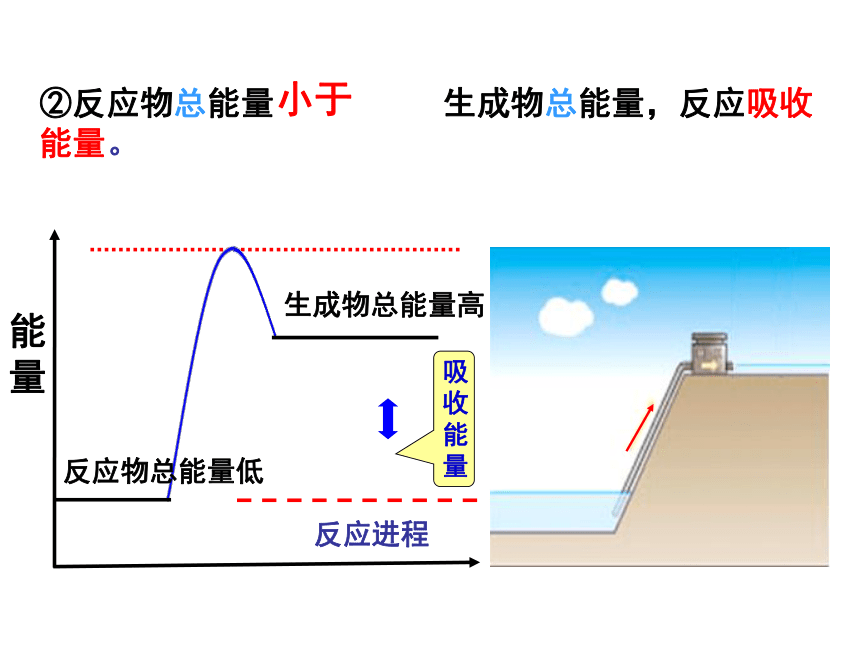
——反应物和生成物的总能量相对大小大于瀑布讨论:水往低处流的过程中,能量发生了什么变化?化学反应中,由总能量高的反应物生成总能量低的生成物时,能量发生了什么变化?能量反应进程②反应物总能量 生成物总能量,反应吸收能量。小于化学反应中能量的变化------总能量守恒(能量守恒定律)反应物的能量之和
E反生成物的能量之和
E生(1)若E反> E生,(2)若E反< E生,放出能量吸收能量放热反应吸热反应规律总结1:宏观:化学反应中能量变化的原因
——反应物和生成物的总能量相对大小化学反应中的能量变化遵循能量守恒定律。放热
反应吸热
反应整理与归纳水煤气的生成反应1.下列说法不正确的是 ( )
A、化学反应除了生成新物质外,还伴随着能量的变化
B、化学反应中能量变化一定表现为热量变化
C、反应物的总能量高于生成物的总能量时,发生放热反应
D、吸热反应贮备能量B检测2. 下列反应既属于氧化还原反应,又属于吸热反应的是 ( )A.铝片与稀盐酸的反应
B.Ba(OH)2·8H2O和NH4Cl的反应
C.灼热的炭与CO2的反应
D.甲烷在氧气中的燃烧反应C4. 下列反应中生成物总能量高于反应物总能量的是 ( )A.碳酸钙受热分解
B.乙醇燃烧
C.铝粉与氧化铁粉末反应
D.氧化钙溶于水A下列说法正确的是:( )
A.需要加热才能发生的反应一定是吸热反应;
B.任何放热反应在常温条件下一定能发生反应;
C.反应物和生成物所具有的总能量决定了是放热还是吸热;
D.吸热反应在一定条件下(如常温、加热等)也能发生反应.CD问题探究二:从本质上分析化学反应为什么伴随能量的变化化学反应的本质是什么?化学键的断裂和形成旧键断裂需要 能量,新键形成会 能量。放 出吸 收阅读课本Page4第三段2 .微观:化学反应中能量变化的原因
——化学键的断裂和形成①断开化学键吸收的总能量 形成化学键释放出的总能量,反应放出能量。小于HClClH②断开化学键吸收的总能量 形成化学键释放出的总能量,反应吸收能量。能量反应进程大于微观:化学反应中能量变化的主要原因
——化学键的断裂和形成大于①断开化学键吸收的总能量 形成化学键释放出的总能量,反应放出能量。②断开化学键吸收的总能量 形成化学键释放出的总能量,反应吸收能量。小于规律总结2:请你试试:
已知拆开1 mol H2需要消耗436.4 kJ能量,拆开1 mol Cl2需要消耗242.7 kJ能量,形成氯化氢分子中的1 mol H-Cl能够释放431.8 kJ能量。
你能根据以上所给的数据判断反应:
H2(g)+Cl2(g)=2HCl(g)
是放热反应还是吸热反应?问 题 解 决2、热化学方程式用来表示化学反应中放出或吸收的热量2H2(g) + O2(g) = 2H2O(l) △H =-571.6 kJ ?mol-1例如:一、化学反应中的热量变化(1)标明物质的状态,用g、l、s分别代表气态(gas)、液态 (liquid)、固态(solid)。 (2)用△H 标明恒压条件下反应放出或吸收的热量,放热为负值,吸热为正值。 (3)热化学方程式中各物质前的化学计量数不表示分子个数,只表示物质的量,因此可以是整数或简单分数。热化学方程式特点:2、热化学方程式一、化学反应中的热量变化(4)对于同一化学反应,当化学计量数不同时,其△H 也不同,即△H 的值与计量数成正比。P35 问题解决典型例题 判断热化学方程式的正误;已知在1×105 Pa,298K条件下,2mol氢气
燃烧生成水蒸气放出 484kJ热量,下列热化学方程式
正确的是 A. H2 (g)+1/2O2 (g)=H2O(g) ;ΔH=-242kJ·mol-1 B.2H2(g)+O2(g)=2H2O(l) ;ΔH=-484kJ·mol-1 C.H2 (g)+1/2O2 (g)=H2O(g) ;ΔH=+242kJ·mol-1 D.2H2 (g)+O2 (g)=2H2O(g) ;ΔH=-484kJ·mol-1
注意:①物质聚集状态②吸放热与ΔH 的“+”、“-”
③吸放热的量与系数对应A D例1. 已知每1 mol 碳完全燃烧生成二氧化碳时将放出393.6kJ热量,写出该反应的热化学方程式。例2. 已知每1 mol 辛烷(C8H18)完全燃烧生成二氧化碳和液态水时将放出5472kJ热量,写出该反应的热化学方程式。 C(s)+O2(g)=CO2(g);△H=-393.6kJ/molC8H18(g) +12.5O2(g) →8CO2(g) + 9H2O(l);△H =-5472kJ/mol例3. 已知每1 mol 甲烷完全燃烧生成二氧化碳和液态水时将放出889.6kJ热量,写出该反应的热化学方程式。例4. 已知每1 mol 乙醇完全燃烧生成二氧化碳和液态水时将放出1366.8kJ热量,写出该反应的热化学方程式。C2H6O (l)+ 3O2 (g)→ 2CO2 (g)+ 3H2O(l); △H =-1366.8kJ/mol CH4(g) +2O2(g) →CO2(g) + 2H2O(l);△H =-889.6kJ/mol
发热镁与盐酸反应有热量放出温度降低氢氧化钡晶体与氯化铵晶体反应需要吸收热量活动与探究一、化学反应中的热量变化一、化学反应中的热量变化1、放热反应与吸热反应吸热反应:有吸收热量 的化学反应放热反应:有热量 放出的化学反应 为什么有的反应会放出热量有的需要吸收热量呢?问题探究一①反应物的总能量 生成物的总能量,反应放出能量。1.宏观:化学反应中能量变化的原因
——反应物和生成物的总能量相对大小大于瀑布讨论:水往低处流的过程中,能量发生了什么变化?化学反应中,由总能量高的反应物生成总能量低的生成物时,能量发生了什么变化?能量反应进程②反应物总能量 生成物总能量,反应吸收能量。小于化学反应中能量的变化------总能量守恒(能量守恒定律)反应物的能量之和
E反生成物的能量之和
E生(1)若E反> E生,(2)若E反< E生,放出能量吸收能量放热反应吸热反应规律总结1:宏观:化学反应中能量变化的原因
——反应物和生成物的总能量相对大小化学反应中的能量变化遵循能量守恒定律。放热
反应吸热
反应整理与归纳水煤气的生成反应1.下列说法不正确的是 ( )
A、化学反应除了生成新物质外,还伴随着能量的变化
B、化学反应中能量变化一定表现为热量变化
C、反应物的总能量高于生成物的总能量时,发生放热反应
D、吸热反应贮备能量B检测2. 下列反应既属于氧化还原反应,又属于吸热反应的是 ( )A.铝片与稀盐酸的反应
B.Ba(OH)2·8H2O和NH4Cl的反应
C.灼热的炭与CO2的反应
D.甲烷在氧气中的燃烧反应C4. 下列反应中生成物总能量高于反应物总能量的是 ( )A.碳酸钙受热分解
B.乙醇燃烧
C.铝粉与氧化铁粉末反应
D.氧化钙溶于水A下列说法正确的是:( )
A.需要加热才能发生的反应一定是吸热反应;
B.任何放热反应在常温条件下一定能发生反应;
C.反应物和生成物所具有的总能量决定了是放热还是吸热;
D.吸热反应在一定条件下(如常温、加热等)也能发生反应.CD问题探究二:从本质上分析化学反应为什么伴随能量的变化化学反应的本质是什么?化学键的断裂和形成旧键断裂需要 能量,新键形成会 能量。放 出吸 收阅读课本Page4第三段2 .微观:化学反应中能量变化的原因
——化学键的断裂和形成①断开化学键吸收的总能量 形成化学键释放出的总能量,反应放出能量。小于HClClH②断开化学键吸收的总能量 形成化学键释放出的总能量,反应吸收能量。能量反应进程大于微观:化学反应中能量变化的主要原因
——化学键的断裂和形成大于①断开化学键吸收的总能量 形成化学键释放出的总能量,反应放出能量。②断开化学键吸收的总能量 形成化学键释放出的总能量,反应吸收能量。小于规律总结2:请你试试:
已知拆开1 mol H2需要消耗436.4 kJ能量,拆开1 mol Cl2需要消耗242.7 kJ能量,形成氯化氢分子中的1 mol H-Cl能够释放431.8 kJ能量。
你能根据以上所给的数据判断反应:
H2(g)+Cl2(g)=2HCl(g)
是放热反应还是吸热反应?问 题 解 决2、热化学方程式用来表示化学反应中放出或吸收的热量2H2(g) + O2(g) = 2H2O(l) △H =-571.6 kJ ?mol-1例如:一、化学反应中的热量变化(1)标明物质的状态,用g、l、s分别代表气态(gas)、液态 (liquid)、固态(solid)。 (2)用△H 标明恒压条件下反应放出或吸收的热量,放热为负值,吸热为正值。 (3)热化学方程式中各物质前的化学计量数不表示分子个数,只表示物质的量,因此可以是整数或简单分数。热化学方程式特点:2、热化学方程式一、化学反应中的热量变化(4)对于同一化学反应,当化学计量数不同时,其△H 也不同,即△H 的值与计量数成正比。P35 问题解决典型例题 判断热化学方程式的正误;已知在1×105 Pa,298K条件下,2mol氢气
燃烧生成水蒸气放出 484kJ热量,下列热化学方程式
正确的是 A. H2 (g)+1/2O2 (g)=H2O(g) ;ΔH=-242kJ·mol-1 B.2H2(g)+O2(g)=2H2O(l) ;ΔH=-484kJ·mol-1 C.H2 (g)+1/2O2 (g)=H2O(g) ;ΔH=+242kJ·mol-1 D.2H2 (g)+O2 (g)=2H2O(g) ;ΔH=-484kJ·mol-1
注意:①物质聚集状态②吸放热与ΔH 的“+”、“-”
③吸放热的量与系数对应A D例1. 已知每1 mol 碳完全燃烧生成二氧化碳时将放出393.6kJ热量,写出该反应的热化学方程式。例2. 已知每1 mol 辛烷(C8H18)完全燃烧生成二氧化碳和液态水时将放出5472kJ热量,写出该反应的热化学方程式。 C(s)+O2(g)=CO2(g);△H=-393.6kJ/molC8H18(g) +12.5O2(g) →8CO2(g) + 9H2O(l);△H =-5472kJ/mol例3. 已知每1 mol 甲烷完全燃烧生成二氧化碳和液态水时将放出889.6kJ热量,写出该反应的热化学方程式。例4. 已知每1 mol 乙醇完全燃烧生成二氧化碳和液态水时将放出1366.8kJ热量,写出该反应的热化学方程式。C2H6O (l)+ 3O2 (g)→ 2CO2 (g)+ 3H2O(l); △H =-1366.8kJ/mol CH4(g) +2O2(g) →CO2(g) + 2H2O(l);△H =-889.6kJ/mol
