化学平衡状态
图片预览









文档简介
课件35张PPT。第三节 化学平衡
一、化学平衡状态
思考:
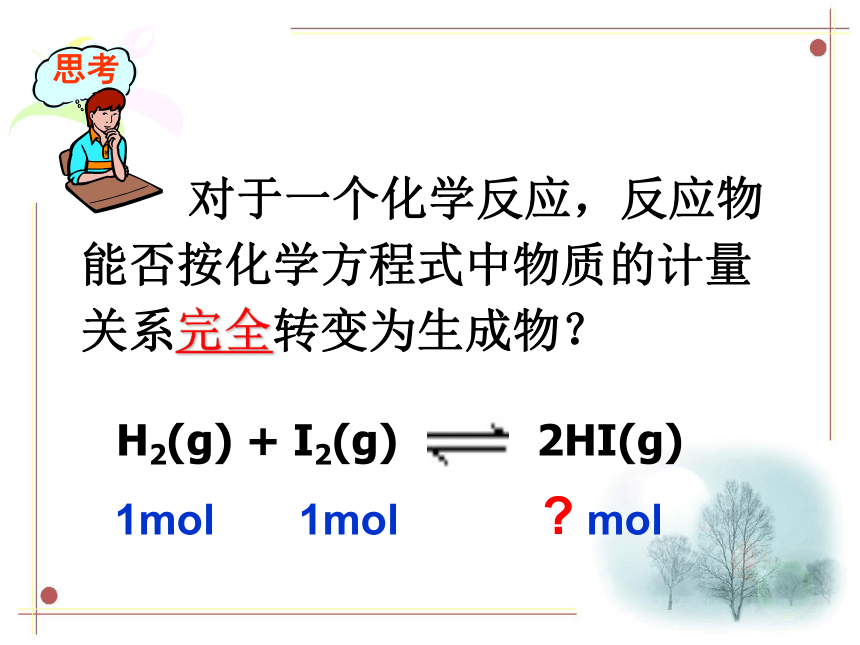
20℃时,将一块质量为40 g 的NaCl晶体投入到100 g 水中,充分搅拌,至固体不再溶解为止,静置。经过相当长的时间后,发现NaCl晶体质量不再发生变化,但NaCl晶体的形状在不断发生改变,为什么? 对于一个化学反应,反应物能否按化学方程式中物质的计量关系完全转变为生成物?思考H2(g) + I2(g) 2HI(g) 1mol 1mol ? molV溶解 >V结晶V溶解V溶解 =V结晶可逆反应正反应:从左向右进行的反应。
逆反应:从右向左进行的反应。单位时间反应物浓度的减少或生成物浓度的增加单位时间反应物浓度的增加或生成物浓度的减少
决定于生成物浓度决定于反应物浓度可逆反应的特点:
⑴同一条件下正逆反应同时进行
⑵可逆反应通常不能进行到底,反应物的转化率不能达到100%,反应体系中得到的总是反应物与生成物的混合物。
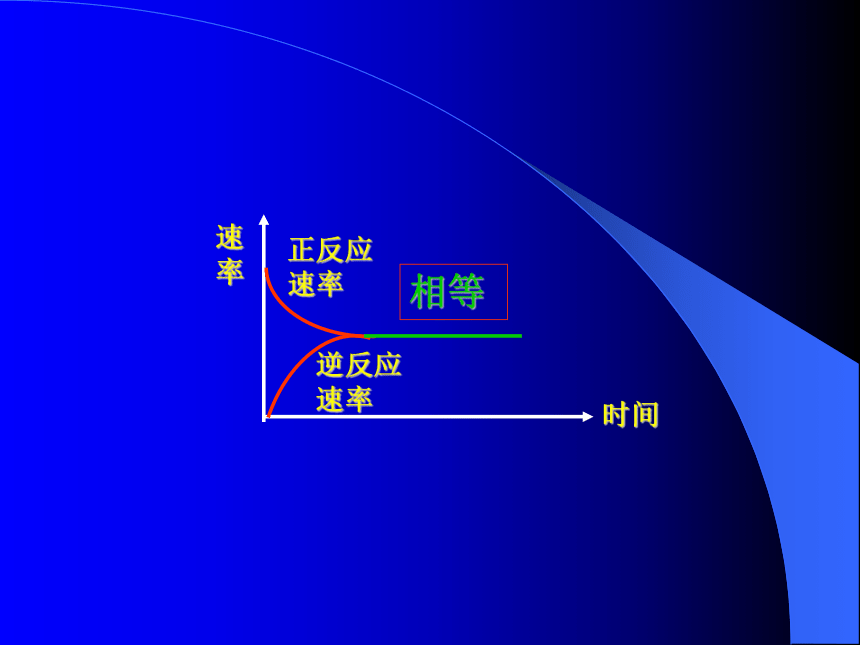
正反应速率逆反应速率相等时间速率1、定义化学平衡状态,就是指在一定条件下的可逆反应里,正反应速率和逆反应速率相等,反应混合物中各组分的浓度保持不变的状态。注意三点前提(适用范围):可逆反应内在本质:v(正)= v(逆) ≠0外在标志:反应混合物中各组分
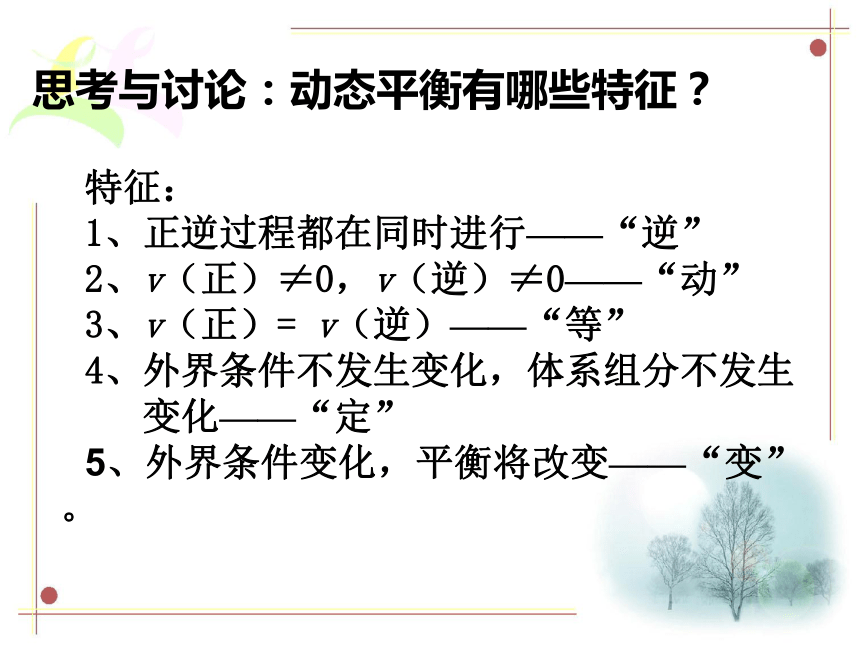
的浓度保持不变2、化学平衡状态的条件:外界条件不变思考与讨论:动态平衡有哪些特征?特征:
1、正逆过程都在同时进行——“逆”
2、v(正)≠0,v(逆)≠0——“动”
3、v(正)= v(逆)——“等”
4、外界条件不发生变化,体系组分不发生
变化——“定”
5、外界条件变化,平衡将改变——“变”。 如何判断可逆反应达到平衡状态?v正=v逆
1、同一物质
2、消耗=生成含量保持不变:
1、物质的量
2、物质的量浓度
3、百分含量 在一定温度下,可逆反应A(气)+3B(气) 2C(气)达到平衡的标志是 ( )
A. C的生成速率与C分解的速率相等
B. 单位时间生成nmolA,同时生成3nmolB
C. 单位时间生成B的速率,与生成C的速率 相等 (数值)
D. 单位时间生成nmolA,同时生成2nmolCADA SO2的消耗速率等于SO3的生成速率
B SO2的生成速率等于SO3的生成速率
C SO2的消耗速率等于O2消耗速率的2倍
D SO3的生成速率等于O2生成速率的 2倍
BD 下列说法可以证明反应N2+3H2 2NH3 已达平衡状态的是( )
A.1个N≡N键断裂的同时,有3个H-H键形成
B.1个N≡N键断裂的同时,有3个H-H键断裂
C.1个N≡N键断裂的同时,有6个N-H键断裂
D.1个N≡N键断裂的同时,有6个N-H键形成AC 下列说法中可以充分说明反应: P(气)+Q(气) R(气)+S(气) , 在恒温恒容下已达平衡状态的是( )
(A) P、Q、R、S的浓度不再变化
(B) P、Q、R、S的分子数比为1:1:1:1
(C)反应容器内总物质的量不随时间而变化
(D)混合气体的压强
(E)气体的平均分子量
(F)各组分的质量分数不再改变
(G)混合气体的密度
下列说法中可以充分说明反应:
在恒温恒容下已达平衡状态的是( )
(A) P、Q、R、S的浓度不再变化
(B) P、Q、R、S的分子数比为1:1:1:1
(C)反应容器内总物质的量不随时间而变化
(D)混合气体的压强
(E)气体的平均分子量
(F)各组分的质量分数不再改变
(G)混合气体的密度
下列说法中可以充分说明反应:
A(固)+3B(气) 2C(气)+D(气) , 在恒温恒容下已达平衡状态的是( )
(A)混合气体的压强
(B)气体的平均分子量
(C)各组分的质量分数不再改变
(D)混合气体的密度
下列说法中可以充分说明反应: A(g)+3B(g) 2C(g)+D(g), 在恒温恒容下已达平衡状态的是( )
(A)混合气体的压强
(B)气体的平均分子量
(C)各组分的质量分数不再改变
(D)混合气体的密度
下列说法中可以充分说明反应: A(g)+3B(g) 2C(g)+2D(g),在恒温恒容下已达平衡状态的是( )
(A)混合气体的压强
(B)气体的平均分子量
(C)各组分的质量分数不再改变
(D)混合气体的密度
在一定温度下的恒容容器中,当下列物理量不再发生变化时,表明反应: A(固)+3B(气) 2C(气)+D(气)已达平衡状态的是(其中只有B气体有颜色) ( )
A.混合气体的压强 B.混合气体的密度
C.气体的平均分子量 D.气体的颜色BCD 在一定温度下,下列叙述不是可逆反应
A(气)+3B(气) 2C(气)+2D(固)达到平衡的标志的是 ( )
①C的生成 速率与C的分解速率相等
②单位时间内生成amolA,同时生成3amolB
③A、B、C的浓度不再变化
④A、B、C的百分含量不在变化
⑤混合气体的总压强不再变化
⑥混合气体的物质的量不再变化
⑦单位时间内消耗amolA,同时生成 3amolB
⑧A、B、C、D的分子数之比为1:3:2:2
A.②⑧ B.②⑤⑧
C.①③④⑦ D.②⑤⑥⑧AB【能力训练】
5、在一定温度下的定容容器中,当下列物理量不再发生变化时,表明反应A(固)+2B(气) ???C(气)+D(气)已达平衡状态的是( )
A.混合气体的压强 B.混合气体密度
C.B的物质的量浓度 D.气体总物质的量
BCC【能力训练】
6、在恒温下,固定容积的密闭容器中,有可逆反应2SO3(气) ???2SO2(气)+O2(气),可用来确定该反应已达到平衡状态的是( )
A.容器内压强不随时间改变
B.SO3的消耗速率与SO2的生成速率相等
C.正反应生成SO2的速率与逆反应生成SO3的速率相等
D.容器内混合气体的密度不随时间改变
AC【能力训练】
7、在一定温下 ??????????????????????????达到平衡的标志是( )
A.单位时间内生成nmol H2,同时生成nmol I2
B.容器内总压强不随时间而变化
C.单位时间内生成2n molHI,同时生成n molH2
D.当 ??????????????时
CCD化学平衡状态的判断【例1】 在一定温度下,可逆反应A(气)+3B(气) 2C(气)达到平衡的标志是 ( )
A. C的生成速率与C分解的速率相等
B. 单位时间内生成nmolA,同时生成3nmolB
C. A、B、C的浓度不再变化
D. A、B、C的分子数比为1:3:2AC【例2】 下列说法中可以充分说明反应: P(气)+Q(气) R(气)+S(气) , 在恒温下已达平衡状态的是( )
A. 反应容器内压强不随时间变化 B. P和S的生成速率相等
C. 反应容器内P、Q、R、S四者共存 D. 反应容器内总物质的量不随时间而 变化B【例3】下列说法可以证明反应N2+3H2 2NH3 已达平衡状态的是( )
A.1个N≡N键断裂的同时,有3个H-H键形成
B.1个N≡N键断裂的同时,有3个H-H键断裂
C.1个N≡N键断裂的同时,有6个N-H键断裂
D.1个N≡N键断裂的同时,有6个N-H键形成AC 【例4】在一定温度下的恒容容器中,当下列物理量不再发生变化时,表明反应: A(固)+3B(气) 2C(气)+D(气)已达平衡状态的是 ( )
A.混合气体的压强 B.混合气体的密度
C.B的物质的量浓度 D.气体的总物质的量
BC【例5】 在一定温度下,下列叙述不是可逆反应A(气)+3B(气) 2C(气)+2D(固)达到平衡的标志的是
①C的生成 速率与C的分解速率相等 ( )
②单位时间内生成amolA,同时生成3amolB
③A、B、C的浓度不再变化
④A、B、C的分压强不再变化
⑤混合气体的总压强不再变化
⑥混合气体的物质的量不再变化
⑦单位时间内消耗amolA,同时生成 3amolB
⑧A、B、C、D的分子数之比为1:3:2:2
A.②⑧ B.②⑤⑧ C.①③④⑦ D.②⑤⑥⑧A能够说明 N2 + 3H2 2NH3反应在密闭容器中已达到平衡状态的是 :A、t min内生成1molNH3同时消耗0.5molN2B、t min内,生成1molN2同时消耗3molH2C、 某时间内断裂3molH-H键的同时,断裂6molN-H键1、容器内N2、H2、NH3三者共存 2、容器内N2、H2、NH3三者浓度相等3、 容器内N2、H2、NH3的浓度比恰为
1:3:24、容器内质量不随时间的变化而变化5、容器内压强不随时间的变化而变化6、容器内密度不再发生变化7、容器内的平均摩尔质量不再发生变化能够说明 N2 + 3H2 2NH3反应在密闭容器中已达到平衡状态的是 :
一、化学平衡状态
思考:
20℃时,将一块质量为40 g 的NaCl晶体投入到100 g 水中,充分搅拌,至固体不再溶解为止,静置。经过相当长的时间后,发现NaCl晶体质量不再发生变化,但NaCl晶体的形状在不断发生改变,为什么? 对于一个化学反应,反应物能否按化学方程式中物质的计量关系完全转变为生成物?思考H2(g) + I2(g) 2HI(g) 1mol 1mol ? molV溶解 >V结晶V溶解
逆反应:从右向左进行的反应。单位时间反应物浓度的减少或生成物浓度的增加单位时间反应物浓度的增加或生成物浓度的减少
决定于生成物浓度决定于反应物浓度可逆反应的特点:
⑴同一条件下正逆反应同时进行
⑵可逆反应通常不能进行到底,反应物的转化率不能达到100%,反应体系中得到的总是反应物与生成物的混合物。
正反应速率逆反应速率相等时间速率1、定义化学平衡状态,就是指在一定条件下的可逆反应里,正反应速率和逆反应速率相等,反应混合物中各组分的浓度保持不变的状态。注意三点前提(适用范围):可逆反应内在本质:v(正)= v(逆) ≠0外在标志:反应混合物中各组分
的浓度保持不变2、化学平衡状态的条件:外界条件不变思考与讨论:动态平衡有哪些特征?特征:
1、正逆过程都在同时进行——“逆”
2、v(正)≠0,v(逆)≠0——“动”
3、v(正)= v(逆)——“等”
4、外界条件不发生变化,体系组分不发生
变化——“定”
5、外界条件变化,平衡将改变——“变”。 如何判断可逆反应达到平衡状态?v正=v逆
1、同一物质
2、消耗=生成含量保持不变:
1、物质的量
2、物质的量浓度
3、百分含量 在一定温度下,可逆反应A(气)+3B(气) 2C(气)达到平衡的标志是 ( )
A. C的生成速率与C分解的速率相等
B. 单位时间生成nmolA,同时生成3nmolB
C. 单位时间生成B的速率,与生成C的速率 相等 (数值)
D. 单位时间生成nmolA,同时生成2nmolCADA SO2的消耗速率等于SO3的生成速率
B SO2的生成速率等于SO3的生成速率
C SO2的消耗速率等于O2消耗速率的2倍
D SO3的生成速率等于O2生成速率的 2倍
BD 下列说法可以证明反应N2+3H2 2NH3 已达平衡状态的是( )
A.1个N≡N键断裂的同时,有3个H-H键形成
B.1个N≡N键断裂的同时,有3个H-H键断裂
C.1个N≡N键断裂的同时,有6个N-H键断裂
D.1个N≡N键断裂的同时,有6个N-H键形成AC 下列说法中可以充分说明反应: P(气)+Q(气) R(气)+S(气) , 在恒温恒容下已达平衡状态的是( )
(A) P、Q、R、S的浓度不再变化
(B) P、Q、R、S的分子数比为1:1:1:1
(C)反应容器内总物质的量不随时间而变化
(D)混合气体的压强
(E)气体的平均分子量
(F)各组分的质量分数不再改变
(G)混合气体的密度
下列说法中可以充分说明反应:
在恒温恒容下已达平衡状态的是( )
(A) P、Q、R、S的浓度不再变化
(B) P、Q、R、S的分子数比为1:1:1:1
(C)反应容器内总物质的量不随时间而变化
(D)混合气体的压强
(E)气体的平均分子量
(F)各组分的质量分数不再改变
(G)混合气体的密度
下列说法中可以充分说明反应:
A(固)+3B(气) 2C(气)+D(气) , 在恒温恒容下已达平衡状态的是( )
(A)混合气体的压强
(B)气体的平均分子量
(C)各组分的质量分数不再改变
(D)混合气体的密度
下列说法中可以充分说明反应: A(g)+3B(g) 2C(g)+D(g), 在恒温恒容下已达平衡状态的是( )
(A)混合气体的压强
(B)气体的平均分子量
(C)各组分的质量分数不再改变
(D)混合气体的密度
下列说法中可以充分说明反应: A(g)+3B(g) 2C(g)+2D(g),在恒温恒容下已达平衡状态的是( )
(A)混合气体的压强
(B)气体的平均分子量
(C)各组分的质量分数不再改变
(D)混合气体的密度
在一定温度下的恒容容器中,当下列物理量不再发生变化时,表明反应: A(固)+3B(气) 2C(气)+D(气)已达平衡状态的是(其中只有B气体有颜色) ( )
A.混合气体的压强 B.混合气体的密度
C.气体的平均分子量 D.气体的颜色BCD 在一定温度下,下列叙述不是可逆反应
A(气)+3B(气) 2C(气)+2D(固)达到平衡的标志的是 ( )
①C的生成 速率与C的分解速率相等
②单位时间内生成amolA,同时生成3amolB
③A、B、C的浓度不再变化
④A、B、C的百分含量不在变化
⑤混合气体的总压强不再变化
⑥混合气体的物质的量不再变化
⑦单位时间内消耗amolA,同时生成 3amolB
⑧A、B、C、D的分子数之比为1:3:2:2
A.②⑧ B.②⑤⑧
C.①③④⑦ D.②⑤⑥⑧AB【能力训练】
5、在一定温度下的定容容器中,当下列物理量不再发生变化时,表明反应A(固)+2B(气) ???C(气)+D(气)已达平衡状态的是( )
A.混合气体的压强 B.混合气体密度
C.B的物质的量浓度 D.气体总物质的量
BCC【能力训练】
6、在恒温下,固定容积的密闭容器中,有可逆反应2SO3(气) ???2SO2(气)+O2(气),可用来确定该反应已达到平衡状态的是( )
A.容器内压强不随时间改变
B.SO3的消耗速率与SO2的生成速率相等
C.正反应生成SO2的速率与逆反应生成SO3的速率相等
D.容器内混合气体的密度不随时间改变
AC【能力训练】
7、在一定温下 ??????????????????????????达到平衡的标志是( )
A.单位时间内生成nmol H2,同时生成nmol I2
B.容器内总压强不随时间而变化
C.单位时间内生成2n molHI,同时生成n molH2
D.当 ??????????????时
CCD化学平衡状态的判断【例1】 在一定温度下,可逆反应A(气)+3B(气) 2C(气)达到平衡的标志是 ( )
A. C的生成速率与C分解的速率相等
B. 单位时间内生成nmolA,同时生成3nmolB
C. A、B、C的浓度不再变化
D. A、B、C的分子数比为1:3:2AC【例2】 下列说法中可以充分说明反应: P(气)+Q(气) R(气)+S(气) , 在恒温下已达平衡状态的是( )
A. 反应容器内压强不随时间变化 B. P和S的生成速率相等
C. 反应容器内P、Q、R、S四者共存 D. 反应容器内总物质的量不随时间而 变化B【例3】下列说法可以证明反应N2+3H2 2NH3 已达平衡状态的是( )
A.1个N≡N键断裂的同时,有3个H-H键形成
B.1个N≡N键断裂的同时,有3个H-H键断裂
C.1个N≡N键断裂的同时,有6个N-H键断裂
D.1个N≡N键断裂的同时,有6个N-H键形成AC 【例4】在一定温度下的恒容容器中,当下列物理量不再发生变化时,表明反应: A(固)+3B(气) 2C(气)+D(气)已达平衡状态的是 ( )
A.混合气体的压强 B.混合气体的密度
C.B的物质的量浓度 D.气体的总物质的量
BC【例5】 在一定温度下,下列叙述不是可逆反应A(气)+3B(气) 2C(气)+2D(固)达到平衡的标志的是
①C的生成 速率与C的分解速率相等 ( )
②单位时间内生成amolA,同时生成3amolB
③A、B、C的浓度不再变化
④A、B、C的分压强不再变化
⑤混合气体的总压强不再变化
⑥混合气体的物质的量不再变化
⑦单位时间内消耗amolA,同时生成 3amolB
⑧A、B、C、D的分子数之比为1:3:2:2
A.②⑧ B.②⑤⑧ C.①③④⑦ D.②⑤⑥⑧A能够说明 N2 + 3H2 2NH3反应在密闭容器中已达到平衡状态的是 :A、t min内生成1molNH3同时消耗0.5molN2B、t min内,生成1molN2同时消耗3molH2C、 某时间内断裂3molH-H键的同时,断裂6molN-H键1、容器内N2、H2、NH3三者共存 2、容器内N2、H2、NH3三者浓度相等3、 容器内N2、H2、NH3的浓度比恰为
1:3:24、容器内质量不随时间的变化而变化5、容器内压强不随时间的变化而变化6、容器内密度不再发生变化7、容器内的平均摩尔质量不再发生变化能够说明 N2 + 3H2 2NH3反应在密闭容器中已达到平衡状态的是 :
