质量守恒定律教学设计
图片预览

文档简介
质量守恒定律(第一课时)
内容分析:本节课是义务教育课程标准实验教科书《化学》九年级(上册)第五单元课题一的内容。教材首先开门见山,提出“化学反应前后物质的质量有没有变化呢?”这一问题,让学生思考,并通过作出假设,实验探究,交流讨论,得出参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和这一规律。然后教材又给出碳酸钠与盐酸反应前后质量的测定、镁条燃烧前后质量的测定这两个实验方案,让学生比较前后质量变化情况,并讨论发生变化的原因,进而较全面地认识化学反应中的质量关系,在学生已对物质结构知识有了初步认识的基础上,引导学生从化学反应的微粒实质进行分析,加深对质量守恒定律的理解,并为学习化学方程式作好铺垫,也是对学生进行辨证唯物主义教育的重要内容。教材的这种处理方法,学生接受起来十分自然,无论是宏观事实,还是微观理论都具有很强的说服力。
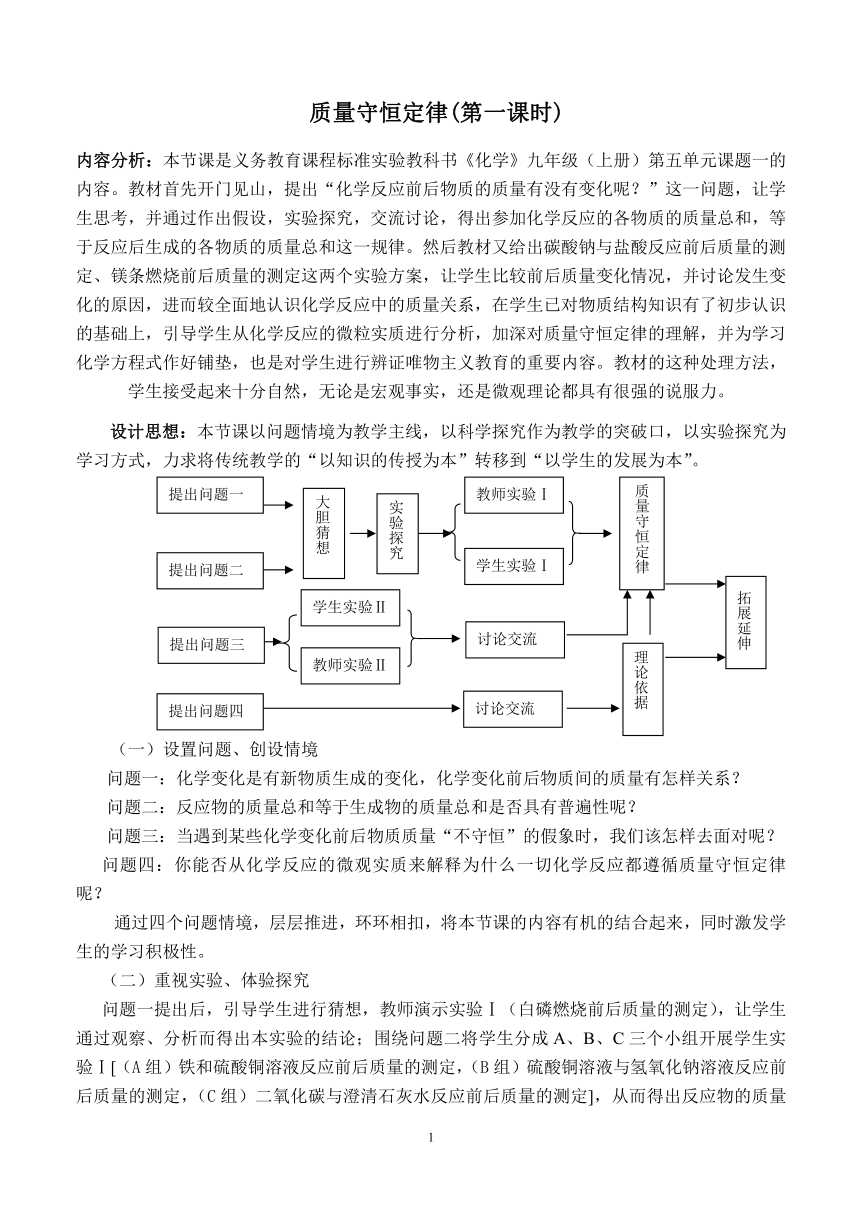
设计思想:本节课以问题情境为教学主线,以科学探究作为教学的突破口,以实验探究为学习方式,力求将传统教学的“以知识的传授为本”转移到“以学生的发展为本”。
(一)设置问题、创设情境
问题一:化学变化是有新物质生成的变化,化学变化前后物质间的质量有怎样关系?
问题二:反应物的质量总和等于生成物的质量总和是否具有普遍性呢?
问题三:当遇到某些化学变化前后物质质量“不守恒”的假象时,我们该怎样去面对呢?
问题四:你能否从化学反应的微观实质来解释为什么一切化学反应都遵循质量守恒定律呢?
通过四个问题情境,层层推进,环环相扣,将本节课的内容有机的结合起来,同时激发学生的学习积极性。
(二)重视实验、体验探究
问题一提出后,引导学生进行猜想,教师演示实验Ⅰ(白磷燃烧前后质量的测定),让学生通过观察、分析而得出本实验的结论;围绕问题二将学生分成A、B、C三个小组开展学生实验Ⅰ[(A组)铁和硫酸铜溶液反应前后质量的测定,(B组)硫酸铜溶液与氢氧化钠溶液反应前后质量的测定,(C组)二氧化碳与澄清石灰水反应前后质量的测定],从而得出反应物的质量总和等于生成物的质量总和——形成质量守恒定律的概念;再围绕问题三通过学生实验Ⅱ(碳酸钠粉末与盐酸反应前后质量的测定)、教师演示实验Ⅱ(镁条在空气中燃烧反应前后质量的测定),让学生形成问题冲突,通过学生的讨论交流解决问题三,使学生进一步加深对质量守恒定律的理解。
(三)动画摸拟、突破难点
最后通过问题四,将研究的问题推向理论高度,让学生在观看模拟动画—水分子分解的基础上,通过师生共同讨论而总结出质量守恒定律的微观本质。
(四)拓展训练、总结提升
通过拓展训练加深对质量守恒定律的理解。课堂总结时,让学生交流本节课所学的知识及方法,让学生体会到这节课我们是从实验探究和理论研究两个方面得出了质量守恒定律,并知道定量研究是科学研究的一种重要方法。
[教学目标]
1.知识与技能
(1)通过对化学反应中反应物和生成物的质量的实验探究,让学生知道什么叫质量守恒定律,理解其涵义。
(2)进一步学的使用。
2.过程与方法
(1)通过实验探究,认识科学探究的意义和基本过程,认识定量研究在化学科学探究和发展中的重要地位和作用。
(2)初步学会运用观察、实验等方法获得信息,学会运用比较、分析、归纳、概括等方法获得正确的结论。
(3)初步培养学生的定量研究和分析推理能力。
3.情感态度与价值观
(1)增强探究兴趣,获得探究的乐趣。
(2)树立“物质不灭”的辩证统一观点。
(3)逐步养成善于合作、勤于思考、严谨求实、勇于创新和实践的科学精神。
[教学重点]
学生在实验探究基础上归纳出质量守恒定律及质量守恒定律的应用。
[教学难点]
运用化学反应的实质从微观角度解释和分析质量守恒定律。
[教学方法]
实验探究法、讨论法、多媒体辅助教学法
[教学准备]
1.实验准备:
教师演示Ⅰ(白磷燃烧前后质量的测定);
教师演示Ⅱ(镁条在空气中燃烧反应前后质量的测定)。
学生实验Ⅰ(A组)铁和硫酸铜溶液反应前后质量的测定;
(B组)硫酸铜溶液与氢氧化钠溶液反应前后质量的测定;
(C组)二氧化碳与澄清石灰水反应前后质量的测定。
学生实验Ⅱ: 碳酸钠粉末与盐酸反应前后质量的测定。
2. PPT多媒体课件
[教学过程]
1.引入课题
[创设问题情境]:我们知道化学变化时一定产生新物质,那么在化学变化前后物质间的质量有怎样关系呢?今天我们一起来探究这个问题。(板书:课题1质量守恒定律)。
2.探究活动1
[提出问题一]:化学变化前后,反应物的总质量和生成物的总质量存在着怎样的关系呢?
[学生猜想一]:反应物的总质量等于生成物的总质量。
[学生猜想二]:反应物的总质量大于生成物的总质量。
[学生猜想三]:反应物的总质量小于生成物的总质量。
[设问]:究竟哪一种猜想是正确的呢?暂且不作评判,让我们用实验事实来说话。
(1)教师演示Ⅰ(白磷燃烧前后质量的测定,装置如右图)。
(2)学生活动:填写实验报告,交流实验现象。
实验步骤 实验现象 实验结论
1.称量 所称质量M1= g 反应表达式_______________,反应物的总质量_______生成物的总质量。
2.用玻璃棒引燃 观察到
3.冷却后再次称量 所称质量M2= g
(3)师生活动:借助于PPT课件引导学生分析反应前后分别测得的是哪些物质的总质量?
(4)学生活动:总结交流得出结论(参加反应的白磷和氧气的质量总和等于反应后生成的五氧化二磷的质量)。
设计意图:让学生体验发现问题、提出问题、分析问题和解决问题的科学研究过程,培养学生严谨求实的科学态度。同时通过多媒体课件引导学生对反应前后物质的总质量进行分析,从而得出本实验的结论。
3.探究活动2
[提出问题二]:反应物的质量总和等于生成物的质量总和是否具有普遍性呢?
(1)学生实验Ⅰ(A组)铁和硫酸铜溶液反应前后质量的测定。
学生实验Ⅰ(B组)硫酸铜溶液与氢氧化钠溶液反应前后质量的测定
学生实验Ⅰ(C组)二氧化碳与澄清石灰水反应前后质量的测定。
A组实验 B组实验 C组实验
(2)学生活动(交流实验现象、实验结论)
(3)师生活动(建立质量守恒定律的概念)
(4)教师总结:参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和。这个规律就叫做质量守恒定律。(板书:一、质量守恒定律 1概念:)
(5)师生活动:(引导学生理解质量守恒定律的内涵)
(6)学生活动:(讨论)
①将3g镁在足量的氧气中完全燃烧,生成5g氧化镁,参加反应的氧气的质量为 g。
②加热2.45g氯酸钾和0.8g二氧化锰的混合物,完全反应后得氯化钾1.49g,同时生成氧气的质量为 g。
③“蜡烛燃烧时慢慢变短,最后什么都没有留下,这不符合质量守恒定律”。这种说法对吗?如何解释?
设计意图:本环节通过三组学生实验旨在让学生亲身体验科学探究过程,通过实验、分析、讨论、表达交流而得出化学变化中普遍遵循的规律——质量守恒定律,证实了自己的猜想,并体验成功的喜悦。通过三个思考题让学生初步学会利用质量守恒定律解决实际问题,以达到巩固概念的目的,同时思考题③又具有承上启下的作用。
4.探究活动3
[提出问题三]: 当遇到某些化学变化前后物质质量“不守恒”的假象时,我们该怎样去面对呢?
(1)学生实验Ⅱ(碳酸钠粉末与盐酸反应前后质量的测定)。
(2)教师实验Ⅱ(镁条在空气中燃烧反应前后质量的测定)。
(3)学生活动:思考、讨论、交流实验现象和结论。
①碳酸钠与盐酸反应质量前后,质量“不守恒”的原因是什么?
②镁条燃烧前后,“不守恒”的原因是什么?
③可采取什么措施使上述两种情况下的天平保持平衡?
④当我们遇到某些化学变化前后物质质量不守恒的假象时,我们该怎样去面对呢?
(4)师生总结:质量守恒定律是一切化学反应都遵循的普遍规律。
设计意图:让学生在实验中形成问题冲突,并通过学生的讨论交流,使学生进一步加深对质量守恒定律的理解,激发了学生的兴趣,开拓了学生的思维,培养了学生的科学探究能力以及开拓创新的精神。
5.探究活动4
[提出问题四]:你能否从化学反应的实质来解释为什么一切化学反应都遵循质量守恒定律呢?
(1)学生活动:(观看模拟动画—水分子的分解)
(2)学生活动:(运用分子、原子的知识解释质量守恒定律)
(3)教师活动:(板书:二、质量守恒定律的理论解释)
设计意图:问题四的提出将研究的问题推向理论高度,让学生在观看模拟动画—水分子分解的基础上,通过师生共同讨论而总结出质量守恒定律的微观本质。
6.课堂小结:
(1)说说质量守恒定律的运用。
(2)谈谈本节课所学到的方法
设计意图:旨在让学生学会归纳、学会总结、学会感悟,避免了传统教学中教师包办课堂小结的做法,培养了学生归纳知识的能力,增强了他们对学习方法的感悟。
7. 拓展延伸
(1)蔗糖受热分解生成碳和水,由此可知蔗糖中含有哪几种元素?
(2)假如蔗糖分解后所生成的碳原子和水分子的个数比为12∶11 ,则蔗糖分子中碳、氢、氧的原子个数比为多少?
(3)已知蜡烛中不含氧元素,一支蜡烛ag,燃烧一段时间后,称得质量为bg,生成二氧化碳和水的总质量为cg,则a-b c( “<”或“>”或“=”),消耗氧气的质量为 ,生成的二氧化碳和水中氧元素的质量为 。
附: 板书设计
点评:本节课采用以问题教学为中心,实验探究的学习方式。教者有系统地对学生进行引导,既关注学生的学习过程,更注重学生的兴趣激发。学生积极参与,主动进行讨论和交流,师生间形成良性互动效应。采用现代化教学方法与手段,力求做到重点突出,难点突破,学生不仅得了知识和技能,同时也培养了认真扎实的科学态度和科学探索的学习方法,真正体现“知识与技能”、“过程与方法”、“情感态度与价值观”等目标融为一体的化学教学观。
质量守恒定律
提出问题一
讨论交流
实验探究
提出问题二
讨论交流
提出问题三
课题1 质量守恒定律
一、质量守恒定律:参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和。
二、质量守恒定律的理论解释
化学反应的实质:原子的重新组合
原子的种类不变
微观上 原子的数目不变
原子的质量不变
拓展延伸
大胆猜想
教师实验Ⅰ
理论依据
学生实验Ⅰ
提出问题四
学生实验Ⅱ
教师实验Ⅱ
PAGE
3
内容分析:本节课是义务教育课程标准实验教科书《化学》九年级(上册)第五单元课题一的内容。教材首先开门见山,提出“化学反应前后物质的质量有没有变化呢?”这一问题,让学生思考,并通过作出假设,实验探究,交流讨论,得出参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和这一规律。然后教材又给出碳酸钠与盐酸反应前后质量的测定、镁条燃烧前后质量的测定这两个实验方案,让学生比较前后质量变化情况,并讨论发生变化的原因,进而较全面地认识化学反应中的质量关系,在学生已对物质结构知识有了初步认识的基础上,引导学生从化学反应的微粒实质进行分析,加深对质量守恒定律的理解,并为学习化学方程式作好铺垫,也是对学生进行辨证唯物主义教育的重要内容。教材的这种处理方法,学生接受起来十分自然,无论是宏观事实,还是微观理论都具有很强的说服力。
设计思想:本节课以问题情境为教学主线,以科学探究作为教学的突破口,以实验探究为学习方式,力求将传统教学的“以知识的传授为本”转移到“以学生的发展为本”。
(一)设置问题、创设情境
问题一:化学变化是有新物质生成的变化,化学变化前后物质间的质量有怎样关系?
问题二:反应物的质量总和等于生成物的质量总和是否具有普遍性呢?
问题三:当遇到某些化学变化前后物质质量“不守恒”的假象时,我们该怎样去面对呢?
问题四:你能否从化学反应的微观实质来解释为什么一切化学反应都遵循质量守恒定律呢?
通过四个问题情境,层层推进,环环相扣,将本节课的内容有机的结合起来,同时激发学生的学习积极性。
(二)重视实验、体验探究
问题一提出后,引导学生进行猜想,教师演示实验Ⅰ(白磷燃烧前后质量的测定),让学生通过观察、分析而得出本实验的结论;围绕问题二将学生分成A、B、C三个小组开展学生实验Ⅰ[(A组)铁和硫酸铜溶液反应前后质量的测定,(B组)硫酸铜溶液与氢氧化钠溶液反应前后质量的测定,(C组)二氧化碳与澄清石灰水反应前后质量的测定],从而得出反应物的质量总和等于生成物的质量总和——形成质量守恒定律的概念;再围绕问题三通过学生实验Ⅱ(碳酸钠粉末与盐酸反应前后质量的测定)、教师演示实验Ⅱ(镁条在空气中燃烧反应前后质量的测定),让学生形成问题冲突,通过学生的讨论交流解决问题三,使学生进一步加深对质量守恒定律的理解。
(三)动画摸拟、突破难点
最后通过问题四,将研究的问题推向理论高度,让学生在观看模拟动画—水分子分解的基础上,通过师生共同讨论而总结出质量守恒定律的微观本质。
(四)拓展训练、总结提升
通过拓展训练加深对质量守恒定律的理解。课堂总结时,让学生交流本节课所学的知识及方法,让学生体会到这节课我们是从实验探究和理论研究两个方面得出了质量守恒定律,并知道定量研究是科学研究的一种重要方法。
[教学目标]
1.知识与技能
(1)通过对化学反应中反应物和生成物的质量的实验探究,让学生知道什么叫质量守恒定律,理解其涵义。
(2)进一步学的使用。
2.过程与方法
(1)通过实验探究,认识科学探究的意义和基本过程,认识定量研究在化学科学探究和发展中的重要地位和作用。
(2)初步学会运用观察、实验等方法获得信息,学会运用比较、分析、归纳、概括等方法获得正确的结论。
(3)初步培养学生的定量研究和分析推理能力。
3.情感态度与价值观
(1)增强探究兴趣,获得探究的乐趣。
(2)树立“物质不灭”的辩证统一观点。
(3)逐步养成善于合作、勤于思考、严谨求实、勇于创新和实践的科学精神。
[教学重点]
学生在实验探究基础上归纳出质量守恒定律及质量守恒定律的应用。
[教学难点]
运用化学反应的实质从微观角度解释和分析质量守恒定律。
[教学方法]
实验探究法、讨论法、多媒体辅助教学法
[教学准备]
1.实验准备:
教师演示Ⅰ(白磷燃烧前后质量的测定);
教师演示Ⅱ(镁条在空气中燃烧反应前后质量的测定)。
学生实验Ⅰ(A组)铁和硫酸铜溶液反应前后质量的测定;
(B组)硫酸铜溶液与氢氧化钠溶液反应前后质量的测定;
(C组)二氧化碳与澄清石灰水反应前后质量的测定。
学生实验Ⅱ: 碳酸钠粉末与盐酸反应前后质量的测定。
2. PPT多媒体课件
[教学过程]
1.引入课题
[创设问题情境]:我们知道化学变化时一定产生新物质,那么在化学变化前后物质间的质量有怎样关系呢?今天我们一起来探究这个问题。(板书:课题1质量守恒定律)。
2.探究活动1
[提出问题一]:化学变化前后,反应物的总质量和生成物的总质量存在着怎样的关系呢?
[学生猜想一]:反应物的总质量等于生成物的总质量。
[学生猜想二]:反应物的总质量大于生成物的总质量。
[学生猜想三]:反应物的总质量小于生成物的总质量。
[设问]:究竟哪一种猜想是正确的呢?暂且不作评判,让我们用实验事实来说话。
(1)教师演示Ⅰ(白磷燃烧前后质量的测定,装置如右图)。
(2)学生活动:填写实验报告,交流实验现象。
实验步骤 实验现象 实验结论
1.称量 所称质量M1= g 反应表达式_______________,反应物的总质量_______生成物的总质量。
2.用玻璃棒引燃 观察到
3.冷却后再次称量 所称质量M2= g
(3)师生活动:借助于PPT课件引导学生分析反应前后分别测得的是哪些物质的总质量?
(4)学生活动:总结交流得出结论(参加反应的白磷和氧气的质量总和等于反应后生成的五氧化二磷的质量)。
设计意图:让学生体验发现问题、提出问题、分析问题和解决问题的科学研究过程,培养学生严谨求实的科学态度。同时通过多媒体课件引导学生对反应前后物质的总质量进行分析,从而得出本实验的结论。
3.探究活动2
[提出问题二]:反应物的质量总和等于生成物的质量总和是否具有普遍性呢?
(1)学生实验Ⅰ(A组)铁和硫酸铜溶液反应前后质量的测定。
学生实验Ⅰ(B组)硫酸铜溶液与氢氧化钠溶液反应前后质量的测定
学生实验Ⅰ(C组)二氧化碳与澄清石灰水反应前后质量的测定。
A组实验 B组实验 C组实验
(2)学生活动(交流实验现象、实验结论)
(3)师生活动(建立质量守恒定律的概念)
(4)教师总结:参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和。这个规律就叫做质量守恒定律。(板书:一、质量守恒定律 1概念:)
(5)师生活动:(引导学生理解质量守恒定律的内涵)
(6)学生活动:(讨论)
①将3g镁在足量的氧气中完全燃烧,生成5g氧化镁,参加反应的氧气的质量为 g。
②加热2.45g氯酸钾和0.8g二氧化锰的混合物,完全反应后得氯化钾1.49g,同时生成氧气的质量为 g。
③“蜡烛燃烧时慢慢变短,最后什么都没有留下,这不符合质量守恒定律”。这种说法对吗?如何解释?
设计意图:本环节通过三组学生实验旨在让学生亲身体验科学探究过程,通过实验、分析、讨论、表达交流而得出化学变化中普遍遵循的规律——质量守恒定律,证实了自己的猜想,并体验成功的喜悦。通过三个思考题让学生初步学会利用质量守恒定律解决实际问题,以达到巩固概念的目的,同时思考题③又具有承上启下的作用。
4.探究活动3
[提出问题三]: 当遇到某些化学变化前后物质质量“不守恒”的假象时,我们该怎样去面对呢?
(1)学生实验Ⅱ(碳酸钠粉末与盐酸反应前后质量的测定)。
(2)教师实验Ⅱ(镁条在空气中燃烧反应前后质量的测定)。
(3)学生活动:思考、讨论、交流实验现象和结论。
①碳酸钠与盐酸反应质量前后,质量“不守恒”的原因是什么?
②镁条燃烧前后,“不守恒”的原因是什么?
③可采取什么措施使上述两种情况下的天平保持平衡?
④当我们遇到某些化学变化前后物质质量不守恒的假象时,我们该怎样去面对呢?
(4)师生总结:质量守恒定律是一切化学反应都遵循的普遍规律。
设计意图:让学生在实验中形成问题冲突,并通过学生的讨论交流,使学生进一步加深对质量守恒定律的理解,激发了学生的兴趣,开拓了学生的思维,培养了学生的科学探究能力以及开拓创新的精神。
5.探究活动4
[提出问题四]:你能否从化学反应的实质来解释为什么一切化学反应都遵循质量守恒定律呢?
(1)学生活动:(观看模拟动画—水分子的分解)
(2)学生活动:(运用分子、原子的知识解释质量守恒定律)
(3)教师活动:(板书:二、质量守恒定律的理论解释)
设计意图:问题四的提出将研究的问题推向理论高度,让学生在观看模拟动画—水分子分解的基础上,通过师生共同讨论而总结出质量守恒定律的微观本质。
6.课堂小结:
(1)说说质量守恒定律的运用。
(2)谈谈本节课所学到的方法
设计意图:旨在让学生学会归纳、学会总结、学会感悟,避免了传统教学中教师包办课堂小结的做法,培养了学生归纳知识的能力,增强了他们对学习方法的感悟。
7. 拓展延伸
(1)蔗糖受热分解生成碳和水,由此可知蔗糖中含有哪几种元素?
(2)假如蔗糖分解后所生成的碳原子和水分子的个数比为12∶11 ,则蔗糖分子中碳、氢、氧的原子个数比为多少?
(3)已知蜡烛中不含氧元素,一支蜡烛ag,燃烧一段时间后,称得质量为bg,生成二氧化碳和水的总质量为cg,则a-b c( “<”或“>”或“=”),消耗氧气的质量为 ,生成的二氧化碳和水中氧元素的质量为 。
附: 板书设计
点评:本节课采用以问题教学为中心,实验探究的学习方式。教者有系统地对学生进行引导,既关注学生的学习过程,更注重学生的兴趣激发。学生积极参与,主动进行讨论和交流,师生间形成良性互动效应。采用现代化教学方法与手段,力求做到重点突出,难点突破,学生不仅得了知识和技能,同时也培养了认真扎实的科学态度和科学探索的学习方法,真正体现“知识与技能”、“过程与方法”、“情感态度与价值观”等目标融为一体的化学教学观。
质量守恒定律
提出问题一
讨论交流
实验探究
提出问题二
讨论交流
提出问题三
课题1 质量守恒定律
一、质量守恒定律:参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和。
二、质量守恒定律的理论解释
化学反应的实质:原子的重新组合
原子的种类不变
微观上 原子的数目不变
原子的质量不变
拓展延伸
大胆猜想
教师实验Ⅰ
理论依据
学生实验Ⅰ
提出问题四
学生实验Ⅱ
教师实验Ⅱ
PAGE
3
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
