离子晶体授课课件
图片预览

文档简介
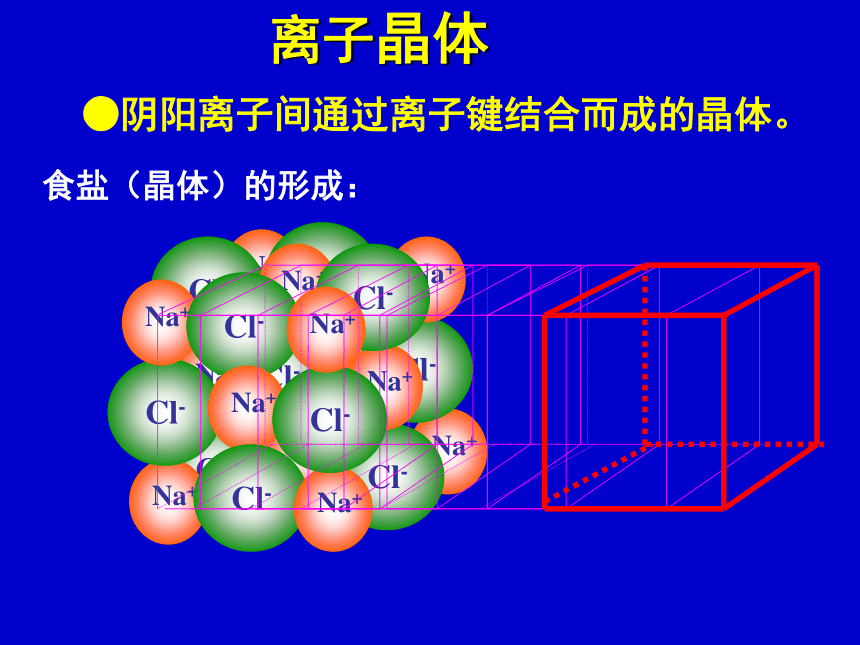
课件19张PPT。食盐(晶体)的形成:离子晶体●阴阳离子间通过离子键结合而成的晶体。
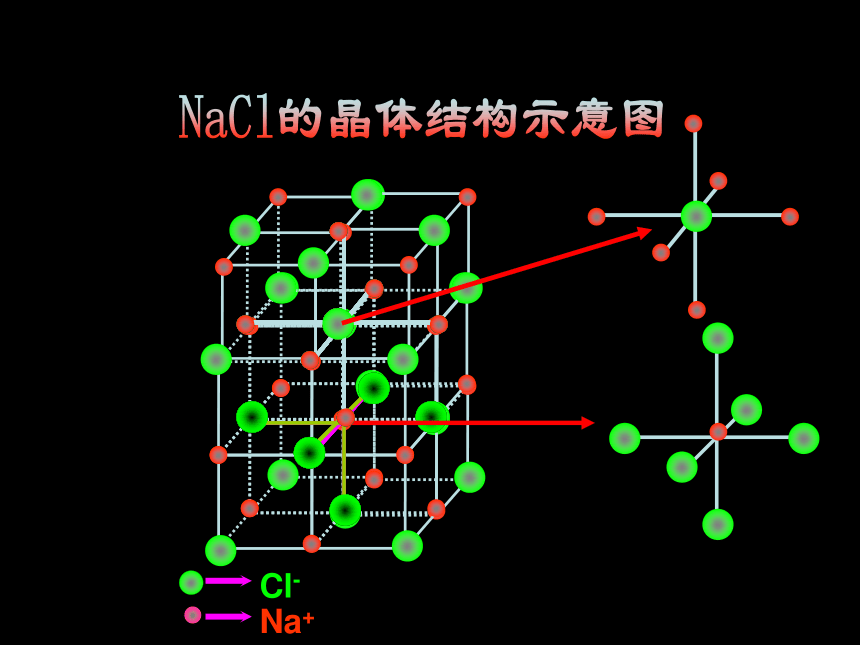
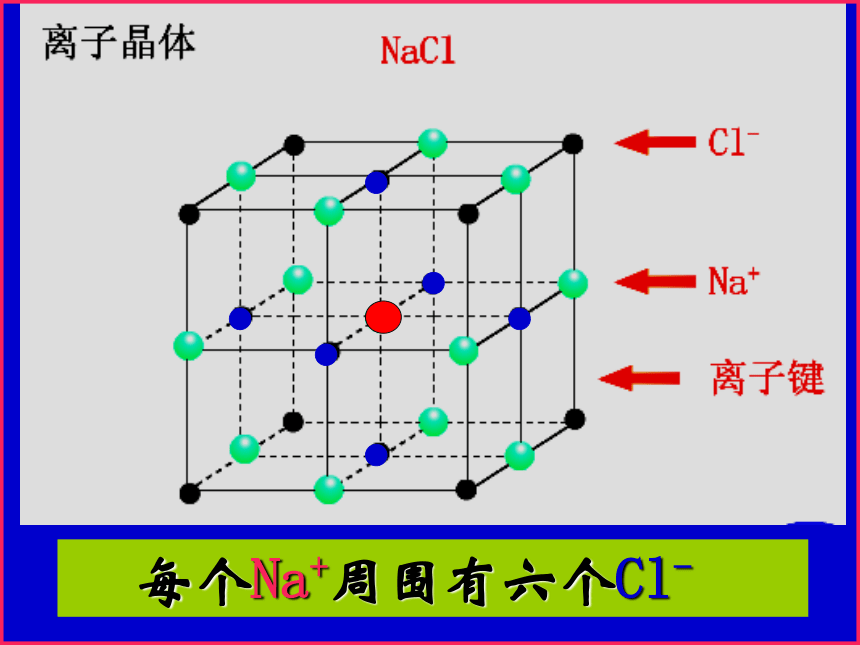
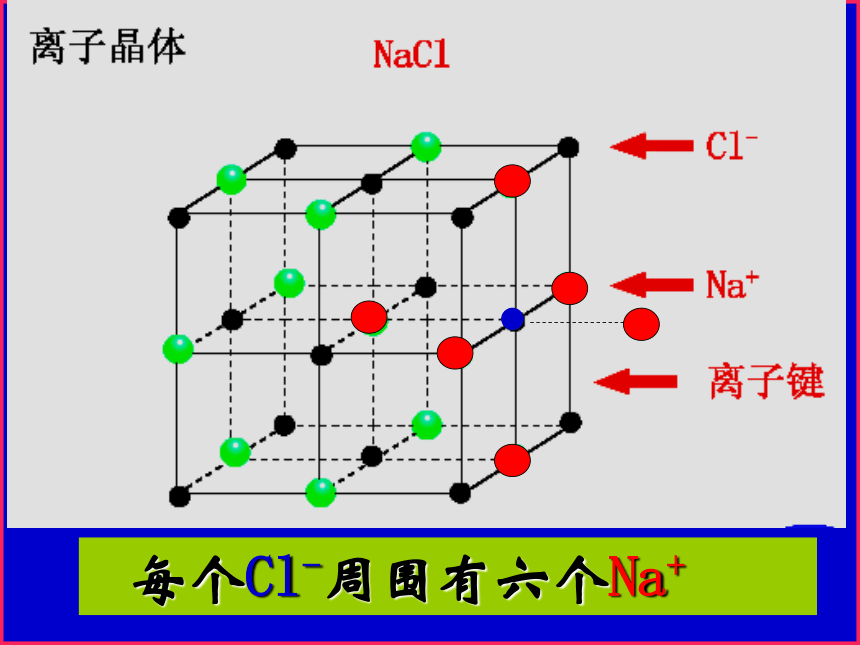
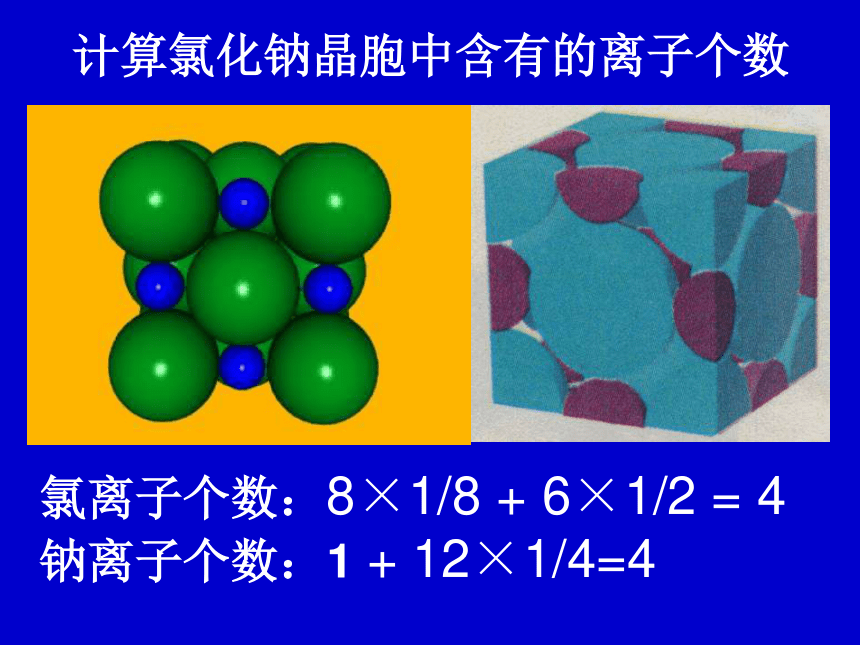
NaCl的晶体结构示意图 每个Na+周围有六个Cl- 每个Cl-周围有六个Na+计算氯化钠晶胞中含有的离子个数氯离子个数:8×1/8 + 6×1/2 = 4 钠离子个数:1 + 12×1/4=4 ——拥有4个氯离子,4个钠离子。Cl—:Na+ = 1 : 1氯化钠晶体的一个晶胞中,所以氯化钠化学式表示为: Na Cl
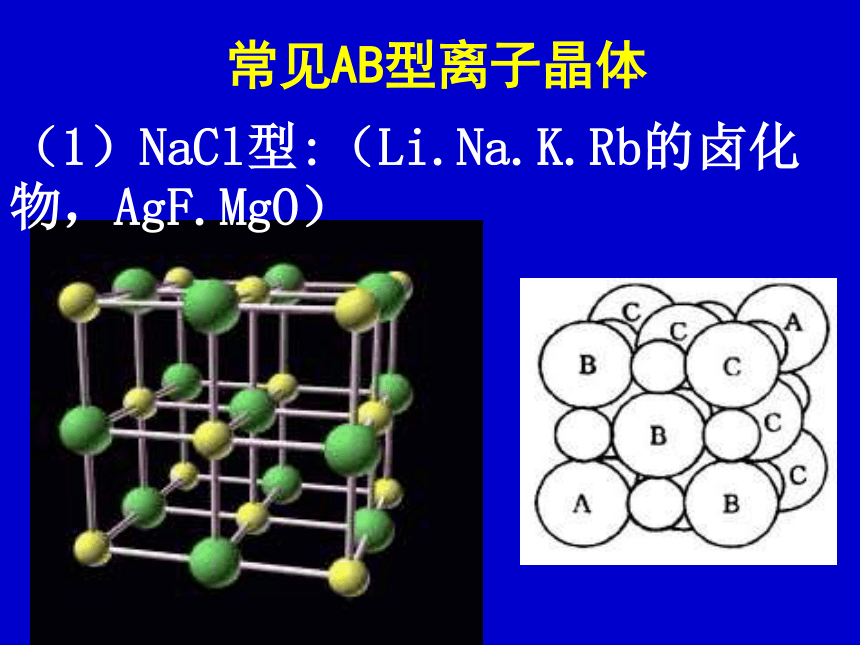
“Na Cl”只表示组成,不表示单独的分子(1)NaCl型:(Li.Na.K.Rb的卤化物,AgF.MgO)常见AB型离子晶体与Na+等距离且最近的Clˉ有:
(配位数)6个NaCl晶体中阴、阳离子配位数6个与Na+等距离且最近的Na+有:12个(2)CsCl型: (CsBr, CsI, NH4Cl) 1°铯离子和氯离子的位置:铯离子:体心
氯离子:顶点;或者反之。2°每个晶胞含铯离子、氯离子的个数:3°与铯离子等距离且最近的铯离子、氯离子各有几个?铯离子:6个;氯离子:8个
(配位数)1个科学探究:找出NaCl、CsCl两种离子晶体中阳离子和阴离子的配位数,它们是否相等?6688(3)立方ZnS型(BeO、BeS) 为什么NaCl的熔沸点比CsCl高?交流与讨论结论:
对于组成和结构相似的物质,阴阳离子半径越小,离子键越强,熔沸点较高,晶体越稳定。 离子键的强弱在一定程度上可以用离子晶体的晶格能来衡量。
指将1mol离子晶体里的阴阳离子完全气化而远离所需要吸收的能量。
单位:kJ/mol晶格能越大,表明离子晶体中的离子键越稳定晶格能:3、晶格能的大小的影响因素 仔细阅读课本P81表,分析晶格能的大小与离子晶体的熔点有什么关系?离子晶体的晶格能与哪些因素有关? 离子电荷越大 ,阴、阳离子半径越小 ,即阴、阳离子间的距离越小 ,则晶格能越大 。一般而言,晶格能越高,离子晶体的熔点越高、硬度越大。晶格能大小还影响着离子晶体在水中的溶解度、溶解热等性质。
◆离子晶体的特点?
●无单个分子存在。如NaCl 和CsCl不是表示分子式。
●一般易溶于水,难溶于非极性溶剂。
●熔沸点较高,硬度较大,难挥发难压缩。
●固态时不导电,水溶液或者熔融状态下均导电。
NaCl的晶体结构示意图 每个Na+周围有六个Cl- 每个Cl-周围有六个Na+计算氯化钠晶胞中含有的离子个数氯离子个数:8×1/8 + 6×1/2 = 4 钠离子个数:1 + 12×1/4=4 ——拥有4个氯离子,4个钠离子。Cl—:Na+ = 1 : 1氯化钠晶体的一个晶胞中,所以氯化钠化学式表示为: Na Cl
“Na Cl”只表示组成,不表示单独的分子(1)NaCl型:(Li.Na.K.Rb的卤化物,AgF.MgO)常见AB型离子晶体与Na+等距离且最近的Clˉ有:
(配位数)6个NaCl晶体中阴、阳离子配位数6个与Na+等距离且最近的Na+有:12个(2)CsCl型: (CsBr, CsI, NH4Cl) 1°铯离子和氯离子的位置:铯离子:体心
氯离子:顶点;或者反之。2°每个晶胞含铯离子、氯离子的个数:3°与铯离子等距离且最近的铯离子、氯离子各有几个?铯离子:6个;氯离子:8个
(配位数)1个科学探究:找出NaCl、CsCl两种离子晶体中阳离子和阴离子的配位数,它们是否相等?6688(3)立方ZnS型(BeO、BeS) 为什么NaCl的熔沸点比CsCl高?交流与讨论结论:
对于组成和结构相似的物质,阴阳离子半径越小,离子键越强,熔沸点较高,晶体越稳定。 离子键的强弱在一定程度上可以用离子晶体的晶格能来衡量。
指将1mol离子晶体里的阴阳离子完全气化而远离所需要吸收的能量。
单位:kJ/mol晶格能越大,表明离子晶体中的离子键越稳定晶格能:3、晶格能的大小的影响因素 仔细阅读课本P81表,分析晶格能的大小与离子晶体的熔点有什么关系?离子晶体的晶格能与哪些因素有关? 离子电荷越大 ,阴、阳离子半径越小 ,即阴、阳离子间的距离越小 ,则晶格能越大 。一般而言,晶格能越高,离子晶体的熔点越高、硬度越大。晶格能大小还影响着离子晶体在水中的溶解度、溶解热等性质。
◆离子晶体的特点?
●无单个分子存在。如NaCl 和CsCl不是表示分子式。
●一般易溶于水,难溶于非极性溶剂。
●熔沸点较高,硬度较大,难挥发难压缩。
●固态时不导电,水溶液或者熔融状态下均导电。
