离子反应及其发生的条件
图片预览






文档简介
课件19张PPT。第二章 化学物质及其变化第二节离子反应第二课时 离子反应及其发生的条件07级化学一班 郭巧乔0709040 三国时期,诸葛亮在七擒孟获的过程中,蜀军由于误饮哑泉水、个个不能言语,生命危在旦夕,巧遇老叟,指点迷津——饮用万安溪安乐泉水、终于转危为安,渡过难关,哑泉水为何能致哑,万安溪安乐泉水又是什么灵丹妙药?
“哑泉致哑”、“安乐泉解毒” 原来哑泉水中含有较多的硫酸铜,人喝了含铜盐较多的水就会中毒,致哑、呕吐、腹泻、最后虚脱、痉挛致死。而万安溪安乐泉水中含有较多的碱(一般味苦),在人体误食硫酸铜后大量饮用此泉水,其中的碱不仅中和胃酸,然后又会在肠胃中与硫酸铜发生离子反应:
Cu2 + + 2OH ― = Cu(OH)2↓
致使原来会被人体吸收的可溶性铜盐变成不溶性的Cu(OH)2沉淀而被排出,因此有解毒作用。
实验现象总结归纳 CuSO4溶液与稀NaCl溶液混合观察不到现象,是因为CuSO4电离出来的Cu2+、SO42―与NaCl电离出来的Na+、Cl―的混合没有发生化学反应。
CuSO4溶液与BaCl2溶液则发生了化学反应,生成了BaSO4白色沉淀,反应的方程式如下:
CuSO4+ BaCl2=CuCl2+BaSO4↓。 一、离子方程式实验2-1 我们发现这两种物质在溶液中发生了电离,并且可以写成如下的方程式:
BaCl2= Ba2++2 Cl―
CuSO4= Cu2++ SO42―
Cu2+和Cl―之间没有化学反应,Ba2+与SO42―则发生了化学反应生成了白色的BaSO4沉淀。此时我们得出了这两个溶液反应的实质是
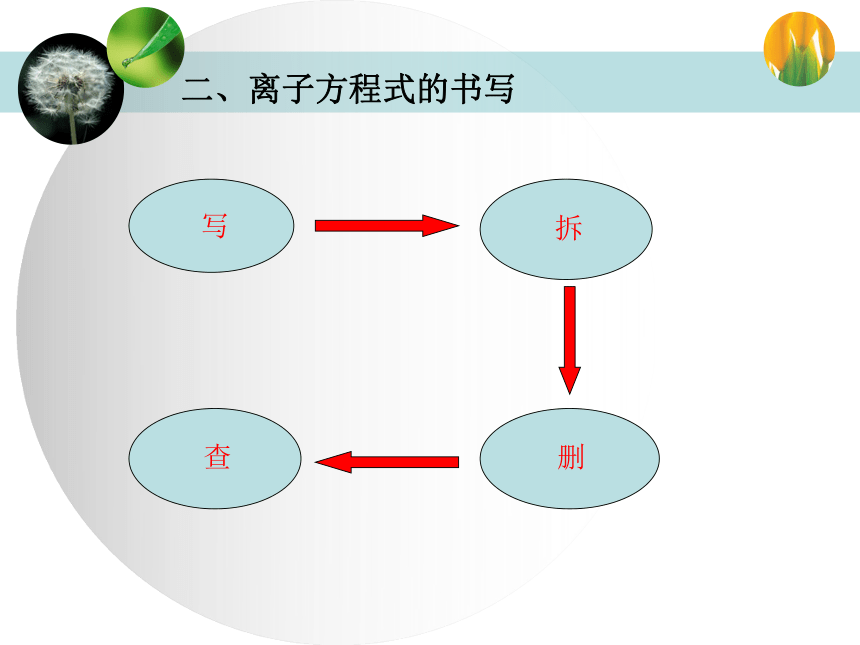
Ba2++ SO42―= BaSO4↓。本实验反应实质由以上的实验,我们可以得出离子方程式的概念概念:用实际参加反应的离子符号来表示反应的式子叫离子方程式。 二、离子方程式的书写1、写:写出反应的化学方程式
2、拆:把易电离的物质写成离子形式,把难溶的物质、气体和水仍用化学式表示
3、删:删去方程式两边相同的离子
4、查:检查离子方程式两边各元素的原子个数和电子数是否相等 以刚刚实验中的反应为例CuSO4+ BaCl2=CuCl2+ BaSO4↓Cu2++ SO42―+ Ba2++2 Cl―= Cu2++2 Cl―+ BaSO4↓得到Ba2++ SO42―= BaSO4↓“拆”中间需要注意的问题:可以拆为离子形式的物质:需要保留化学式的物质: 钾钠盐全都溶,铵盐、硝酸也相同; 硫酸钡铅要除外,氯化亚汞、银不溶; 亚硫酸盐磷酸盐,钠钾铵外均不溶; 碳酸盐硅酸盐,完全都与上相类。 硫化钾钠钡镁溶,硫化钙微溶余不溶。盐溶解性记忆技巧 注意:1.凡非溶液中进行的反应一般不能写成离子方程式。2.对于微溶物:(1)在生成物中有微溶物析出时,微溶物用化学式表示。(2)当反应物里有微溶物处于溶液状态(稀溶液),写成离子符号。(3)当反应物里有微溶物处于悬浊液或固态时,应写成化学式。3.凡有气体生成的需加↑ ,有才沉淀生成的需加↓。练习1.?硝酸和氢氧化钠溶液的反应
2.?氯化钡溶液与硫酸钠溶液反应
3.?碳酸钠溶液与澄清石灰水反应
4. BaCO3与盐酸的反应 解答:1.H++OH―=H2O
2. Ba2++ SO42―= BaSO4↓
3. Ca2+ +CO32― =CaCO3 ↓
4. CO32― +2H+ = H2O+CO2 ↑ 请同学们将下列化学方程式改写成离子方程式 1.NaOH +HCl =NaCI+H2O
2.KOH+HCI=KCI+H2O
3.2NaOH+H2SO4=Na2SO4+2H2O
4.2KOH+H2SO4=K2SO4+2H2O1.H++OH―=H2O
2.H++OH―=H2O
3.H++OH―=H2O
4.H++OH―=H2O三、离子方程式的意义上述四个化学方程式的离子反应式均相同。
并且根据实验2-2,
表明:酸与碱发生中和反应的实质是有酸电离出来的与由碱电离出来的结合生成了。
离子方程式不仅可以表示某一个具体的化学反应,而且还可以表示同一类型的离子反应 四、离子反应发生的条件同一溶液中若离子间符合下列任意一个条件就会发生离子反应,离子之间便不能在溶液中大量共存。这也就是离子反应发生的条件。1.生成沉淀或难溶物(微溶物)2.生成气体或挥发性物质Ba2+与SO42―,Ag +与Br ―NH4 + 与OH―,H +与 CO32―(实验2-3) H + 与Ac ―生成弱酸氧化性离子(如Fe3 + 、NO3―、ClO ― 、MnO4 ―等)与还原性离子(如S2―、I ― 、Fe2 + 、SO32 ―等)不能大量共存。3.生成难电离物质4.发生氧化还原反应解题时需注意:⑴溶液无色透明时,则溶液中一定没有色离子。有色离子: MnO4-(紫红色)、Fe3+(黄色)、
Fe2 +(浅绿色)、Cu2+(蓝色) ⑵强碱性溶液中肯定不存在与OH -反应的离子。⑶强酸性溶液中肯定不存在与H +反应的离子。练习1、下列离子在水溶液中,能大量共存的是( )
A、Na + 、 K + 、 CO32-、H +
B、Fe3+、K + 、 Cl-、 OH-
C、K + 、NH4 + 、 H + 、SO42-
D、 Ba2 + 、Cu2+ 、NO3- 、SO42-
2、下列离子在水溶液中,无色且能大量共存的是( )
A. Fe3+ 、K + 、NO3- 、Cl-
B. Ba2+ 、K + 、Cl- 、OH-
C. H + 、Mg2+ 、HCO3- 、SO42-
D. Na + 、K + 、MnO4- 、NO3-
CB 五、离子反应在生活中的应用 离子反应在生活中有很多的应用,比如中学阶段主要应用在离子的分离和检验,离子反应在工农业生产、科研、日常生活中普遍存在,如:分离分析,水的净化,电镀,医药,染料,“三废”处理和生命活动等。 作业P32,No.6、7 谢谢!
“哑泉致哑”、“安乐泉解毒” 原来哑泉水中含有较多的硫酸铜,人喝了含铜盐较多的水就会中毒,致哑、呕吐、腹泻、最后虚脱、痉挛致死。而万安溪安乐泉水中含有较多的碱(一般味苦),在人体误食硫酸铜后大量饮用此泉水,其中的碱不仅中和胃酸,然后又会在肠胃中与硫酸铜发生离子反应:
Cu2 + + 2OH ― = Cu(OH)2↓
致使原来会被人体吸收的可溶性铜盐变成不溶性的Cu(OH)2沉淀而被排出,因此有解毒作用。
实验现象总结归纳 CuSO4溶液与稀NaCl溶液混合观察不到现象,是因为CuSO4电离出来的Cu2+、SO42―与NaCl电离出来的Na+、Cl―的混合没有发生化学反应。
CuSO4溶液与BaCl2溶液则发生了化学反应,生成了BaSO4白色沉淀,反应的方程式如下:
CuSO4+ BaCl2=CuCl2+BaSO4↓。 一、离子方程式实验2-1 我们发现这两种物质在溶液中发生了电离,并且可以写成如下的方程式:
BaCl2= Ba2++2 Cl―
CuSO4= Cu2++ SO42―
Cu2+和Cl―之间没有化学反应,Ba2+与SO42―则发生了化学反应生成了白色的BaSO4沉淀。此时我们得出了这两个溶液反应的实质是
Ba2++ SO42―= BaSO4↓。本实验反应实质由以上的实验,我们可以得出离子方程式的概念概念:用实际参加反应的离子符号来表示反应的式子叫离子方程式。 二、离子方程式的书写1、写:写出反应的化学方程式
2、拆:把易电离的物质写成离子形式,把难溶的物质、气体和水仍用化学式表示
3、删:删去方程式两边相同的离子
4、查:检查离子方程式两边各元素的原子个数和电子数是否相等 以刚刚实验中的反应为例CuSO4+ BaCl2=CuCl2+ BaSO4↓Cu2++ SO42―+ Ba2++2 Cl―= Cu2++2 Cl―+ BaSO4↓得到Ba2++ SO42―= BaSO4↓“拆”中间需要注意的问题:可以拆为离子形式的物质:需要保留化学式的物质: 钾钠盐全都溶,铵盐、硝酸也相同; 硫酸钡铅要除外,氯化亚汞、银不溶; 亚硫酸盐磷酸盐,钠钾铵外均不溶; 碳酸盐硅酸盐,完全都与上相类。 硫化钾钠钡镁溶,硫化钙微溶余不溶。盐溶解性记忆技巧 注意:1.凡非溶液中进行的反应一般不能写成离子方程式。2.对于微溶物:(1)在生成物中有微溶物析出时,微溶物用化学式表示。(2)当反应物里有微溶物处于溶液状态(稀溶液),写成离子符号。(3)当反应物里有微溶物处于悬浊液或固态时,应写成化学式。3.凡有气体生成的需加↑ ,有才沉淀生成的需加↓。练习1.?硝酸和氢氧化钠溶液的反应
2.?氯化钡溶液与硫酸钠溶液反应
3.?碳酸钠溶液与澄清石灰水反应
4. BaCO3与盐酸的反应 解答:1.H++OH―=H2O
2. Ba2++ SO42―= BaSO4↓
3. Ca2+ +CO32― =CaCO3 ↓
4. CO32― +2H+ = H2O+CO2 ↑ 请同学们将下列化学方程式改写成离子方程式 1.NaOH +HCl =NaCI+H2O
2.KOH+HCI=KCI+H2O
3.2NaOH+H2SO4=Na2SO4+2H2O
4.2KOH+H2SO4=K2SO4+2H2O1.H++OH―=H2O
2.H++OH―=H2O
3.H++OH―=H2O
4.H++OH―=H2O三、离子方程式的意义上述四个化学方程式的离子反应式均相同。
并且根据实验2-2,
表明:酸与碱发生中和反应的实质是有酸电离出来的与由碱电离出来的结合生成了。
离子方程式不仅可以表示某一个具体的化学反应,而且还可以表示同一类型的离子反应 四、离子反应发生的条件同一溶液中若离子间符合下列任意一个条件就会发生离子反应,离子之间便不能在溶液中大量共存。这也就是离子反应发生的条件。1.生成沉淀或难溶物(微溶物)2.生成气体或挥发性物质Ba2+与SO42―,Ag +与Br ―NH4 + 与OH―,H +与 CO32―(实验2-3) H + 与Ac ―生成弱酸氧化性离子(如Fe3 + 、NO3―、ClO ― 、MnO4 ―等)与还原性离子(如S2―、I ― 、Fe2 + 、SO32 ―等)不能大量共存。3.生成难电离物质4.发生氧化还原反应解题时需注意:⑴溶液无色透明时,则溶液中一定没有色离子。有色离子: MnO4-(紫红色)、Fe3+(黄色)、
Fe2 +(浅绿色)、Cu2+(蓝色) ⑵强碱性溶液中肯定不存在与OH -反应的离子。⑶强酸性溶液中肯定不存在与H +反应的离子。练习1、下列离子在水溶液中,能大量共存的是( )
A、Na + 、 K + 、 CO32-、H +
B、Fe3+、K + 、 Cl-、 OH-
C、K + 、NH4 + 、 H + 、SO42-
D、 Ba2 + 、Cu2+ 、NO3- 、SO42-
2、下列离子在水溶液中,无色且能大量共存的是( )
A. Fe3+ 、K + 、NO3- 、Cl-
B. Ba2+ 、K + 、Cl- 、OH-
C. H + 、Mg2+ 、HCO3- 、SO42-
D. Na + 、K + 、MnO4- 、NO3-
CB 五、离子反应在生活中的应用 离子反应在生活中有很多的应用,比如中学阶段主要应用在离子的分离和检验,离子反应在工农业生产、科研、日常生活中普遍存在,如:分离分析,水的净化,电镀,医药,染料,“三废”处理和生命活动等。 作业P32,No.6、7 谢谢!
