杂化轨道讲解课件
图片预览



文档简介
课件15张PPT。分析思考:
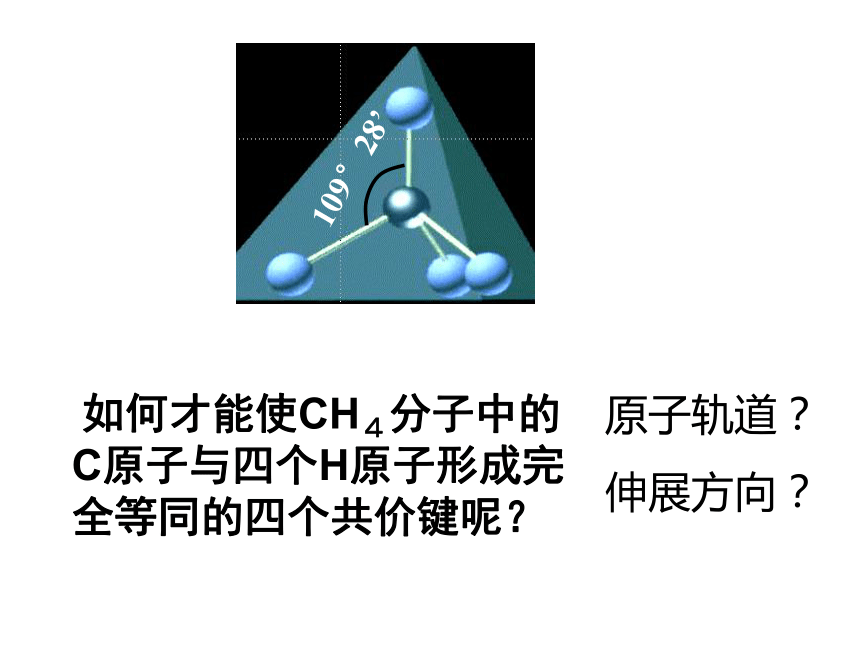
1、写出C原子电子排布的轨道表示式,并由此推测:CH4分子的C原子有没有可能形成四个共价键?怎样才能形成四个共价键?2、如果C原子就以1个2S轨道和3个2P轨道上的单电子,分别与四个H原子的1S轨道上的单电子重叠成键,所形成的四个共价键能否完全相同?这与CH4分子的实际情况是否吻合? 如何才能使CH4分子中的C原子与四个H原子形成完全等同的四个共价键呢?原子轨道?
伸展方向?二、杂化轨道理论
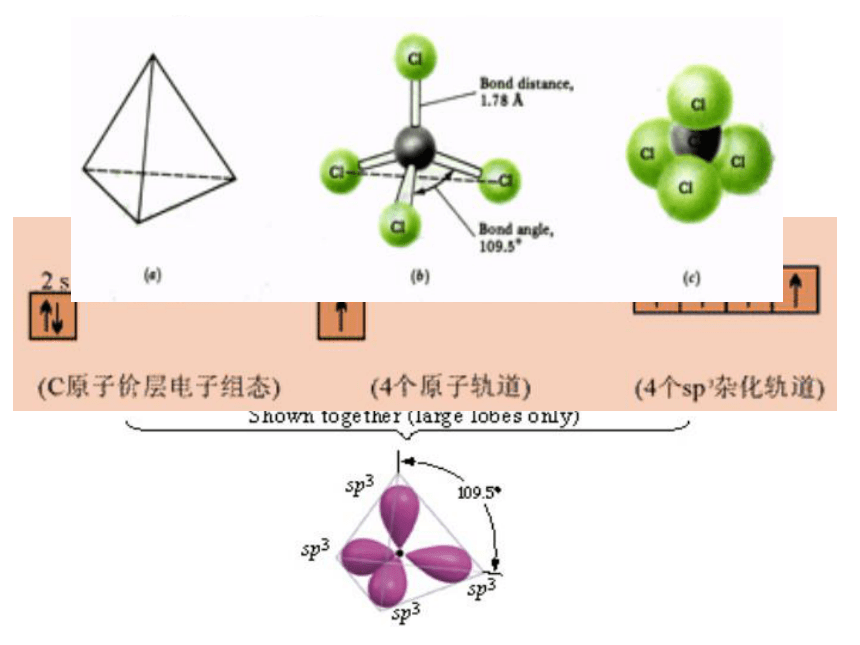
—解释分子的立体构型1、杂化轨道的概念
在形成多原子分子的过程中,中心原子的若干能量相近的原子轨道间通过相互的混杂后,形成相同数量的几个能量与形状都相同的新轨道。※杂化轨道只用于形成σ键或者用来容纳孤对电子
剩余的p轨道可以形成π键基本要点:
在形成分子时,由于原子的相互影响,某个原子的若干个不同类型、能量相近的原子轨道重新组合成若干个新轨道。这种轨道重新组合的过程称为杂化,所形成的新轨道称为杂化轨道。
杂化前后轨道数目不变。
杂化后轨道伸展方向,形状发生改变。 <杂化轨道理论>
杂化是发生在分子形成时,孤立原子不发生;只有能量相近的原子轨道才发生杂化。
能量和成分不同的杂化轨道称为不等性杂化轨道,不等性杂化轨道间的夹角与等性杂化轨道不同。
杂化轨道成键时,要满足原子轨道最大重叠。杂化轨道成键能力
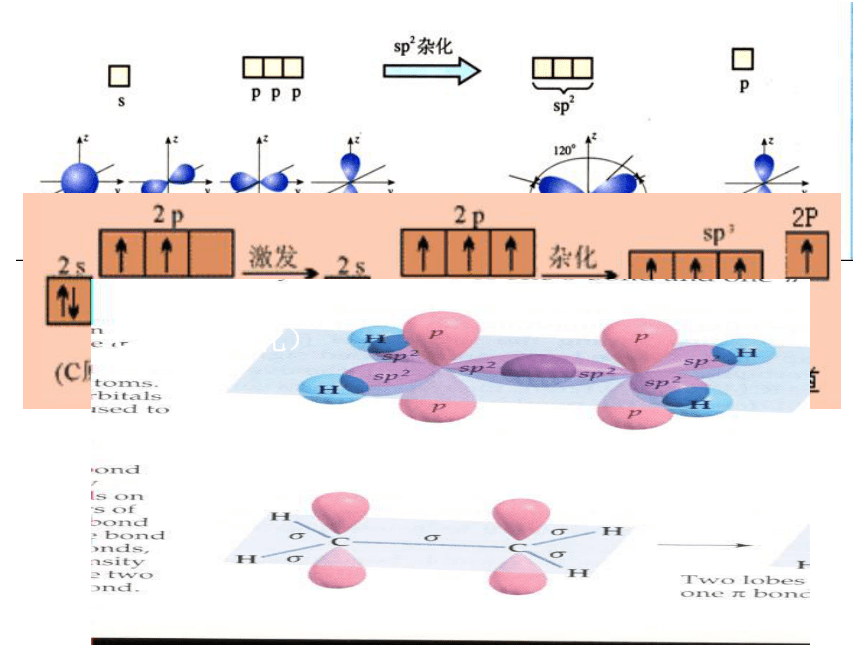
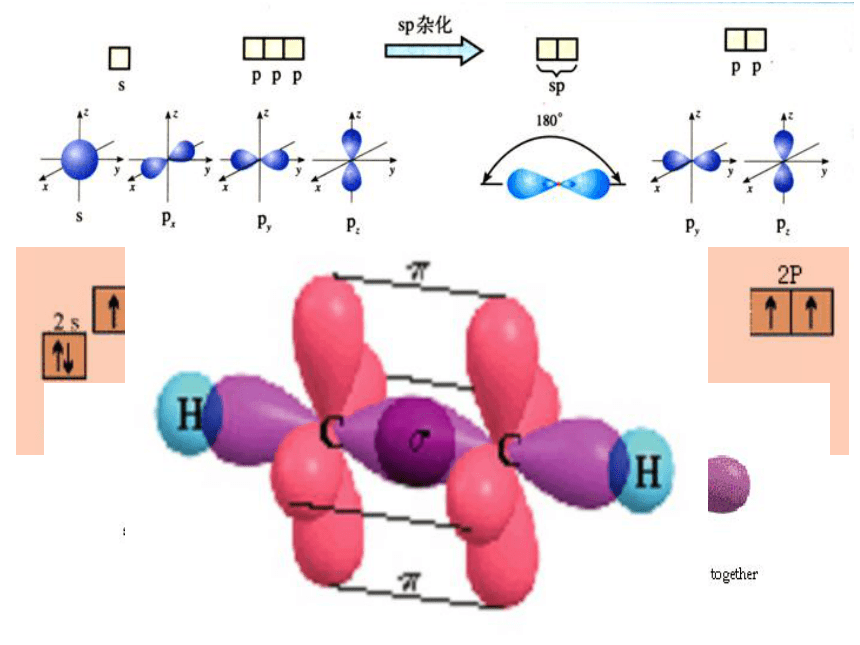
sp < sp2 < sp3 < dsp2 < sp3d < sp3d2<杂化轨道理论>2、杂化轨道的类型小结:杂化轨道的类型与分子的空间构型 中心原子直线形 三角形 四面体 三角锥 V型 杂化轨道类型SP SP2 SP3 不等性 SP3参加杂化的轨道杂化轨道数成键轨道夹角分子空间构型实例a )中心原子价层电子总数等于中心A的价电子数加上配体 B 在成键过程中提供的电子数 。
如 CCl 4 4 + 1 ? 4 = 8 ★杂化轨道数=中心原子总价电子数÷2
(不包括π键) b)氧族元素的原子做中心时,价电子数为 6 。如 H2O 或 H2S 。做配体时,提供电子数为 0 。如 CO2 c)处理离子时,要加减与离子价数相当的电子,如
PO4 3- :5+0 ? 4+3=8 , NH4+ : 5+1 ? 4 -1= 8 。 3、中心原子杂化方式的判断(4+0)÷2=2(4+2+0)÷2=3(4+4)÷2=4(6+0)÷2=3(5+3)÷2=4(6+2)÷2=4SPSP2SP3SP2SP3SP3直线形平面三角形正四面体形V形三角锥形V形0+2=20+3=30+4=41+2=31+3=42+2=4SPSP2SP3SP2SP3SP3直线形平面三角形正四面体形V形三角锥形V形 练习:
用杂化轨道理论分析下列物质的杂化类型、成键情况和分子的空间构型。
(1)CO2
(2)H2O
(3)HCHO
(4)HCN
(5)SO3
1、写出C原子电子排布的轨道表示式,并由此推测:CH4分子的C原子有没有可能形成四个共价键?怎样才能形成四个共价键?2、如果C原子就以1个2S轨道和3个2P轨道上的单电子,分别与四个H原子的1S轨道上的单电子重叠成键,所形成的四个共价键能否完全相同?这与CH4分子的实际情况是否吻合? 如何才能使CH4分子中的C原子与四个H原子形成完全等同的四个共价键呢?原子轨道?
伸展方向?二、杂化轨道理论
—解释分子的立体构型1、杂化轨道的概念
在形成多原子分子的过程中,中心原子的若干能量相近的原子轨道间通过相互的混杂后,形成相同数量的几个能量与形状都相同的新轨道。※杂化轨道只用于形成σ键或者用来容纳孤对电子
剩余的p轨道可以形成π键基本要点:
在形成分子时,由于原子的相互影响,某个原子的若干个不同类型、能量相近的原子轨道重新组合成若干个新轨道。这种轨道重新组合的过程称为杂化,所形成的新轨道称为杂化轨道。
杂化前后轨道数目不变。
杂化后轨道伸展方向,形状发生改变。 <杂化轨道理论>
杂化是发生在分子形成时,孤立原子不发生;只有能量相近的原子轨道才发生杂化。
能量和成分不同的杂化轨道称为不等性杂化轨道,不等性杂化轨道间的夹角与等性杂化轨道不同。
杂化轨道成键时,要满足原子轨道最大重叠。杂化轨道成键能力
sp < sp2 < sp3 < dsp2 < sp3d < sp3d2<杂化轨道理论>2、杂化轨道的类型小结:杂化轨道的类型与分子的空间构型 中心原子直线形 三角形 四面体 三角锥 V型 杂化轨道类型SP SP2 SP3 不等性 SP3参加杂化的轨道杂化轨道数成键轨道夹角分子空间构型实例a )中心原子价层电子总数等于中心A的价电子数加上配体 B 在成键过程中提供的电子数 。
如 CCl 4 4 + 1 ? 4 = 8 ★杂化轨道数=中心原子总价电子数÷2
(不包括π键) b)氧族元素的原子做中心时,价电子数为 6 。如 H2O 或 H2S 。做配体时,提供电子数为 0 。如 CO2 c)处理离子时,要加减与离子价数相当的电子,如
PO4 3- :5+0 ? 4+3=8 , NH4+ : 5+1 ? 4 -1= 8 。 3、中心原子杂化方式的判断(4+0)÷2=2(4+2+0)÷2=3(4+4)÷2=4(6+0)÷2=3(5+3)÷2=4(6+2)÷2=4SPSP2SP3SP2SP3SP3直线形平面三角形正四面体形V形三角锥形V形0+2=20+3=30+4=41+2=31+3=42+2=4SPSP2SP3SP2SP3SP3直线形平面三角形正四面体形V形三角锥形V形 练习:
用杂化轨道理论分析下列物质的杂化类型、成键情况和分子的空间构型。
(1)CO2
(2)H2O
(3)HCHO
(4)HCN
(5)SO3
