分子的性质
图片预览











文档简介
课件44张PPT。分子的性质一、键的极性和分子的极性(1)离子键、共价键?
(2)极性键与非极性键
(3)何谓电负性?
(4)分别以H2、HCl为例,探究电负性对共价键极性有何影响?1、极性键与非极性键练习与巩固指出下列物质中化学键的类型
F2 HF NaOH N2
Na2O2 H2O2 CH3COOH练习与巩固1.含有非极性键的离子化合物是?? (???? )
A.?NaOH B?.Na2O2?
C.NaCl D?.NH4Cl
2.下列元素间形成的共价键中,极性最强的是? (???? )
A.F―F B.H―F
C.H―Cl D.H―O一、键的极性和分子的极性2、极性分子与非极性分子极性分子:正电中心和负电中心不重合非极性分子:正电中心和负电中心重合正电中心和负电中心是否重合 化学键的极性的向量和是否等于零(定量) 看键的极性,也看分子的空间构型 判断方法:(本质)2、极性分子与非极性分子思考与交流总结键的极性与分子极性的关系 A、都是由非极性键构成的分子一般是非极 性分子。
B、极性键结合形成的双原子分子一定为极 性分子。
C、极性键结合形成的多原子分子,可能为 非极性分子,也可能为极性分子。
D、多原子分子的极性,应有键的极性和分子的空间构型共同来决定。
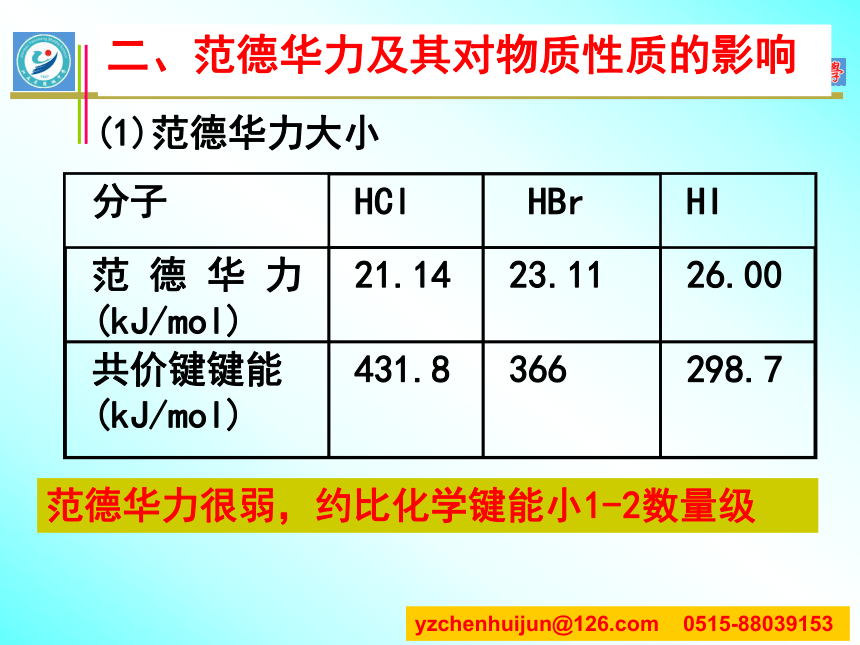
一、键的极性和分子的极性科学视野表面活性剂和细胞膜二、范德华力及其对物质性质的影响气体在加压或降温是为什么会变为液体、固体?(1)范德华力大小?
范德华力很弱,约比化学键能小1-2数量级二、范德华力及其对物质性质的影响?
(2) 范德华力与相对分子质量的关系结构相似,相对分子质量越大,范德华力越大二、范德华力及其对物质性质的影响(3)范德华力与分子的极性的关系相对分子质量相同或相近时,分子的极性越大,范德华力越大二、范德华力及其对物质性质的影响(4)范德华力对物质熔沸点的影响二、范德华力及其对物质性质的影响二、范德华力及其对物质性质的影响科学视野壁虎与范德华力已经与电负性很强的原子形成共价键的氢原子与另一个分子中电负性很强的原子之间的作用力。三、氢键及其对物质性质的影响氢键的概念:氢键的表示:三、氢键及其对物质性质的影响氢键的本质:是一种静电作用,是除范德华力外的另一种分子间作用力,氢键的大小,介于化学键与范德华力之间,不属于化学键。但也有键长、键能。三、氢键及其对物质性质的影响氢键的种类:分子间氢键
分子内氢键三、氢键及其对物质性质的影响氢键的种类:三、氢键及其对物质性质的影响氢键对物质熔沸点影响:分子间氢键使物质熔沸点升高
分子内氢键使物质熔沸点降低极性溶剂里,溶质分子与溶剂分子间的氢键使溶质溶解度增大,而当溶质分子形成分子间氢键使使溶质溶解度减小。 氢键对物质溶解度的影响:比较熔沸点:
HF HCl
H2O H2S
邻羟基苯甲醛、对羟基苯甲醛课堂讨论应用与拓展为什么NH3极易溶于水?
冰的硬度比一般固体共价化合物大,为什么?
课后习题5?三、氢键及其对物质性质的影响资料卡片某些氢键的键长和键能科学视野生物大分子中的氢键四、溶解性(1)内因:相似相溶原理
(2)外因:影响固体溶解度的主要因素是温度;影响气体溶解度的主要因素是温度和压强。
(3)其他因素:
A)如果溶质与溶剂之间能形成氢键,则溶解度增大,且氢键越强,溶解性越好。如:NH3。
B)溶质与水发生反应时可增大其溶解度,如:SO2。思考与交流PtCl2(NH3)2可以形成两种固体,一种为淡黄色,在水中的溶解度小,另一种为黄绿色,在水中的溶解度较大,请回答下列问题:
⑴PtCl2(NH3)2是平面正方形结构,还是四面体结构
⑵请在以下空格内画出这两种固体分子的几何构型图,
淡黄色固体: ,黄绿色固体: 。
⑶淡黄色固体物质是由 分子组成,黄绿色固体物质是由 分子组成(填“极性分子”或“非极性分子”)
⑷黄绿色固体在水中溶解度比淡黄色固体大,原因是 。五、手性观察一下两组图片,有何特征? 一对分子,组成和原子的排列方式完全相同,但如同左手和右手一样互为镜像,在三维空间无论如何旋转不能重叠,这对分子互称手性异构体。有手性异构体的分子称为手性分子。中心原子称为手性原子。乳酸分子CH3CH(OH)COOH有以下两种异构体: ??? 五、手性具有手性的有机物,是因为含有手性碳原子造成的。
如果一个碳原子所联结的四个原子或原子团各不相同,那么该碳原子称为手性碳原子,记作﹡C 。五、手性注意:也有一些手性物质没有手性碳原子(2)有机物X的结构简式为
若使X通过化学变化,失去光学活性,可能发生的反应类型有________.
A.酯化 B.水解 C.氧化
D.还原 E.消去 F.缩聚下列两分子的关系是 ( )A.互为同分异构体 B.是同一物质
C.是手性分子 D.互为同系物右旋与左旋自然界中的手性珍贵的法螺左旋贝。百万分之一,十分罕见。自然界中的手性手性的应用手性合成
手性催化科学史话巴斯德与手性六、无机含氧酸分子的酸性指出下列无机含氧酸的酸性HClO4 HClO3
H2SO4 HNO3
H3PO4 H2SO3
H3BO3 HNO2六、无机含氧酸分子的酸性把含氧酸的化学式写成(HO)m ROn,
就能根据n值判断常见含氧酸的强弱。
n=0,极弱酸,如硼酸(H3BO3)。
n=1,弱酸,如亚硫酸(H2SO3)。
n=2,强酸,如硫酸(H2SO4)、硝酸(HNO3)。
n=3,极强酸,如高氯酸(HClO4)。 含氧酸的强度取决于中心原子的电负性、原子半径、氧化数。
当中心原子的电负性大、原子半径小、氧化数高时,使O-H键减弱,酸性增强。六、无机含氧酸分子的酸性H2SiO4 H3PO4 H2SO4 HClO4 HClO HClO3 HClO4HClO HBrO HIO练习:比较下列含氧酸酸性的强弱六、无机含氧酸分子的酸性 同周期的含氧酸,自左至右,随中心原子原子序数增大 ,酸性增强。 同一族的含氧酸,自上而下,随中心原子原子序数增大 ,酸性减弱。 同一元素不同价态的含氧酸酸性高价强于低价 。无机含氧酸强度的变化规律某些含氧酸可表示为:(HO)mROn,它的强度与酸中的非羟基氧原子数n有关;n越大,酸性越强:n=0 →弱酸;n=1→中强酸;n=2→强酸;n=3 →超强酸。
已知:硼酸(H3BO3)是弱酸,而亚磷酸(H3PO3)是中强酸
(1) 写出这两种酸的结构式: 、 。
(2)写出亚磷酸和过量的NaOH溶液反应的化学方程式:
(2)极性键与非极性键
(3)何谓电负性?
(4)分别以H2、HCl为例,探究电负性对共价键极性有何影响?1、极性键与非极性键练习与巩固指出下列物质中化学键的类型
F2 HF NaOH N2
Na2O2 H2O2 CH3COOH练习与巩固1.含有非极性键的离子化合物是?? (???? )
A.?NaOH B?.Na2O2?
C.NaCl D?.NH4Cl
2.下列元素间形成的共价键中,极性最强的是? (???? )
A.F―F B.H―F
C.H―Cl D.H―O一、键的极性和分子的极性2、极性分子与非极性分子极性分子:正电中心和负电中心不重合非极性分子:正电中心和负电中心重合正电中心和负电中心是否重合 化学键的极性的向量和是否等于零(定量) 看键的极性,也看分子的空间构型 判断方法:(本质)2、极性分子与非极性分子思考与交流总结键的极性与分子极性的关系 A、都是由非极性键构成的分子一般是非极 性分子。
B、极性键结合形成的双原子分子一定为极 性分子。
C、极性键结合形成的多原子分子,可能为 非极性分子,也可能为极性分子。
D、多原子分子的极性,应有键的极性和分子的空间构型共同来决定。
一、键的极性和分子的极性科学视野表面活性剂和细胞膜二、范德华力及其对物质性质的影响气体在加压或降温是为什么会变为液体、固体?(1)范德华力大小?
范德华力很弱,约比化学键能小1-2数量级二、范德华力及其对物质性质的影响?
(2) 范德华力与相对分子质量的关系结构相似,相对分子质量越大,范德华力越大二、范德华力及其对物质性质的影响(3)范德华力与分子的极性的关系相对分子质量相同或相近时,分子的极性越大,范德华力越大二、范德华力及其对物质性质的影响(4)范德华力对物质熔沸点的影响二、范德华力及其对物质性质的影响二、范德华力及其对物质性质的影响科学视野壁虎与范德华力已经与电负性很强的原子形成共价键的氢原子与另一个分子中电负性很强的原子之间的作用力。三、氢键及其对物质性质的影响氢键的概念:氢键的表示:三、氢键及其对物质性质的影响氢键的本质:是一种静电作用,是除范德华力外的另一种分子间作用力,氢键的大小,介于化学键与范德华力之间,不属于化学键。但也有键长、键能。三、氢键及其对物质性质的影响氢键的种类:分子间氢键
分子内氢键三、氢键及其对物质性质的影响氢键的种类:三、氢键及其对物质性质的影响氢键对物质熔沸点影响:分子间氢键使物质熔沸点升高
分子内氢键使物质熔沸点降低极性溶剂里,溶质分子与溶剂分子间的氢键使溶质溶解度增大,而当溶质分子形成分子间氢键使使溶质溶解度减小。 氢键对物质溶解度的影响:比较熔沸点:
HF HCl
H2O H2S
邻羟基苯甲醛、对羟基苯甲醛课堂讨论应用与拓展为什么NH3极易溶于水?
冰的硬度比一般固体共价化合物大,为什么?
课后习题5?三、氢键及其对物质性质的影响资料卡片某些氢键的键长和键能科学视野生物大分子中的氢键四、溶解性(1)内因:相似相溶原理
(2)外因:影响固体溶解度的主要因素是温度;影响气体溶解度的主要因素是温度和压强。
(3)其他因素:
A)如果溶质与溶剂之间能形成氢键,则溶解度增大,且氢键越强,溶解性越好。如:NH3。
B)溶质与水发生反应时可增大其溶解度,如:SO2。思考与交流PtCl2(NH3)2可以形成两种固体,一种为淡黄色,在水中的溶解度小,另一种为黄绿色,在水中的溶解度较大,请回答下列问题:
⑴PtCl2(NH3)2是平面正方形结构,还是四面体结构
⑵请在以下空格内画出这两种固体分子的几何构型图,
淡黄色固体: ,黄绿色固体: 。
⑶淡黄色固体物质是由 分子组成,黄绿色固体物质是由 分子组成(填“极性分子”或“非极性分子”)
⑷黄绿色固体在水中溶解度比淡黄色固体大,原因是 。五、手性观察一下两组图片,有何特征? 一对分子,组成和原子的排列方式完全相同,但如同左手和右手一样互为镜像,在三维空间无论如何旋转不能重叠,这对分子互称手性异构体。有手性异构体的分子称为手性分子。中心原子称为手性原子。乳酸分子CH3CH(OH)COOH有以下两种异构体: ??? 五、手性具有手性的有机物,是因为含有手性碳原子造成的。
如果一个碳原子所联结的四个原子或原子团各不相同,那么该碳原子称为手性碳原子,记作﹡C 。五、手性注意:也有一些手性物质没有手性碳原子(2)有机物X的结构简式为
若使X通过化学变化,失去光学活性,可能发生的反应类型有________.
A.酯化 B.水解 C.氧化
D.还原 E.消去 F.缩聚下列两分子的关系是 ( )A.互为同分异构体 B.是同一物质
C.是手性分子 D.互为同系物右旋与左旋自然界中的手性珍贵的法螺左旋贝。百万分之一,十分罕见。自然界中的手性手性的应用手性合成
手性催化科学史话巴斯德与手性六、无机含氧酸分子的酸性指出下列无机含氧酸的酸性HClO4 HClO3
H2SO4 HNO3
H3PO4 H2SO3
H3BO3 HNO2六、无机含氧酸分子的酸性把含氧酸的化学式写成(HO)m ROn,
就能根据n值判断常见含氧酸的强弱。
n=0,极弱酸,如硼酸(H3BO3)。
n=1,弱酸,如亚硫酸(H2SO3)。
n=2,强酸,如硫酸(H2SO4)、硝酸(HNO3)。
n=3,极强酸,如高氯酸(HClO4)。 含氧酸的强度取决于中心原子的电负性、原子半径、氧化数。
当中心原子的电负性大、原子半径小、氧化数高时,使O-H键减弱,酸性增强。六、无机含氧酸分子的酸性H2SiO4 H3PO4 H2SO4 HClO4 HClO HClO3 HClO4HClO HBrO HIO练习:比较下列含氧酸酸性的强弱六、无机含氧酸分子的酸性 同周期的含氧酸,自左至右,随中心原子原子序数增大 ,酸性增强。 同一族的含氧酸,自上而下,随中心原子原子序数增大 ,酸性减弱。 同一元素不同价态的含氧酸酸性高价强于低价 。无机含氧酸强度的变化规律某些含氧酸可表示为:(HO)mROn,它的强度与酸中的非羟基氧原子数n有关;n越大,酸性越强:n=0 →弱酸;n=1→中强酸;n=2→强酸;n=3 →超强酸。
已知:硼酸(H3BO3)是弱酸,而亚磷酸(H3PO3)是中强酸
(1) 写出这两种酸的结构式: 、 。
(2)写出亚磷酸和过量的NaOH溶液反应的化学方程式:
