2010高考化学专题复习教案六:物质的量
文档属性
| 名称 | 2010高考化学专题复习教案六:物质的量 |  | |
| 格式 | rar | ||
| 文件大小 | 70.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 新人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2010-04-21 12:06:00 | ||
图片预览



文档简介
《物质的量》教案
【高考热点分析】
物质的量是重要的化学基础知识,是化学计算的核心,具有较强的应用性,是每年高考的重要考点之一。其热点有:相对原子质量、相对分子质量、摩尔质量、阿伏加德罗常数、气体摩尔体积等。
【学习目标】
1.理解相对原子质量,相对分子质量的涵义。
2.掌握物质的量及其单位—摩尔,摩尔质量、气体摩尔体积的涵义。
3.理解阿伏加德罗常数的涵义。掌握物质的量与粒子数、气体体积(标准状况下)之间的相互关系。
【基础知识梳理】
一、基本概念
1.物质的量
①物质的量物理意义:衡量宏观物质的质量和微观结构粒子多少(分子、原子、离子、中子、质子、电子)的物理量,它是七个国际单位制物理量中的一个(质量、长度、时间、电流强度、热力学温度、光学强度)。其单位是摩尔(mol)。
②阿伏加德罗常数(NA)就是0.012KgC—12所含的碳原子数,由此可以看出:
★阿伏加德罗常数是一个精确值(0.012Kg C-12含碳的原子数是个定值)
★ 阿伏加德罗常数可通过实验测定(测定方法有: ;
; 。)
★6.02×1023是个非常近似的值。
③摩尔质量——单位物质的量的物质所具有的质量,即M=
摩尔质量与式量(相对分子质量、相对原子质量)的关系:
摩尔质量是指每摩尔物质微粒(分子、原子、离子、中子、质子、电子及其它粒子,或这些粒子的特定组合)的质量,其单位是g·mol-1;而式量(相对分子质量、相对原子质量)是一种相对比值,单位为1。摩尔质量与式量的意义不同,但在数值上等于其式量。
④引入摩尔的意义:摩尔象一座桥梁把单个的肉眼看不见的微粒跟很大数量的微粒集体,可称量的物质之间联系起来。
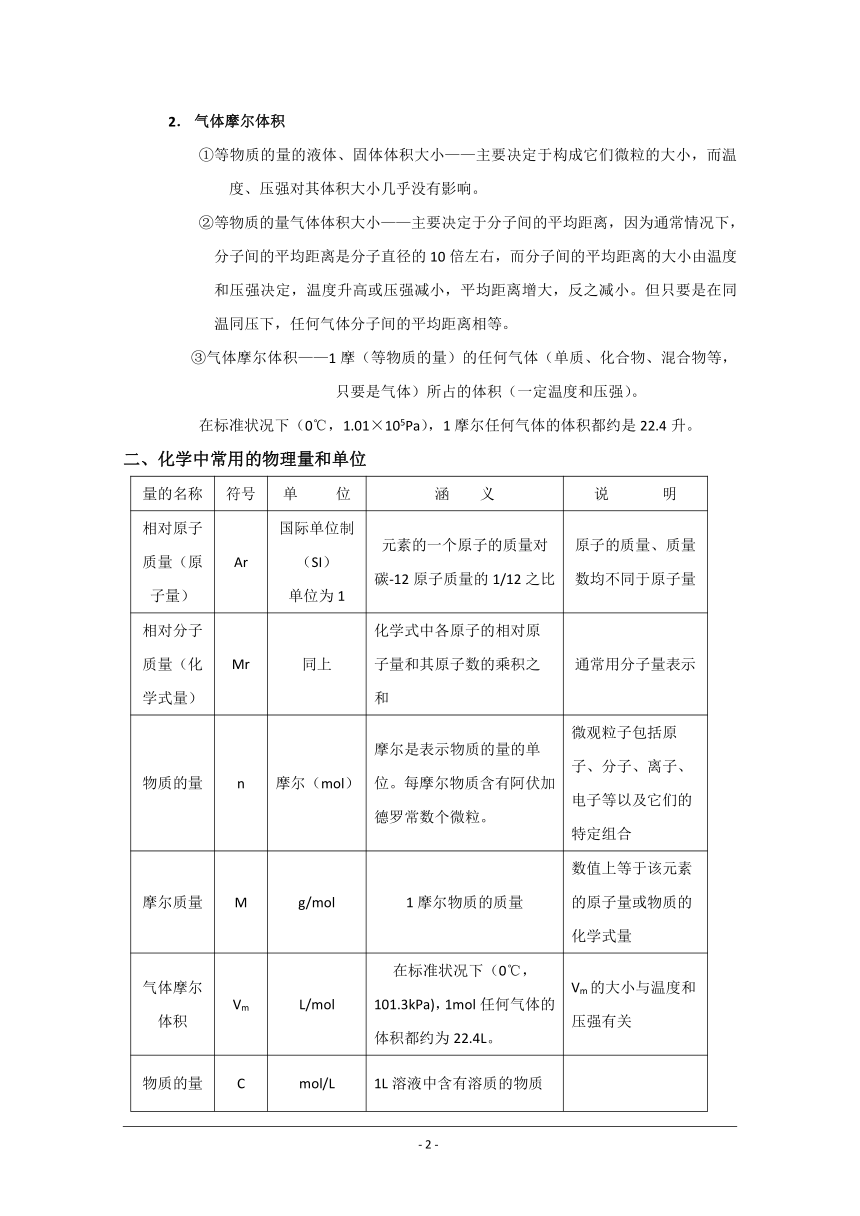
2. 气体摩尔体积
①等物质的量的液体、固体体积大小——主要决定于构成它们微粒的大小,而温度、压强对其体积大小几乎没有影响。
②等物质的量气体体积大小——主要决定于分子间的平均距离,因为通常情况下,分子间的平均距离是分子直径的10倍左右,而分子间的平均距离的大小由温度和压强决定,温度升高或压强减小,平均距离增大,反之减小。但只要是在同温同压下,任何气体分子间的平均距离相等。
③气体摩尔体积——1摩(等物质的量)的任何气体(单质、化合物、混合物等,只要是气体)所占的体积(一定温度和压强)。
在标准状况下(0℃,1.01×105Pa),1摩尔任何气体的体积都约是22.4升。
二、化学中常用的物理量和单位
量的名称 符号 单 位 涵 义 说 明
相对原子质量(原子量) Ar 国际单位制(SI)单位为1 元素的一个原子的质量对碳-12原子质量的1/12之比 原子的质量、质量数均不同于原子量
相对分子质量(化学式量) Mr 同上 化学式中各原子的相对原子量和其原子数的乘积之和 通常用分子量表示
物质的量 n 摩尔(mol) 摩尔是表示物质的量的单位。每摩尔物质含有阿伏加德罗常数个微粒。 微观粒子包括原子、分子、离子、电子等以及它们的特定组合
摩尔质量 M g/mol 1摩尔物质的质量 数值上等于该元素的原子量或物质的化学式量
气体摩尔体积 Vm L/mol 在标准状况下(0℃,101.3kPa),1mol任何气体的体积都约为22.4L。 Vm的大小与温度和压强有关
物质的量浓度 C mol/L 1L溶液中含有溶质的物质的量
三、 物理量之间的关系及其记忆方法:(摩尔立交桥)
微粒数
NA ÷
× NA
÷摩尔质量 22.4L·mol-1÷
质量 物质的量 体积〖气体体积(标准状况)〗
摩尔质量× (mol) ×22.4L·mol-1
÷ 溶液
溶液 体积
体积 ×
浓 度〖物质的量浓度(mol/L)〗
记忆方法:上微粒、下浓度,质量、体积分左右,中间就是摩尔(数)
向下、向内都用除 反之相乘得各数
注意点:
①一个中心:必须以物质的量为中心
②两个前提:在应用Vm=22.4L·mol-1时,一定要有“标准状况”和“气体状态”为两个前提。
③三个条件:★直接构成物质的粒子与间接构成物质的粒子(原子、电子等)间的关系;★摩尔质量与相对分子质量间的关系;
★“强、弱、非”电解质与溶质粒子(分子、或离子)数间的关系。
④四个无关:★物质的量、质量、粒子数的多少与温度、压强的高低无关
★物质的量浓度的大小与所取溶液的体积多少无关
(但溶质粒子数的多少与溶液体积有关)
⑤状态问题:水在标准状况下为液态或固态;SO3在标准状况下为固态,常温常压下为液态;碳原子数大于4的烃,在标准状况下为液态或固态。
⑥特别物质的摩尔质量:D2O、T2O、18O2等
⑦某些物质分子中的原子个数:Ne、O3、白磷等。
⑧一些物质中的化学键数目:SiO2、Si、CH4、P4、CO2等。
⑨某些离子或原子团在水溶液中发生水解反应,使离子数目减少
⑩较复杂的反应中,转移电子数的计算:Na2O2+H2O、Cl2+NaOH、电解AgNO3溶液等。
【典型例题】
1.如果ag某气体中含有的分子数为b,则cg该气体在标准状况下的体积
是(式中NA代表阿伏加德罗常数)
A.22.4bc/(aNA)L B.22.4ab/(cNA)L C.22.4ac/(bNA)L D.22.4b/(acNA)L
2.(2001年上海)设NA为阿伏加德罗常数,下列说法不正确的是:
A、标准状况下的22.4L辛烷完全燃烧,生成二氧化碳分子数为8NA
B.18g水中含有的电子数为10NA
C.46gNO2和46gN2O4含有的原子数均为3NA
D.在1L2mol/L的硝酸镁溶液中含有的硝酸根离子数为4NA
3.设NA代表阿伏加德罗常数,下列说法中正确的是
A.2L 1mol/L(NH4)2SO4溶液中含2NA个NH4+
B.SiO2晶体中,与每1molSi原子结合形成共价键的O原子数为4NA
C.在标准状况下,1L辛烷完全燃烧,可产生8NA /22.4L二氧化碳
D.常温常压下,1mol氖气中含有NA个氖原子
4.(2001年京、皖、蒙春季)氯的原子序数是17,35Cl是氯的一种同位素。
下列说法中正确的是:
A.35Cl原子所含的质子数是18 B、mol的1H35Cl分子所含的中子数约为6.02×1023
C.3.5g的35Cl2气体的体积是2.24L D、35Cl2气体的摩尔质量为70g/mol
5.下列说法正确的是:
A.标况下1摩任何气体所占体积一定是22.4升
B.非标准状况下,1摩H 2所占体积一定不是22.4L
C.标况下,1mol水蒸气所占体积约为22.4L D.标况下1molNO2气体所占体积为22.4L
6.以石墨作电极电解氯化铜的溶液,电流强度为aA,时间t min后阴极增重Wg,
在阳极得VL纯净气体(标准状况),则计算阿伏加德罗常数的列式是
(1个电子的电量为q,铜的原子量为M)
A.64at/(2qw) B.672at/(Vq) C.30Mat/(wq) D.无法列式
7.铝分别与足量的稀盐酸和氢氧化钠溶液反应,当两个反应放出的气体在相同状况下
体积相等时,反应中消耗的HCl和NaOH物质的量之比为
A.1:1 B.2:1 C、3:1 D.1:3
8.如果将相对原子质量的标准改变(如将C-12改为C-24),则阿伏加德罗常数、摩尔质量、气体摩尔体积、物质的量等将如何改变?
【强化训练】
1.在化学学科上经常使用下列物理量,其中跟阿伏加德罗常数无关的物理量是
A、键长 B.摩尔质量 C.物质的量 D.气体摩尔体积
2.在100mL0.10mol/L的AgNO3溶液中加入100mL溶有2.08g BaCl2的溶液,再加入
100mL溶有0.010molCuSO4·5H2O的溶液,充分反应.下列说法中正确的是
A.最终得到白色沉淀和无色溶液
B、最终得到白色沉淀是等物质的量的两种化合物的混合物
C.在最终的溶液中n(Cl-)=0.02mol
D.在最终的溶液中c(Cu2+)=0.01mol/L
3.假设的相对原子质量为24,则下列推断不正确的是
A、标准状况时11.2 L的质量为32g B.的相对原子质量为32
C.44g和28gCO含有相同的分子数 D.标准状况时44g的体积是22.4L
4.某气体的摩尔质量为Mg·,N表示阿伏加德罗常数的值,在一定的温度和压强下,体积为VL的该气体所含有的分子数为X.则表示的是
A.以g为单位VL该气体的质量 B、以g为单位1L该气体的质量
C.1L该气体中所含的分子数 D.以L为单位1mol该气体的体积
5.下列叙述正确的是
A.同温同压下,相同体积的物质,它们的物质的量必相等
B、任何条件下,等物质的量的乙烯和一氧化碳所含的分子数必相等
C.1L一氧化碳气体一定比1L氧气的质量小
D.等体积、等物质的量浓度的强酸中所含的H+数一定相等
6.某温度下,在体积一定的密闭容器中,适量的NH3和Cl2恰好完全反应,其产物只有N2和NH4Cl,则反应前后容器中压强之比应接近于
A、1:11 B、7:11 C.11:1 D、11:7
7.已知Ba(AlO2)2可溶于水,向含有a mol Al2(SO4)3的溶液中加入含有b mol Ba(OH)2
溶液(2aA、(8a-2b)mol B、(a+2b)mol C、(8a-b)mol D.(11a-2b)mol
8.在相同的状况下有A、B两种气体,若VA=VB,质量WA(n表示物质的量,M表示式量)
A、MA=MB B.MA9.有一真空瓶重500g,在同一条件下装满O2重508g,装满另一种G气体时重511g,
则G的分子量是 A、11 B、22 C.44 D、56
10.电解普通水(H2O)和重水(D2O)的混合物,通电一段时间后两极共生成气体18.5g,体积为33.6L(标况),在生成的气体中,重氢(D)和普通氢(H)的原子数比为
A、1:2 B、2:3 C.1:3 D、2:5
11.在一个密闭容器中盛有11gX气体(X的摩尔质量为44g/mol)时,压强为1×104Pa。如果在相同温度下,把更多的气体X充入容器,使容器内压强增至5×104Pa,这时
容器内气体X的分子数约为
A.3.3×1025 B.3.3×1024 C、7.5×1023 D.7.5×1022
12.设阿伏加德罗常数为NA。标准状况下某种O2和N2的混合气体mg含有b个分子,
则ng该混合气体在标准状况下所占体积是
A、 B. C. D.
13.NA表示阿伏加德罗常数,下列说法中不正确的是:
A、 1mol甲基正离子(CH3+)所含电子数为9NA
B、 从四氧化三铁中还原出1mol Fe,发生转移的电子数为3NA
C. 标准状况下,22.4L CO2与CO的混合气体中含有的碳原子数为NA
D. 500mL 0.5mol·L-1的Ca(NO3)2溶液中,含有NO3-的数目为0.5NA
14.NA表示阿伏加德罗常数,下列说法正确的是:
A. 22.4L的CH4中含有4NA个C-H键
B. 20g D2O中含有的质子数为12NA
C. 含有0.1NA个H+的HCl溶液pH=1
D、用惰性电极电解食盐水时,每当线路中有2NA个电子通过时,就有2NA个
水分子被消耗掉
15.已知阿伏加德罗常数、物质的摩尔质量、一定条件下的摩尔体积。
下列物理量不能计算出近似值的是:
A. 固态物质分子的大小和质量 B. 液态物质的分子大小和质量
C、气态物质的分子大小和质量 D. 气态物质分子的质量
16.同温同压下,等质量的SO2和CO2相比较,下列叙述正确的是:
A、密度比等于16:11 B.物质的量比等于16:11
C.体积比等于1:1 D、体积比等于11:16
17.0.03molCu完全溶于HNO3,产生氮的氧化物混合气体共0.05mol,则该混合气体的平均相对分子质量可能是:
A.3O B、46 C.66 D、50
18.某固体A在一定温度下分解生成固体B、C和D,A(s) B(s)+C(g)+4D(g)
若测得生成的气体的质量是同温同压下相同体积氢气的10倍,且当所得气体在标况下的体积为22.4L时,所得B的质量为30.4克。则A的摩尔质量是:
A.130.4g·mol-1 B.50.4g·mol-1 C.182.4g·mol-1 D、252g·mol-1
19.同温同压下,当反应物分解了8%时,总体积也增加8%的是:
A、2NH3(g)N2(g)+3H2(g) B.2NO(g)N2(g)+O2(g)
C.2N2O5(g)4NO2(g)+O2(g) D.2NO2(g)2NO(g)+O2(g)
20.下列各组中两种气体的分子数一定相等的是
A.温度相同、体积相同的O2和N2 B、质量相等、密度不等的N2和C2H4
C.体积相同、密度不相等的CO和C2H4 D.压强相同,体积相同的O2和H2
21.一定条件下,可逆反应A2(g)+B2(g) 2C(g)达到化学平衡状态,测得平衡状态时C(A2)=0.5mol·L-1,C(B2)=0.1omol·L-1,C(C)=1.6mol·L-1,
其中A2、B2、C的起始浓度分别为a mol·L-1、b mol·L-1、c mol·L-1,请回答:
a、b应满足的关系是 ,a的取值范围是
说明你的结论的由来 .
22.称取金属钠、铁、铝各mg,在室温下分别与VL4mol·L-1的HCl充分反应,试推断在下列三种情况下,V的取值范围(用含m的表达式表示)
(1)铝与盐酸反应放出H2最多__________(2)钠与盐酸反应放出H2最多________
(3)铝、铁分别与VL盐酸反应放出氢气一样多___________________
23.常温下A和B两种气体组成的混合物(A的式量大于B),经分析混合物气体中只
含有C、O元素。
(1)当混合物中C、O的质量比总是小于3∶8时,混合气体中A和B分别
是 和 (填写物质名称)。
(2)当混合物中C、O的质量比总是介于3∶8和3∶4之间时,混合气体中A和B
分别可能是 和 或 和 (填写化学式)。
24.体积比为1∶1的氢气和某种氮的氧化物在一定温度和压强下反应,生成体积比也
为1∶1的水蒸气和氮气,并且反应前后总体积不变。则这种氮氧化物的
化学式为 ,反应的化学方程式为 。
25.常温下A和B两种气体组成的混合物(A的式量大于B),经分析混合气体中只含
有N和H两种元素,而且不论A和B如何混合,N和H的质量比总是大于14∶3,由此可以确定A为 ,B为 ,
其理由是 ;
若上述混合物中N和H的质量比为7∶1,则在此混合物中A和B的物质的量
之比是 ,A在混合物中的体积分数为 。
26.加热硫酸铜晶体,随着温度不断升高到1000℃,晶体会逐渐“释放”水蒸气、
三氧化硫(并会分解)、氧气,同时生成CuO,而最后CuO转化为Cu2O,现将
25.0g CuSO4·H2O均匀加热,缓慢升温至1000℃,并恒温一段时间。
试通过计算回答下列问题:
(1)反应过程中固体产物的质量是否可以为10g(填“可能”或“不可能”) ;
(2)若实验无误差,反应完全后,气体产物除去水后,其物质的量n(气体)的
取值范围为 ;
(3)某同学在实验最后获得固体质量为7.6g,试计算该同学获得固体物质的组成
成分和它们的质量。
27.NH3和Cl2可迅速发生如下反应:
2NH3+3Cl2=N2+6HCl.附图为反应后
气体总体积V随该混合气体中Cl2
的体积含量(x%)而变化的图象
(每次实验取气体的总量均为18L)试计算
(1) 当反应处于B点时(结束后)原混合气体中Cl2体积百分含量是多少?
(2) 当反应结束处于A点时所得气体的总体积是多少升?
(3) 当反应结束时,V=6L,则原混合气体中Cl2的体积百分含量为多少?
w.w.^w.k.&s.5*u.c.#om
www.
PAGE
- 9 -
【高考热点分析】
物质的量是重要的化学基础知识,是化学计算的核心,具有较强的应用性,是每年高考的重要考点之一。其热点有:相对原子质量、相对分子质量、摩尔质量、阿伏加德罗常数、气体摩尔体积等。
【学习目标】
1.理解相对原子质量,相对分子质量的涵义。
2.掌握物质的量及其单位—摩尔,摩尔质量、气体摩尔体积的涵义。
3.理解阿伏加德罗常数的涵义。掌握物质的量与粒子数、气体体积(标准状况下)之间的相互关系。
【基础知识梳理】
一、基本概念
1.物质的量
①物质的量物理意义:衡量宏观物质的质量和微观结构粒子多少(分子、原子、离子、中子、质子、电子)的物理量,它是七个国际单位制物理量中的一个(质量、长度、时间、电流强度、热力学温度、光学强度)。其单位是摩尔(mol)。
②阿伏加德罗常数(NA)就是0.012KgC—12所含的碳原子数,由此可以看出:
★阿伏加德罗常数是一个精确值(0.012Kg C-12含碳的原子数是个定值)
★ 阿伏加德罗常数可通过实验测定(测定方法有: ;
; 。)
★6.02×1023是个非常近似的值。
③摩尔质量——单位物质的量的物质所具有的质量,即M=
摩尔质量与式量(相对分子质量、相对原子质量)的关系:
摩尔质量是指每摩尔物质微粒(分子、原子、离子、中子、质子、电子及其它粒子,或这些粒子的特定组合)的质量,其单位是g·mol-1;而式量(相对分子质量、相对原子质量)是一种相对比值,单位为1。摩尔质量与式量的意义不同,但在数值上等于其式量。
④引入摩尔的意义:摩尔象一座桥梁把单个的肉眼看不见的微粒跟很大数量的微粒集体,可称量的物质之间联系起来。
2. 气体摩尔体积
①等物质的量的液体、固体体积大小——主要决定于构成它们微粒的大小,而温度、压强对其体积大小几乎没有影响。
②等物质的量气体体积大小——主要决定于分子间的平均距离,因为通常情况下,分子间的平均距离是分子直径的10倍左右,而分子间的平均距离的大小由温度和压强决定,温度升高或压强减小,平均距离增大,反之减小。但只要是在同温同压下,任何气体分子间的平均距离相等。
③气体摩尔体积——1摩(等物质的量)的任何气体(单质、化合物、混合物等,只要是气体)所占的体积(一定温度和压强)。
在标准状况下(0℃,1.01×105Pa),1摩尔任何气体的体积都约是22.4升。
二、化学中常用的物理量和单位
量的名称 符号 单 位 涵 义 说 明
相对原子质量(原子量) Ar 国际单位制(SI)单位为1 元素的一个原子的质量对碳-12原子质量的1/12之比 原子的质量、质量数均不同于原子量
相对分子质量(化学式量) Mr 同上 化学式中各原子的相对原子量和其原子数的乘积之和 通常用分子量表示
物质的量 n 摩尔(mol) 摩尔是表示物质的量的单位。每摩尔物质含有阿伏加德罗常数个微粒。 微观粒子包括原子、分子、离子、电子等以及它们的特定组合
摩尔质量 M g/mol 1摩尔物质的质量 数值上等于该元素的原子量或物质的化学式量
气体摩尔体积 Vm L/mol 在标准状况下(0℃,101.3kPa),1mol任何气体的体积都约为22.4L。 Vm的大小与温度和压强有关
物质的量浓度 C mol/L 1L溶液中含有溶质的物质的量
三、 物理量之间的关系及其记忆方法:(摩尔立交桥)
微粒数
NA ÷
× NA
÷摩尔质量 22.4L·mol-1÷
质量 物质的量 体积〖气体体积(标准状况)〗
摩尔质量× (mol) ×22.4L·mol-1
÷ 溶液
溶液 体积
体积 ×
浓 度〖物质的量浓度(mol/L)〗
记忆方法:上微粒、下浓度,质量、体积分左右,中间就是摩尔(数)
向下、向内都用除 反之相乘得各数
注意点:
①一个中心:必须以物质的量为中心
②两个前提:在应用Vm=22.4L·mol-1时,一定要有“标准状况”和“气体状态”为两个前提。
③三个条件:★直接构成物质的粒子与间接构成物质的粒子(原子、电子等)间的关系;★摩尔质量与相对分子质量间的关系;
★“强、弱、非”电解质与溶质粒子(分子、或离子)数间的关系。
④四个无关:★物质的量、质量、粒子数的多少与温度、压强的高低无关
★物质的量浓度的大小与所取溶液的体积多少无关
(但溶质粒子数的多少与溶液体积有关)
⑤状态问题:水在标准状况下为液态或固态;SO3在标准状况下为固态,常温常压下为液态;碳原子数大于4的烃,在标准状况下为液态或固态。
⑥特别物质的摩尔质量:D2O、T2O、18O2等
⑦某些物质分子中的原子个数:Ne、O3、白磷等。
⑧一些物质中的化学键数目:SiO2、Si、CH4、P4、CO2等。
⑨某些离子或原子团在水溶液中发生水解反应,使离子数目减少
⑩较复杂的反应中,转移电子数的计算:Na2O2+H2O、Cl2+NaOH、电解AgNO3溶液等。
【典型例题】
1.如果ag某气体中含有的分子数为b,则cg该气体在标准状况下的体积
是(式中NA代表阿伏加德罗常数)
A.22.4bc/(aNA)L B.22.4ab/(cNA)L C.22.4ac/(bNA)L D.22.4b/(acNA)L
2.(2001年上海)设NA为阿伏加德罗常数,下列说法不正确的是:
A、标准状况下的22.4L辛烷完全燃烧,生成二氧化碳分子数为8NA
B.18g水中含有的电子数为10NA
C.46gNO2和46gN2O4含有的原子数均为3NA
D.在1L2mol/L的硝酸镁溶液中含有的硝酸根离子数为4NA
3.设NA代表阿伏加德罗常数,下列说法中正确的是
A.2L 1mol/L(NH4)2SO4溶液中含2NA个NH4+
B.SiO2晶体中,与每1molSi原子结合形成共价键的O原子数为4NA
C.在标准状况下,1L辛烷完全燃烧,可产生8NA /22.4L二氧化碳
D.常温常压下,1mol氖气中含有NA个氖原子
4.(2001年京、皖、蒙春季)氯的原子序数是17,35Cl是氯的一种同位素。
下列说法中正确的是:
A.35Cl原子所含的质子数是18 B、mol的1H35Cl分子所含的中子数约为6.02×1023
C.3.5g的35Cl2气体的体积是2.24L D、35Cl2气体的摩尔质量为70g/mol
5.下列说法正确的是:
A.标况下1摩任何气体所占体积一定是22.4升
B.非标准状况下,1摩H 2所占体积一定不是22.4L
C.标况下,1mol水蒸气所占体积约为22.4L D.标况下1molNO2气体所占体积为22.4L
6.以石墨作电极电解氯化铜的溶液,电流强度为aA,时间t min后阴极增重Wg,
在阳极得VL纯净气体(标准状况),则计算阿伏加德罗常数的列式是
(1个电子的电量为q,铜的原子量为M)
A.64at/(2qw) B.672at/(Vq) C.30Mat/(wq) D.无法列式
7.铝分别与足量的稀盐酸和氢氧化钠溶液反应,当两个反应放出的气体在相同状况下
体积相等时,反应中消耗的HCl和NaOH物质的量之比为
A.1:1 B.2:1 C、3:1 D.1:3
8.如果将相对原子质量的标准改变(如将C-12改为C-24),则阿伏加德罗常数、摩尔质量、气体摩尔体积、物质的量等将如何改变?
【强化训练】
1.在化学学科上经常使用下列物理量,其中跟阿伏加德罗常数无关的物理量是
A、键长 B.摩尔质量 C.物质的量 D.气体摩尔体积
2.在100mL0.10mol/L的AgNO3溶液中加入100mL溶有2.08g BaCl2的溶液,再加入
100mL溶有0.010molCuSO4·5H2O的溶液,充分反应.下列说法中正确的是
A.最终得到白色沉淀和无色溶液
B、最终得到白色沉淀是等物质的量的两种化合物的混合物
C.在最终的溶液中n(Cl-)=0.02mol
D.在最终的溶液中c(Cu2+)=0.01mol/L
3.假设的相对原子质量为24,则下列推断不正确的是
A、标准状况时11.2 L的质量为32g B.的相对原子质量为32
C.44g和28gCO含有相同的分子数 D.标准状况时44g的体积是22.4L
4.某气体的摩尔质量为Mg·,N表示阿伏加德罗常数的值,在一定的温度和压强下,体积为VL的该气体所含有的分子数为X.则表示的是
A.以g为单位VL该气体的质量 B、以g为单位1L该气体的质量
C.1L该气体中所含的分子数 D.以L为单位1mol该气体的体积
5.下列叙述正确的是
A.同温同压下,相同体积的物质,它们的物质的量必相等
B、任何条件下,等物质的量的乙烯和一氧化碳所含的分子数必相等
C.1L一氧化碳气体一定比1L氧气的质量小
D.等体积、等物质的量浓度的强酸中所含的H+数一定相等
6.某温度下,在体积一定的密闭容器中,适量的NH3和Cl2恰好完全反应,其产物只有N2和NH4Cl,则反应前后容器中压强之比应接近于
A、1:11 B、7:11 C.11:1 D、11:7
7.已知Ba(AlO2)2可溶于水,向含有a mol Al2(SO4)3的溶液中加入含有b mol Ba(OH)2
溶液(2a
8.在相同的状况下有A、B两种气体,若VA=VB,质量WA
A、MA=MB B.MA
则G的分子量是 A、11 B、22 C.44 D、56
10.电解普通水(H2O)和重水(D2O)的混合物,通电一段时间后两极共生成气体18.5g,体积为33.6L(标况),在生成的气体中,重氢(D)和普通氢(H)的原子数比为
A、1:2 B、2:3 C.1:3 D、2:5
11.在一个密闭容器中盛有11gX气体(X的摩尔质量为44g/mol)时,压强为1×104Pa。如果在相同温度下,把更多的气体X充入容器,使容器内压强增至5×104Pa,这时
容器内气体X的分子数约为
A.3.3×1025 B.3.3×1024 C、7.5×1023 D.7.5×1022
12.设阿伏加德罗常数为NA。标准状况下某种O2和N2的混合气体mg含有b个分子,
则ng该混合气体在标准状况下所占体积是
A、 B. C. D.
13.NA表示阿伏加德罗常数,下列说法中不正确的是:
A、 1mol甲基正离子(CH3+)所含电子数为9NA
B、 从四氧化三铁中还原出1mol Fe,发生转移的电子数为3NA
C. 标准状况下,22.4L CO2与CO的混合气体中含有的碳原子数为NA
D. 500mL 0.5mol·L-1的Ca(NO3)2溶液中,含有NO3-的数目为0.5NA
14.NA表示阿伏加德罗常数,下列说法正确的是:
A. 22.4L的CH4中含有4NA个C-H键
B. 20g D2O中含有的质子数为12NA
C. 含有0.1NA个H+的HCl溶液pH=1
D、用惰性电极电解食盐水时,每当线路中有2NA个电子通过时,就有2NA个
水分子被消耗掉
15.已知阿伏加德罗常数、物质的摩尔质量、一定条件下的摩尔体积。
下列物理量不能计算出近似值的是:
A. 固态物质分子的大小和质量 B. 液态物质的分子大小和质量
C、气态物质的分子大小和质量 D. 气态物质分子的质量
16.同温同压下,等质量的SO2和CO2相比较,下列叙述正确的是:
A、密度比等于16:11 B.物质的量比等于16:11
C.体积比等于1:1 D、体积比等于11:16
17.0.03molCu完全溶于HNO3,产生氮的氧化物混合气体共0.05mol,则该混合气体的平均相对分子质量可能是:
A.3O B、46 C.66 D、50
18.某固体A在一定温度下分解生成固体B、C和D,A(s) B(s)+C(g)+4D(g)
若测得生成的气体的质量是同温同压下相同体积氢气的10倍,且当所得气体在标况下的体积为22.4L时,所得B的质量为30.4克。则A的摩尔质量是:
A.130.4g·mol-1 B.50.4g·mol-1 C.182.4g·mol-1 D、252g·mol-1
19.同温同压下,当反应物分解了8%时,总体积也增加8%的是:
A、2NH3(g)N2(g)+3H2(g) B.2NO(g)N2(g)+O2(g)
C.2N2O5(g)4NO2(g)+O2(g) D.2NO2(g)2NO(g)+O2(g)
20.下列各组中两种气体的分子数一定相等的是
A.温度相同、体积相同的O2和N2 B、质量相等、密度不等的N2和C2H4
C.体积相同、密度不相等的CO和C2H4 D.压强相同,体积相同的O2和H2
21.一定条件下,可逆反应A2(g)+B2(g) 2C(g)达到化学平衡状态,测得平衡状态时C(A2)=0.5mol·L-1,C(B2)=0.1omol·L-1,C(C)=1.6mol·L-1,
其中A2、B2、C的起始浓度分别为a mol·L-1、b mol·L-1、c mol·L-1,请回答:
a、b应满足的关系是 ,a的取值范围是
说明你的结论的由来 .
22.称取金属钠、铁、铝各mg,在室温下分别与VL4mol·L-1的HCl充分反应,试推断在下列三种情况下,V的取值范围(用含m的表达式表示)
(1)铝与盐酸反应放出H2最多__________(2)钠与盐酸反应放出H2最多________
(3)铝、铁分别与VL盐酸反应放出氢气一样多___________________
23.常温下A和B两种气体组成的混合物(A的式量大于B),经分析混合物气体中只
含有C、O元素。
(1)当混合物中C、O的质量比总是小于3∶8时,混合气体中A和B分别
是 和 (填写物质名称)。
(2)当混合物中C、O的质量比总是介于3∶8和3∶4之间时,混合气体中A和B
分别可能是 和 或 和 (填写化学式)。
24.体积比为1∶1的氢气和某种氮的氧化物在一定温度和压强下反应,生成体积比也
为1∶1的水蒸气和氮气,并且反应前后总体积不变。则这种氮氧化物的
化学式为 ,反应的化学方程式为 。
25.常温下A和B两种气体组成的混合物(A的式量大于B),经分析混合气体中只含
有N和H两种元素,而且不论A和B如何混合,N和H的质量比总是大于14∶3,由此可以确定A为 ,B为 ,
其理由是 ;
若上述混合物中N和H的质量比为7∶1,则在此混合物中A和B的物质的量
之比是 ,A在混合物中的体积分数为 。
26.加热硫酸铜晶体,随着温度不断升高到1000℃,晶体会逐渐“释放”水蒸气、
三氧化硫(并会分解)、氧气,同时生成CuO,而最后CuO转化为Cu2O,现将
25.0g CuSO4·H2O均匀加热,缓慢升温至1000℃,并恒温一段时间。
试通过计算回答下列问题:
(1)反应过程中固体产物的质量是否可以为10g(填“可能”或“不可能”) ;
(2)若实验无误差,反应完全后,气体产物除去水后,其物质的量n(气体)的
取值范围为 ;
(3)某同学在实验最后获得固体质量为7.6g,试计算该同学获得固体物质的组成
成分和它们的质量。
27.NH3和Cl2可迅速发生如下反应:
2NH3+3Cl2=N2+6HCl.附图为反应后
气体总体积V随该混合气体中Cl2
的体积含量(x%)而变化的图象
(每次实验取气体的总量均为18L)试计算
(1) 当反应处于B点时(结束后)原混合气体中Cl2体积百分含量是多少?
(2) 当反应结束处于A点时所得气体的总体积是多少升?
(3) 当反应结束时,V=6L,则原混合气体中Cl2的体积百分含量为多少?
w.w.^w.k.&s.5*u.c.#om
www.
PAGE
- 9 -
同课章节目录
