新课标2010高考化学二轮复习:专题四《化学反应速率与化学平衡的综合探究》
文档属性
| 名称 | 新课标2010高考化学二轮复习:专题四《化学反应速率与化学平衡的综合探究》 |  | |
| 格式 | rar | ||
| 文件大小 | 108.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2010-04-23 20:07:00 | ||
图片预览




文档简介
本资料来自于资源最齐全的21世纪教育网www.21cnjy.com
【专题四】化学反应速率与化学平衡的综合探究
【考情分析】
化学反应速率理论主要是解决快出产品的问题,化学平衡理论主要是解决多出产品的问题,这二个问题无论对理论研究还是化工生产都具有重大意义,因此化学反应速率和化学平衡知识一直是高考中考核的热点内容,同时新课程中由于引入了平衡常数和化学反应方向的判断,因此在新高考中涉及有关平衡常数的计算和应用性问题可能性较大,同时平衡问题在试卷中的权重也会加大。
【知识交汇】
1. 化学反应方向的判断
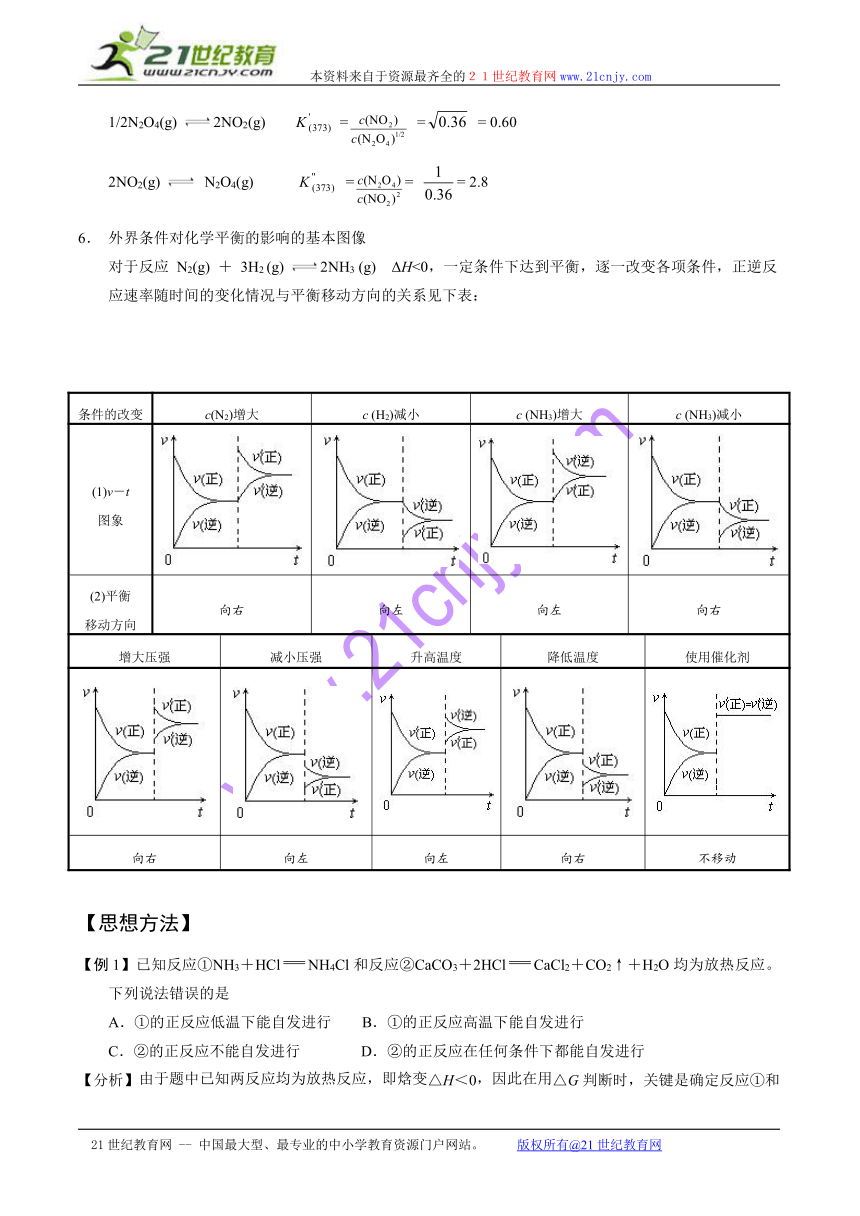
用焓判据或熵判据判断化学反应的方向均有局限性,因此宜用综合判据△G判断化学反应的方向,△G==△H-T△S,若△G小于0,则该条件下的反应为自发反应,若△G大于0,则该条件下的反应为非自发反应,其逆反应能自发进行,其结果可用右图表示。
2. 对于反应a A(g)+b B(s)=c C(g),条件的变化(其它条
件不发生变化)引起的化学反应速率变化见下表。
条件的改变 化学反应速率的变化 理论解释
⑴增大A的浓度 增大 增大单位体积内活化分子数,单位时间内有效碰撞次数增加
⑵升高温度 增大 增大反应物分子中活化分子百分数,使有效碰撞次数增加,同时,温度升高,分子运动加快,单位时间内碰撞次数增加
⑶恒容条件下,增加A 增大 相当于增大A的浓度,解释同(1)
⑷恒容条件下,充入与反应无关的He,总压强增大 不变 反应物浓度没有发生变化
⑸恒压条件下,充入与反应无关的He,总压强不变 减小 相当于增大容器的体积,反应物的浓度减小
⑹使用适当的催化剂 增大 降低反应活化能,使更多反应物分子成为活化分子,成千成万倍地增加了有效碰撞次数
⑺把B(s)粉碎成粉末 增大 接触面积增大
3.化学平衡移动和转化率的关系
反应实例 条件变化与平衡移动方向 达新平衡后转化率变化
2SO2 +O2
2SO3(g)ΔH<0 增大O2浓度,平衡正移 SO2 的转化率增大,O2的转化率减小
增大SO3浓度,平衡逆移 从逆反应角度看,SO3的转化率减小
升高温度,平衡逆移 SO2 、O2的转化率都减小
增大压强,平衡正移 SO2 、O2的转化率都增大
2NO2
N2O4(g) 体积不变时,充入NO2气体,平衡正移 NO2的转化率增大
体积不变时,充入N2O4气体,平衡逆移 NO2的转化率增大
2HI
H2+I2(g) 增大H2的浓度,平衡逆移 H2的转化率减小,I2的转化率增大
增大HI的浓度,平衡正移 HI的转化率不变
增大压强,平衡不移动 转化率不变
4. 等效平衡与等同平衡的异同
在分析等效平衡与等同平衡时宜抓住3个变量,即体积分数、物质的量和物质的量浓度,若是“等同平衡”三者皆相同,若是“等效平衡”则体积分数一定相同,物质的量、物质的量浓度可能会同比例发生变化。其规律总结如下:
条 件 等效条件 结 果
恒温恒容Ⅰ反应前后气体分子数不相等A(g)+B(g)
C(g)(△n(g)≠0) 投料换算成相同物质表示时量相同回归定值 两次平衡时各组分百分含量、n、c均相同完全相同等同平衡
恒温恒容Ⅱ反应前后气体分子数相等A(g)+B(g)
2C(g)(△n(g)=0) 投料换算成相同物质表示时等比例回归定比 两次平衡时各组分百分含量相同,n、c同比例变化等效平衡
恒温恒压Ⅲ所有有气体参加的可逆反应 投料换算成相同物质表示时等比例回归定比 两次平衡时各组分百分含量相同、c相同,n同比例变化等效平衡
5. 化学平衡常数
⑴不要把反应体系中纯固体、纯液体以及稀水溶液中的水的浓度写进平衡常数表达式。
例如:CaCO3(s)
CaO(s) + CO2(g) K = c(CO2)
Cr2O72- (aq) + H2O(l)
2CrO42- (aq) + 2H+(aq) K = c(CrO42-)2c(H+)/c(Cr2O72-)
但非水溶液中反应,若有水参加或生成,则此时水的浓度不可视为常数,应写进平衡常数表达式中。
例如:C2H5OH + CH3COOH
CH3COOC2H5 + H2O K =
⑵同一化学反应,化学反应方程式写法不同,其平衡常数表达式及数值亦不同。例如:
N2O4(g)
2NO2(g) K(373) = = 0.36
1/2N2O4(g)
2NO2(g) K = = = 0.60
2NO2(g)
N2O4(g) K == = 2.8
6. 外界条件对化学平衡的影响的基本图像
对于反应 N2(g) + 3H2 (g)
2NH3 (g) ΔH<0,一定条件下达到平衡,逐一改变各项条件,正逆反应速率随时间的变化情况与平衡移动方向的关系见下表:
条件的改变 c(N2)增大 c (H2)减小 c (NH3)增大 c (NH3)减小
(1)v-t图象
(2)平衡移动方向 向右 向左 向左 向右
增大压强 减小压强 升高温度 降低温度 使用催化剂
向右 向左 向左 向右 不移动
【思想方法】
【例1】已知反应①NH3+HClNH4Cl和反应②CaCO3+2HClCaCl2+CO2↑+H2O均为放热反应。下列说法错误的是
A.①的正反应低温下能自发进行 B.①的正反应高温下能自发进行
C.②的正反应不能自发进行 D.②的正反应在任何条件下都能自发进行
【分析】由于题中已知两反应均为放热反应,即焓变△H<0,因此在用△G判断时,关键是确定反应①和②中熵值的变化,由于熵是衡量体系混乱度的标志,因此可用反应前后气体的物质的量的多少衡量熵值的大小。反应①中气体的物质的量减小,因此反应①是熵减的反应,即△S<0。反应②中气体的物质的量增加,因此反应②是熵增的反应,即△S>0。由此可知反应①的正反应在低温下能自发进行,反应②的正反应在任何条件下都能自发进行。
[答案]BC
【例2】⑴在一定条件下,可逆反应达到平衡状态的本质特征是____________________,下列关系中能说明反应N2(g)+3H2(g)
2NH3(g)已经达到平衡状态的是_________。
A.3v正(N2)=v正(H2) B.v正(N2)=v逆(NH3)
C.2v正(H2)=3v逆(NH3) D.v正(N2)=3v逆(H2)
⑵在一定温度下的恒容密闭容器中,可逆反应达到平衡状态时,一些宏观物理量恒定不变:a各物质的浓度不变,b平衡混合物中各组份的物质的量分数或质量分数不变,c容器内气体压强不变,d容器内气体密度不变,e容器内气体颜色不变。
①能说明反应N2(g)+3H2(g)
2NH3(g)达到平衡状态的有_____________;
②能说明反应H2(g)+I2(g)
2HI(g)达到平衡状态的有________________;
③能说明反应2NO2(g)
N2O4(g)达到平衡状态的有__________________;
④能说明反应C(s)+H2O(g)
CO(g)+H2(g)达到平衡状态的有_________。
【分析】⑴中选项中给出的是用绝对标志判定化学平衡状态,选项C正确。⑵中判断时首先要注意到本题中反应的条件是恒温恒容,其次要注意化学反应方程式中是否有固体物质存在。反应①在反应过程中气体的质量不变,因此在恒容状态下不能用密度判断反应是否达到平衡状态,由于反应物和生成物均为无色气体,因此也不能用颜色来判定。反应②是一个气体体积不变的反应,反应过程中气体的质量不变,物质的量也不变,所以不能用压强和密度判定反应是否达平衡状态。反应③在反应过程中气体的质量保持不变,因此同样不能用密度来判定。反应④中反应过程中气体的质量和气体的物质的量均发生改变,因此a、b、c、d均可用来判定反应是否达平衡状态,由于反应物和生成物均为无色气体,因此不能用颜色来判定。
[答案]⑴正反应速率与逆反应速率相等 C
⑵ ① a b c ② a b e ③ a b c e ④ a b c d
【例3】在体积恒定的密闭容器中,充入3 molA和1 molB发生反应3A(g)+B(g)
xC(g),达到平衡后,C在平衡混合气中的体积分数为φ。若维持温度不变,按1.2 molA、0.4 molB、0.6 molC为起始物质。
⑴若达到平衡后C的体积分数仍为φ,则x值是_______;
⑵若达到平衡后压强不变,C的体积分数仍为φ,则x值是____________。
A.1 B.2 C.3 D.4
【分析】第⑴问只要满足φ相等,属于等效平衡,满足题中条件应用回归定比法,x可等于1也可等于4。第⑵不仅要满足达到平衡时φ相等且压强不变,压强不变即物质的量不变,因此属于“等同平衡”,必须用回归定值法,即1.2 mol+3mol,0.4 mol+1mol,解得x1。
[答案]AD A
【例4】已知图一表示的是可逆反应CO(g)+H2(g)
C(s)+H2O(g) ΔH>0化学反应速率(v)与时间(t)的关系,图二表示的是可逆反应2NO2(g)
N2O4(g) ΔH<0的浓度(c)随时间(t)的变化情况。下列说法中正确的是
A.图一t2时改变的条件可能是升高了温度或增大了压强
B.图一t2时改变的条件是增大了反应物的浓度
C.图二t1时改变的条件可能是升高了温度或增大了压强
D.若图二t1时改变的条件增大压强,则混合气体的平均相对分子质量将减小
【分析】由图一可知,t2瞬间,曲线是断开的,因此条件的改变不可能是由某一物质的浓度引起的,t2瞬间,正、逆反应速率均加快,且v (正′)>v (逆′),可知化学平衡正向移动,因此外界条件的改变可能是升高了温度也可能是增大了压强,所以选项A正确B错误。由图二可知,t1瞬间,曲线是断开的,因此外界条件的改变不可能是温度的变化。由于此刻NO2和N2O4的浓度均增大,显然改变的条件是给体系增压。同时压强增大,平衡向正反应方向移动,N2O4的体积分数增加,因此混合气体的平均相对分子质量应增大,选项C和D均错。
[答案]A
【例5】下列说法中正确的是
A.已知t1 ℃时反应N2+3H2
2NH3 ΔH<0的速率为v,若降低温度,正反应速率
加快
B.合成氨中及时分离出氨气可减慢反应速率
C.在合成氨反应中,相同条件下在有催化剂时(a)和无催化剂时(b)速率时间图像可用下图一表示
D.在合成氨反应中,不同温度下(T2>T1)的NH3的体积分数与时间的关系图像可用图二表示
【分析】对于选项A,有同学误认为降低温度平衡正向移动,因此正反应速率加快,很显然这是错误的。事实上不论反应是放热反应还是吸热反应,温度降低,正逆反应速率均减慢。对于放热反应,由于正反应速率减小的程度小于逆反应速率减小的程度,因此平衡正向移动,A错。对于选项B,有同学误认为分离出氨气导致平衡正向移动,因此反应速率加快,显然这也是错误的。合成氨中及时分离出氨气会导致浓度减小,因此反应速率会减慢,平衡移动的原因同样是由于正反应速率减小的程度小于逆反应速率减小的程度,因此平衡正向移动,B正确。对于选项C,有同学只考虑加入催化剂缩短了达到平衡的时间,所以误认为图像正确。那么我们想一想为什么加入催化剂后能缩短达到平衡的时间呢?很显然是由于化学反应速率加快的结果,而图一中纵坐标即表示化学反应速率,从图中看出两种条件下达到化学平衡状态时速率是相等的,因此也不符合实际情况,C错。对于选项D,由于合成氨反应是放热反应,因此温度越高,NH3的产率越低,这一点图二是符合的,但考虑到温度高,化学反应速率越快,体现在图像上即在T2时达到平衡前曲线的斜率大,因此D也不符合,正确的图像如右图所示,即符合“先平先拐”的原理。
[答案]B
【例5】联氨(N2H4)及其衍生物是一类重要的火箭燃料,N2H4与N2O4反应能放出大量的热。
⑴已知:2NO2(g)
N2O4(g) H =-57.20 kJ·mol-1。一定温度下,在密闭容器中反应2NO2(g)
N2O4(g)达到平衡。其它条件不变时,下列措施能提高NO2转化率的是 。
A.减小NO2的浓度 B.降低温度 C.增加NO2的浓度 D.升高温度
⑵25 ℃时,1.00 g N2H4(l)与足量N2O4(l)完全反应生成N2(g)和H2O(l),放出19.14 kJ的热量。则反应2N2H4(l)+N2O4(l) = 3N2(g)+4H2O(l)的 H = kJ·mol-1。
⑶17 ℃、1.01×105 Pa,密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2) = 0.0300 mol·L-1、c(N2O4) = 0.0120 mol·L-1。计算反应2NO2(g)
N2O4(g)的平衡常数K。
⑷现用一定量的Cu与足量的浓HNO3反应,制得1.00 L已达到平衡的N2O4和NO2为混合气体(17 ℃、1.01×105 Pa),理论上至少需消耗Cu多少克?
【分析】⑴由于正反应是放热反应,降低温度,平衡向正反应方向移动,提高NO2的转化率。若增加NO2的浓度,可以利用“虚拟容器法”判断:将加入的NO2先建立一下与原平衡等效的平衡,再合并,相当于体积减小,压强增大,平衡向正反应移动,NO2转化率提高。
⑵1.00 g N2H4(l)与足量N2O4(l)完全反应生成N2(g)和H2O(l),放出19.14 kJ的热量,则2 mol即64 g N2H4(l)反应放出热量1224.96 kJ。
⑶根据题意知平衡时:c(N2O4) = 0.0120 mol·L-1;c(NO2) = 0.0300 mol·L-1
K === 13.3 。
⑷由⑶可知,在17 ℃、1.01×105 Pa达到平衡时,1.00 L混合气体中:
n(N2O4) = c(N2O4)×V = 0.0120 mol·L-1×1.00 L = 0.0120 mol。
n(NO2) = c(NO2)×V = 0.0300 mol·L-1×1.00 L = 0.0300 mol。
则n(NO2)总 = n(NO2)+2×n(N2O4) = 0.0540 mol
由Cu+4HNO3 = Cu(NO3)2+2NO2↑+2H2O可得m(Cu) = ×64 g·mol-1 = 1.73 g。
[答案]⑴BC ⑵-1224.96 ⑶13.3 ⑷1.73 g
【专题演练】
1. 恒温时有两个反应:① 2X(g)+Y(g)
2Z(g);② A(g)+B(g)
C(g)+D(g),以下说法中,能说明反应①已经达到化学平衡状态、但不能说明反应②已经达到化学平衡状态的是
A.反应容器中,气体物质的总质量不再变化
B.反应容器中,各物质的量不随时间变化
C.反应容器中,气体的密度不随时间改变而改变
D.反应容器中,气体的平均摩尔质量不再改变
2. 一定温度下,某压强恒定的密闭容器中发生如下可逆反应:CO(g)+H2(g)
C(s)+H2O(g);ΔH>0,以1 mol CO和2 mol H2为起始反应物,t1时达到平衡,生成0.6 mol H2O(g)。t2时改变反应条件,化学反应速率(v)与时间(t)的关系如图所示。下列叙述正确的是
A.起始时刻和达平衡后容器的体积之比为2∶1
B.平衡后若加入少量炭,平衡向逆反应方向移动
C.平衡后若加入氢气,上述反应的ΔH会增大
D.t2时改变的条件可能是升高了温度或增大了压强
3. 在一体积可变的密闭容器中,加入一定量的X、Y,发生反应mX(g)
nY(g) H = QkJ·mol-1。反应达到平衡时,Y的物质的量浓度与温度、气体体积的关系如下表所示:
1 2 3
100 1.00 0.75 0.53
200 1.20 0.90 0.63
300 1.30 1.00 0.70
下列说法正确的是
A.m>n
B.Q<0
C.温度不变,压强增大,Y的质量分数减少
D.体积不变,温度升高,平衡向逆反应方向移动
4. 25 ℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 X Y Z
初始浓度/mol·L-1 0.1 0.2 0
平衡浓度/mol·L-1 0.05 0.05 0.1
下列说法错误的是
A.反应达到平衡时,X的转化率为50%
B.反应可表示为X+3Y
2Z,其平衡常数为1600
C.增大压强使平衡向生成Z的方向移动,平衡常数增大
D.改变温度可以改变此反应的平衡常数
5. 把除去氧化膜的镁条投入到盛有稀HCl的试管中,发现氢气发生的速率变化情况如下左图所示。
⑴其中t1~t2速率变化的主要原因是__________。
⑵t2~t3速率变化的主要原因是______________。
⑶在上右图中画出生成H2的体积随时间变化的示意图。
6.Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物。现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响。
[实验设计]控制p-CP的初始浓度相同,恒定实验温度在298 K或313 K(其余实验条件见下表),设计如下对比试验。
⑴请完成以下实验设计表(表中不要留空格)。
实验编号 实验目的 T/K pH c/10-3 mol·L-1
H2O2 Fe2+
① 为以下实验作参考 298 3 6.0 0.30
② 探究温度对降解反应速率的影响
③ 298 10 6.0 0.30
[数据处理]实验测得p-CP的浓度随时间变化的关系如上图。
⑵请根据上图实验①曲线,计算降解反应在50 s~150 s内的反应速率:
v (p-CP) = mol·L-1·s-1
[解释与结论]
⑶实验①、②表明温度升高,降解反应速率增大。但温度过高时反而导致降解反应速率减小,请从Fenton法所用试剂H2O2的角度分析原因: 。
⑷实验③得出的结论是:pH等于10时, 。
[思考与交流]
⑸实验时需在不同时间从反应器中取样,并使所取样品中的反应立即停止下来。根据上图中的信息,给出一种迅速停止反应的方法:
7. 恒温时,在某密闭容器中通入2molA(g)和1molB(g),发生如下反应:2A(g)+B(g)
2C(g),压强一定时,测得在平衡时C的体积分数为0.4。
⑴与上述平衡保持同温、同压,另取4molA(g)和2molB(g)达平衡,则C的体积分数为多少?平衡时,气体的总物质的量是多少?
⑵在另一密闭容器中,通入n(A) molA(g)和n(B)molB(g),若保持平衡时C的体积分数仍为0.4,则恒有an(B)<n(A)<bn(B),问a、b各为多少?
【参考答案】
1.D
解析:由于题中所给的条件只是“恒温”,体积是否发生变化没有明确,若体积恒定,则气体的密度不能作为反应①达到平衡的标志。
2. D
解析:起始时,容器中气体的总物质的量为3 mol,达平衡后气体的总物质的量为
2.4 mol,由于在恒压条件下进行的反应,气体的物质的量之比等于容器的体积之比,为3mol:2.4mol=5:4,A错误。达平衡后加入固态的炭对平衡没有影响。加入氢气能使平衡向正反应方向移动,但不会改变反应热的大小。由图像可知,t2时正、逆反应速率均加快,平衡正向移动,可能是升高了温度也可能是缩小了容器体积(增大了压强)。
3. C
解析:本题考查化学平衡移动的有关知识。固定温度条件(比如取100 ℃)讨论气体体积变化对Y浓度的影响:当体积扩大1倍时(压强减小),若平衡不移动则c(Y) = 0.5mol·L-1,而实际上为0.75mol·L-1,大于0.5mol·L-1,这表明平衡是向右移动的,即减小压强平衡右移,这说明正反应是一个体积扩大的反应,m<n,A错、C正确。固定体积(如1体积)讨论温度变化对Y浓度的影响,知温度越高,Y浓度越大,说明升高温度平衡正移,正反应是吸热反应,B、D均错。
4. C
解析:选项中有一明显的错误,就是C选项中“平衡常数增大”,平衡常数只与温度有关,增大压强不可能使平衡常数增大。X的转化率=×100%=50%,A正确。根据表中数据(0.1-0.05):(0.2-0.05):(0.1-0) = 1:3:2可推导出该反应的化学方程式为X+3Y
2Z,根据平衡常数的定义K=,代入数据K==1000,因此只有选项C正确。
5. ⑴镁条与盐酸反应放热,温度升高使反应速率加快 ⑵盐酸浓度减小,反应速率减慢
⑶
解析:对一确定的化学反应来说,其反应速率的大小,受浓度、温度、压强、催化剂等外界条件的影响。Mg与HCl反应的整个过程中盐酸的浓度在不断降低。在t1~t2时间段,速率呈增大趋势的原因,只可能从温度升高方面找原因,在t2~t3时间段,速率呈减小趋势的原因说明盐酸降低到一定程度后,浓度对反应速率的影响成为主要影响因素。作图时要注意的是:化学反应速率越快,则在相同时间内产生氢气的量也多,由速率变化可知,产生氢气的量先快后慢最后保持不变。
6. ⑴
实验编号 实验目的 T/K pH c/10-3mol·L-1
H2O2 Fe2+
② 探究温度对降解反应速率的影响 313 3 6.0 0.30
③ 探究溶液的pH对降解反应速率的影响
⑵8×10-6 mol·L-1·s-1。 ⑶H2O2在温度过高时迅速分解。
⑷反应不能进行。
⑸在溶液中加入碱溶液,使溶液的pH大于或等于10。
解析:⑴②当探究温度对降解反应速率的影响时,应保持其它条件(溶液的pH、H2O2与Fe2+的浓度)不变,根据题中条件可知此时温度为313K,对比①③中条件可知,此时探究的条件是溶液的pH。⑵根据实验①中曲线,在50~150s内,p-CP的浓度由1.2×10-3 mol·L-1减为0.4×10-3 mol·L-1,由此可知v (p-CP)= (1.2×10-3 mol·L-1—0.4×10-3 mol·L-1)/100s=8×10-6mol·L-1·s-1。⑶题中条件(从所用试剂H2O2的角度分析)为解题指明了方向,由于H2O2不稳定,温度升高可加快H2O2的分解,浓度减小,因此不利于降解反应的进行。⑷题中只要求回答结论,而不要求原因分析,降低了难度,由图③曲线可知当溶液pH增大至10,在该条件下p-CP的浓度没有发生变化,说明降解反应没有进行,很显然可能原因是当溶液pH增大时,Fe2+被沉淀了,离子浓度减小,不利于该反应的进行。最后一问其实题⑷为题⑸的回答作了铺垫,可在溶液中加入碱溶液使溶液的pH至10以下可确保该反应立即停止下来。
7. ⑴ 0.4,5mol ⑵a=0.5, b=5
解析:⑴恒温时,密闭容器中通入2molA(g)和1molB(g) 发生反应达平衡,压强一定时C的体积分数为0.4。若与上述平衡保持同温、同压,且n (A):n (B)=2:1,则为等效平衡,C的体积分数仍为0.4。
2A(g)+B(g)
2C(g)
起始物质的量(mol) 4 2 0
平衡物质的量(mol) 4-2x 2-x 2x
则有2x/(4-2x+2-x+2x)×100%=0.4,解得x=1,n(总)= 4-2x+2-x+2x=6-x=5。
⑵ 2A(g) + B(g)
2C(g)
起始物质的量(mol) n(A) n(B) 0
平衡物质的量(mol) n(A)-2y n(B)-y 2y
据题意,解得n(A)+n(B)=6y……①,且n(A)-2y>0……②,n(B)-y>0……③。联立①②③解得:0.5n(B)<n(A)<5n(B),所以有a=0.5,b=5。www.
△S
△H
△H<0,△S>0
任何温度下反应都
能自发进行
△H>0,△S>0
高温下反应
能自发进行
△H<0,△S<0
低温下反应
能自发进行
△H>0,△S<0
任何温度下反应
都不能自发进行
v
t
0
b
a
v(正)=v(逆)≠0
图一
NH3%
T1
T2
t(s)
0
图二
v(正)
v(逆)
v′(正)
v′(逆)
v
t
t1
t2
t3
0
积
气
体
体
/L
c(Y)/mol/L
温度度
O
t(min)
V(H2)
(mL)
v
t
t1
t2
t3
21世纪教育网 -- 中国最大型、最专业的中小学教育资源门户网站。 版权所有@21世纪教育网
【专题四】化学反应速率与化学平衡的综合探究
【考情分析】
化学反应速率理论主要是解决快出产品的问题,化学平衡理论主要是解决多出产品的问题,这二个问题无论对理论研究还是化工生产都具有重大意义,因此化学反应速率和化学平衡知识一直是高考中考核的热点内容,同时新课程中由于引入了平衡常数和化学反应方向的判断,因此在新高考中涉及有关平衡常数的计算和应用性问题可能性较大,同时平衡问题在试卷中的权重也会加大。
【知识交汇】
1. 化学反应方向的判断
用焓判据或熵判据判断化学反应的方向均有局限性,因此宜用综合判据△G判断化学反应的方向,△G==△H-T△S,若△G小于0,则该条件下的反应为自发反应,若△G大于0,则该条件下的反应为非自发反应,其逆反应能自发进行,其结果可用右图表示。
2. 对于反应a A(g)+b B(s)=c C(g),条件的变化(其它条
件不发生变化)引起的化学反应速率变化见下表。
条件的改变 化学反应速率的变化 理论解释
⑴增大A的浓度 增大 增大单位体积内活化分子数,单位时间内有效碰撞次数增加
⑵升高温度 增大 增大反应物分子中活化分子百分数,使有效碰撞次数增加,同时,温度升高,分子运动加快,单位时间内碰撞次数增加
⑶恒容条件下,增加A 增大 相当于增大A的浓度,解释同(1)
⑷恒容条件下,充入与反应无关的He,总压强增大 不变 反应物浓度没有发生变化
⑸恒压条件下,充入与反应无关的He,总压强不变 减小 相当于增大容器的体积,反应物的浓度减小
⑹使用适当的催化剂 增大 降低反应活化能,使更多反应物分子成为活化分子,成千成万倍地增加了有效碰撞次数
⑺把B(s)粉碎成粉末 增大 接触面积增大
3.化学平衡移动和转化率的关系
反应实例 条件变化与平衡移动方向 达新平衡后转化率变化
2SO2 +O2
2SO3(g)ΔH<0 增大O2浓度,平衡正移 SO2 的转化率增大,O2的转化率减小
增大SO3浓度,平衡逆移 从逆反应角度看,SO3的转化率减小
升高温度,平衡逆移 SO2 、O2的转化率都减小
增大压强,平衡正移 SO2 、O2的转化率都增大
2NO2
N2O4(g) 体积不变时,充入NO2气体,平衡正移 NO2的转化率增大
体积不变时,充入N2O4气体,平衡逆移 NO2的转化率增大
2HI
H2+I2(g) 增大H2的浓度,平衡逆移 H2的转化率减小,I2的转化率增大
增大HI的浓度,平衡正移 HI的转化率不变
增大压强,平衡不移动 转化率不变
4. 等效平衡与等同平衡的异同
在分析等效平衡与等同平衡时宜抓住3个变量,即体积分数、物质的量和物质的量浓度,若是“等同平衡”三者皆相同,若是“等效平衡”则体积分数一定相同,物质的量、物质的量浓度可能会同比例发生变化。其规律总结如下:
条 件 等效条件 结 果
恒温恒容Ⅰ反应前后气体分子数不相等A(g)+B(g)
C(g)(△n(g)≠0) 投料换算成相同物质表示时量相同回归定值 两次平衡时各组分百分含量、n、c均相同完全相同等同平衡
恒温恒容Ⅱ反应前后气体分子数相等A(g)+B(g)
2C(g)(△n(g)=0) 投料换算成相同物质表示时等比例回归定比 两次平衡时各组分百分含量相同,n、c同比例变化等效平衡
恒温恒压Ⅲ所有有气体参加的可逆反应 投料换算成相同物质表示时等比例回归定比 两次平衡时各组分百分含量相同、c相同,n同比例变化等效平衡
5. 化学平衡常数
⑴不要把反应体系中纯固体、纯液体以及稀水溶液中的水的浓度写进平衡常数表达式。
例如:CaCO3(s)
CaO(s) + CO2(g) K = c(CO2)
Cr2O72- (aq) + H2O(l)
2CrO42- (aq) + 2H+(aq) K = c(CrO42-)2c(H+)/c(Cr2O72-)
但非水溶液中反应,若有水参加或生成,则此时水的浓度不可视为常数,应写进平衡常数表达式中。
例如:C2H5OH + CH3COOH
CH3COOC2H5 + H2O K =
⑵同一化学反应,化学反应方程式写法不同,其平衡常数表达式及数值亦不同。例如:
N2O4(g)
2NO2(g) K(373) = = 0.36
1/2N2O4(g)
2NO2(g) K = = = 0.60
2NO2(g)
N2O4(g) K == = 2.8
6. 外界条件对化学平衡的影响的基本图像
对于反应 N2(g) + 3H2 (g)
2NH3 (g) ΔH<0,一定条件下达到平衡,逐一改变各项条件,正逆反应速率随时间的变化情况与平衡移动方向的关系见下表:
条件的改变 c(N2)增大 c (H2)减小 c (NH3)增大 c (NH3)减小
(1)v-t图象
(2)平衡移动方向 向右 向左 向左 向右
增大压强 减小压强 升高温度 降低温度 使用催化剂
向右 向左 向左 向右 不移动
【思想方法】
【例1】已知反应①NH3+HClNH4Cl和反应②CaCO3+2HClCaCl2+CO2↑+H2O均为放热反应。下列说法错误的是
A.①的正反应低温下能自发进行 B.①的正反应高温下能自发进行
C.②的正反应不能自发进行 D.②的正反应在任何条件下都能自发进行
【分析】由于题中已知两反应均为放热反应,即焓变△H<0,因此在用△G判断时,关键是确定反应①和②中熵值的变化,由于熵是衡量体系混乱度的标志,因此可用反应前后气体的物质的量的多少衡量熵值的大小。反应①中气体的物质的量减小,因此反应①是熵减的反应,即△S<0。反应②中气体的物质的量增加,因此反应②是熵增的反应,即△S>0。由此可知反应①的正反应在低温下能自发进行,反应②的正反应在任何条件下都能自发进行。
[答案]BC
【例2】⑴在一定条件下,可逆反应达到平衡状态的本质特征是____________________,下列关系中能说明反应N2(g)+3H2(g)
2NH3(g)已经达到平衡状态的是_________。
A.3v正(N2)=v正(H2) B.v正(N2)=v逆(NH3)
C.2v正(H2)=3v逆(NH3) D.v正(N2)=3v逆(H2)
⑵在一定温度下的恒容密闭容器中,可逆反应达到平衡状态时,一些宏观物理量恒定不变:a各物质的浓度不变,b平衡混合物中各组份的物质的量分数或质量分数不变,c容器内气体压强不变,d容器内气体密度不变,e容器内气体颜色不变。
①能说明反应N2(g)+3H2(g)
2NH3(g)达到平衡状态的有_____________;
②能说明反应H2(g)+I2(g)
2HI(g)达到平衡状态的有________________;
③能说明反应2NO2(g)
N2O4(g)达到平衡状态的有__________________;
④能说明反应C(s)+H2O(g)
CO(g)+H2(g)达到平衡状态的有_________。
【分析】⑴中选项中给出的是用绝对标志判定化学平衡状态,选项C正确。⑵中判断时首先要注意到本题中反应的条件是恒温恒容,其次要注意化学反应方程式中是否有固体物质存在。反应①在反应过程中气体的质量不变,因此在恒容状态下不能用密度判断反应是否达到平衡状态,由于反应物和生成物均为无色气体,因此也不能用颜色来判定。反应②是一个气体体积不变的反应,反应过程中气体的质量不变,物质的量也不变,所以不能用压强和密度判定反应是否达平衡状态。反应③在反应过程中气体的质量保持不变,因此同样不能用密度来判定。反应④中反应过程中气体的质量和气体的物质的量均发生改变,因此a、b、c、d均可用来判定反应是否达平衡状态,由于反应物和生成物均为无色气体,因此不能用颜色来判定。
[答案]⑴正反应速率与逆反应速率相等 C
⑵ ① a b c ② a b e ③ a b c e ④ a b c d
【例3】在体积恒定的密闭容器中,充入3 molA和1 molB发生反应3A(g)+B(g)
xC(g),达到平衡后,C在平衡混合气中的体积分数为φ。若维持温度不变,按1.2 molA、0.4 molB、0.6 molC为起始物质。
⑴若达到平衡后C的体积分数仍为φ,则x值是_______;
⑵若达到平衡后压强不变,C的体积分数仍为φ,则x值是____________。
A.1 B.2 C.3 D.4
【分析】第⑴问只要满足φ相等,属于等效平衡,满足题中条件应用回归定比法,x可等于1也可等于4。第⑵不仅要满足达到平衡时φ相等且压强不变,压强不变即物质的量不变,因此属于“等同平衡”,必须用回归定值法,即1.2 mol+3mol,0.4 mol+1mol,解得x1。
[答案]AD A
【例4】已知图一表示的是可逆反应CO(g)+H2(g)
C(s)+H2O(g) ΔH>0化学反应速率(v)与时间(t)的关系,图二表示的是可逆反应2NO2(g)
N2O4(g) ΔH<0的浓度(c)随时间(t)的变化情况。下列说法中正确的是
A.图一t2时改变的条件可能是升高了温度或增大了压强
B.图一t2时改变的条件是增大了反应物的浓度
C.图二t1时改变的条件可能是升高了温度或增大了压强
D.若图二t1时改变的条件增大压强,则混合气体的平均相对分子质量将减小
【分析】由图一可知,t2瞬间,曲线是断开的,因此条件的改变不可能是由某一物质的浓度引起的,t2瞬间,正、逆反应速率均加快,且v (正′)>v (逆′),可知化学平衡正向移动,因此外界条件的改变可能是升高了温度也可能是增大了压强,所以选项A正确B错误。由图二可知,t1瞬间,曲线是断开的,因此外界条件的改变不可能是温度的变化。由于此刻NO2和N2O4的浓度均增大,显然改变的条件是给体系增压。同时压强增大,平衡向正反应方向移动,N2O4的体积分数增加,因此混合气体的平均相对分子质量应增大,选项C和D均错。
[答案]A
【例5】下列说法中正确的是
A.已知t1 ℃时反应N2+3H2
2NH3 ΔH<0的速率为v,若降低温度,正反应速率
加快
B.合成氨中及时分离出氨气可减慢反应速率
C.在合成氨反应中,相同条件下在有催化剂时(a)和无催化剂时(b)速率时间图像可用下图一表示
D.在合成氨反应中,不同温度下(T2>T1)的NH3的体积分数与时间的关系图像可用图二表示
【分析】对于选项A,有同学误认为降低温度平衡正向移动,因此正反应速率加快,很显然这是错误的。事实上不论反应是放热反应还是吸热反应,温度降低,正逆反应速率均减慢。对于放热反应,由于正反应速率减小的程度小于逆反应速率减小的程度,因此平衡正向移动,A错。对于选项B,有同学误认为分离出氨气导致平衡正向移动,因此反应速率加快,显然这也是错误的。合成氨中及时分离出氨气会导致浓度减小,因此反应速率会减慢,平衡移动的原因同样是由于正反应速率减小的程度小于逆反应速率减小的程度,因此平衡正向移动,B正确。对于选项C,有同学只考虑加入催化剂缩短了达到平衡的时间,所以误认为图像正确。那么我们想一想为什么加入催化剂后能缩短达到平衡的时间呢?很显然是由于化学反应速率加快的结果,而图一中纵坐标即表示化学反应速率,从图中看出两种条件下达到化学平衡状态时速率是相等的,因此也不符合实际情况,C错。对于选项D,由于合成氨反应是放热反应,因此温度越高,NH3的产率越低,这一点图二是符合的,但考虑到温度高,化学反应速率越快,体现在图像上即在T2时达到平衡前曲线的斜率大,因此D也不符合,正确的图像如右图所示,即符合“先平先拐”的原理。
[答案]B
【例5】联氨(N2H4)及其衍生物是一类重要的火箭燃料,N2H4与N2O4反应能放出大量的热。
⑴已知:2NO2(g)
N2O4(g) H =-57.20 kJ·mol-1。一定温度下,在密闭容器中反应2NO2(g)
N2O4(g)达到平衡。其它条件不变时,下列措施能提高NO2转化率的是 。
A.减小NO2的浓度 B.降低温度 C.增加NO2的浓度 D.升高温度
⑵25 ℃时,1.00 g N2H4(l)与足量N2O4(l)完全反应生成N2(g)和H2O(l),放出19.14 kJ的热量。则反应2N2H4(l)+N2O4(l) = 3N2(g)+4H2O(l)的 H = kJ·mol-1。
⑶17 ℃、1.01×105 Pa,密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2) = 0.0300 mol·L-1、c(N2O4) = 0.0120 mol·L-1。计算反应2NO2(g)
N2O4(g)的平衡常数K。
⑷现用一定量的Cu与足量的浓HNO3反应,制得1.00 L已达到平衡的N2O4和NO2为混合气体(17 ℃、1.01×105 Pa),理论上至少需消耗Cu多少克?
【分析】⑴由于正反应是放热反应,降低温度,平衡向正反应方向移动,提高NO2的转化率。若增加NO2的浓度,可以利用“虚拟容器法”判断:将加入的NO2先建立一下与原平衡等效的平衡,再合并,相当于体积减小,压强增大,平衡向正反应移动,NO2转化率提高。
⑵1.00 g N2H4(l)与足量N2O4(l)完全反应生成N2(g)和H2O(l),放出19.14 kJ的热量,则2 mol即64 g N2H4(l)反应放出热量1224.96 kJ。
⑶根据题意知平衡时:c(N2O4) = 0.0120 mol·L-1;c(NO2) = 0.0300 mol·L-1
K === 13.3 。
⑷由⑶可知,在17 ℃、1.01×105 Pa达到平衡时,1.00 L混合气体中:
n(N2O4) = c(N2O4)×V = 0.0120 mol·L-1×1.00 L = 0.0120 mol。
n(NO2) = c(NO2)×V = 0.0300 mol·L-1×1.00 L = 0.0300 mol。
则n(NO2)总 = n(NO2)+2×n(N2O4) = 0.0540 mol
由Cu+4HNO3 = Cu(NO3)2+2NO2↑+2H2O可得m(Cu) = ×64 g·mol-1 = 1.73 g。
[答案]⑴BC ⑵-1224.96 ⑶13.3 ⑷1.73 g
【专题演练】
1. 恒温时有两个反应:① 2X(g)+Y(g)
2Z(g);② A(g)+B(g)
C(g)+D(g),以下说法中,能说明反应①已经达到化学平衡状态、但不能说明反应②已经达到化学平衡状态的是
A.反应容器中,气体物质的总质量不再变化
B.反应容器中,各物质的量不随时间变化
C.反应容器中,气体的密度不随时间改变而改变
D.反应容器中,气体的平均摩尔质量不再改变
2. 一定温度下,某压强恒定的密闭容器中发生如下可逆反应:CO(g)+H2(g)
C(s)+H2O(g);ΔH>0,以1 mol CO和2 mol H2为起始反应物,t1时达到平衡,生成0.6 mol H2O(g)。t2时改变反应条件,化学反应速率(v)与时间(t)的关系如图所示。下列叙述正确的是
A.起始时刻和达平衡后容器的体积之比为2∶1
B.平衡后若加入少量炭,平衡向逆反应方向移动
C.平衡后若加入氢气,上述反应的ΔH会增大
D.t2时改变的条件可能是升高了温度或增大了压强
3. 在一体积可变的密闭容器中,加入一定量的X、Y,发生反应mX(g)
nY(g) H = QkJ·mol-1。反应达到平衡时,Y的物质的量浓度与温度、气体体积的关系如下表所示:
1 2 3
100 1.00 0.75 0.53
200 1.20 0.90 0.63
300 1.30 1.00 0.70
下列说法正确的是
A.m>n
B.Q<0
C.温度不变,压强增大,Y的质量分数减少
D.体积不变,温度升高,平衡向逆反应方向移动
4. 25 ℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 X Y Z
初始浓度/mol·L-1 0.1 0.2 0
平衡浓度/mol·L-1 0.05 0.05 0.1
下列说法错误的是
A.反应达到平衡时,X的转化率为50%
B.反应可表示为X+3Y
2Z,其平衡常数为1600
C.增大压强使平衡向生成Z的方向移动,平衡常数增大
D.改变温度可以改变此反应的平衡常数
5. 把除去氧化膜的镁条投入到盛有稀HCl的试管中,发现氢气发生的速率变化情况如下左图所示。
⑴其中t1~t2速率变化的主要原因是__________。
⑵t2~t3速率变化的主要原因是______________。
⑶在上右图中画出生成H2的体积随时间变化的示意图。
6.Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物。现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响。
[实验设计]控制p-CP的初始浓度相同,恒定实验温度在298 K或313 K(其余实验条件见下表),设计如下对比试验。
⑴请完成以下实验设计表(表中不要留空格)。
实验编号 实验目的 T/K pH c/10-3 mol·L-1
H2O2 Fe2+
① 为以下实验作参考 298 3 6.0 0.30
② 探究温度对降解反应速率的影响
③ 298 10 6.0 0.30
[数据处理]实验测得p-CP的浓度随时间变化的关系如上图。
⑵请根据上图实验①曲线,计算降解反应在50 s~150 s内的反应速率:
v (p-CP) = mol·L-1·s-1
[解释与结论]
⑶实验①、②表明温度升高,降解反应速率增大。但温度过高时反而导致降解反应速率减小,请从Fenton法所用试剂H2O2的角度分析原因: 。
⑷实验③得出的结论是:pH等于10时, 。
[思考与交流]
⑸实验时需在不同时间从反应器中取样,并使所取样品中的反应立即停止下来。根据上图中的信息,给出一种迅速停止反应的方法:
7. 恒温时,在某密闭容器中通入2molA(g)和1molB(g),发生如下反应:2A(g)+B(g)
2C(g),压强一定时,测得在平衡时C的体积分数为0.4。
⑴与上述平衡保持同温、同压,另取4molA(g)和2molB(g)达平衡,则C的体积分数为多少?平衡时,气体的总物质的量是多少?
⑵在另一密闭容器中,通入n(A) molA(g)和n(B)molB(g),若保持平衡时C的体积分数仍为0.4,则恒有an(B)<n(A)<bn(B),问a、b各为多少?
【参考答案】
1.D
解析:由于题中所给的条件只是“恒温”,体积是否发生变化没有明确,若体积恒定,则气体的密度不能作为反应①达到平衡的标志。
2. D
解析:起始时,容器中气体的总物质的量为3 mol,达平衡后气体的总物质的量为
2.4 mol,由于在恒压条件下进行的反应,气体的物质的量之比等于容器的体积之比,为3mol:2.4mol=5:4,A错误。达平衡后加入固态的炭对平衡没有影响。加入氢气能使平衡向正反应方向移动,但不会改变反应热的大小。由图像可知,t2时正、逆反应速率均加快,平衡正向移动,可能是升高了温度也可能是缩小了容器体积(增大了压强)。
3. C
解析:本题考查化学平衡移动的有关知识。固定温度条件(比如取100 ℃)讨论气体体积变化对Y浓度的影响:当体积扩大1倍时(压强减小),若平衡不移动则c(Y) = 0.5mol·L-1,而实际上为0.75mol·L-1,大于0.5mol·L-1,这表明平衡是向右移动的,即减小压强平衡右移,这说明正反应是一个体积扩大的反应,m<n,A错、C正确。固定体积(如1体积)讨论温度变化对Y浓度的影响,知温度越高,Y浓度越大,说明升高温度平衡正移,正反应是吸热反应,B、D均错。
4. C
解析:选项中有一明显的错误,就是C选项中“平衡常数增大”,平衡常数只与温度有关,增大压强不可能使平衡常数增大。X的转化率=×100%=50%,A正确。根据表中数据(0.1-0.05):(0.2-0.05):(0.1-0) = 1:3:2可推导出该反应的化学方程式为X+3Y
2Z,根据平衡常数的定义K=,代入数据K==1000,因此只有选项C正确。
5. ⑴镁条与盐酸反应放热,温度升高使反应速率加快 ⑵盐酸浓度减小,反应速率减慢
⑶
解析:对一确定的化学反应来说,其反应速率的大小,受浓度、温度、压强、催化剂等外界条件的影响。Mg与HCl反应的整个过程中盐酸的浓度在不断降低。在t1~t2时间段,速率呈增大趋势的原因,只可能从温度升高方面找原因,在t2~t3时间段,速率呈减小趋势的原因说明盐酸降低到一定程度后,浓度对反应速率的影响成为主要影响因素。作图时要注意的是:化学反应速率越快,则在相同时间内产生氢气的量也多,由速率变化可知,产生氢气的量先快后慢最后保持不变。
6. ⑴
实验编号 实验目的 T/K pH c/10-3mol·L-1
H2O2 Fe2+
② 探究温度对降解反应速率的影响 313 3 6.0 0.30
③ 探究溶液的pH对降解反应速率的影响
⑵8×10-6 mol·L-1·s-1。 ⑶H2O2在温度过高时迅速分解。
⑷反应不能进行。
⑸在溶液中加入碱溶液,使溶液的pH大于或等于10。
解析:⑴②当探究温度对降解反应速率的影响时,应保持其它条件(溶液的pH、H2O2与Fe2+的浓度)不变,根据题中条件可知此时温度为313K,对比①③中条件可知,此时探究的条件是溶液的pH。⑵根据实验①中曲线,在50~150s内,p-CP的浓度由1.2×10-3 mol·L-1减为0.4×10-3 mol·L-1,由此可知v (p-CP)= (1.2×10-3 mol·L-1—0.4×10-3 mol·L-1)/100s=8×10-6mol·L-1·s-1。⑶题中条件(从所用试剂H2O2的角度分析)为解题指明了方向,由于H2O2不稳定,温度升高可加快H2O2的分解,浓度减小,因此不利于降解反应的进行。⑷题中只要求回答结论,而不要求原因分析,降低了难度,由图③曲线可知当溶液pH增大至10,在该条件下p-CP的浓度没有发生变化,说明降解反应没有进行,很显然可能原因是当溶液pH增大时,Fe2+被沉淀了,离子浓度减小,不利于该反应的进行。最后一问其实题⑷为题⑸的回答作了铺垫,可在溶液中加入碱溶液使溶液的pH至10以下可确保该反应立即停止下来。
7. ⑴ 0.4,5mol ⑵a=0.5, b=5
解析:⑴恒温时,密闭容器中通入2molA(g)和1molB(g) 发生反应达平衡,压强一定时C的体积分数为0.4。若与上述平衡保持同温、同压,且n (A):n (B)=2:1,则为等效平衡,C的体积分数仍为0.4。
2A(g)+B(g)
2C(g)
起始物质的量(mol) 4 2 0
平衡物质的量(mol) 4-2x 2-x 2x
则有2x/(4-2x+2-x+2x)×100%=0.4,解得x=1,n(总)= 4-2x+2-x+2x=6-x=5。
⑵ 2A(g) + B(g)
2C(g)
起始物质的量(mol) n(A) n(B) 0
平衡物质的量(mol) n(A)-2y n(B)-y 2y
据题意,解得n(A)+n(B)=6y……①,且n(A)-2y>0……②,n(B)-y>0……③。联立①②③解得:0.5n(B)<n(A)<5n(B),所以有a=0.5,b=5。www.
△S
△H
△H<0,△S>0
任何温度下反应都
能自发进行
△H>0,△S>0
高温下反应
能自发进行
△H<0,△S<0
低温下反应
能自发进行
△H>0,△S<0
任何温度下反应
都不能自发进行
v
t
0
b
a
v(正)=v(逆)≠0
图一
NH3%
T1
T2
t(s)
0
图二
v(正)
v(逆)
v′(正)
v′(逆)
v
t
t1
t2
t3
0
积
气
体
体
/L
c(Y)/mol/L
温度度
O
t(min)
V(H2)
(mL)
v
t
t1
t2
t3
21世纪教育网 -- 中国最大型、最专业的中小学教育资源门户网站。 版权所有@21世纪教育网
同课章节目录
