从铝土矿到铝合金复习课
图片预览







文档简介
课件21张PPT。从铝土矿到铝合金思考: 如何设计可能多的方法区分相同大小的镁片和铝片?一、铝铝的物理性质:铝的化学性质特点:铝在自然界的存在形式:工业上如何制金属铝:较强的还原性化合态电解熔融氧化铝铝的原子结构示意图:练习1:
等质量的铝分别与足量的盐酸、NaOH溶液反应,产生H2的量之比是多少?参加反应的HCl、NaOH的物质的量之比为多少?练习2:
为了除去镁粉中的少量铝粉,可选用的试剂是 ( )
A.氢氧化钠溶液
B.稀盐酸
C.氨水
D.浓硝酸A练习3:
用铝箔包住0.1mol金属钠,用针扎出一些小孔,放入水中,完全反应,用排水集气法收集产生的气体,则收集到的气体在标准状况下是 ( )
A.O2和H2的混合气体 B.1.12L的H2
C.大于1.12L的H2 D.小于1.12L的H2C练习4:
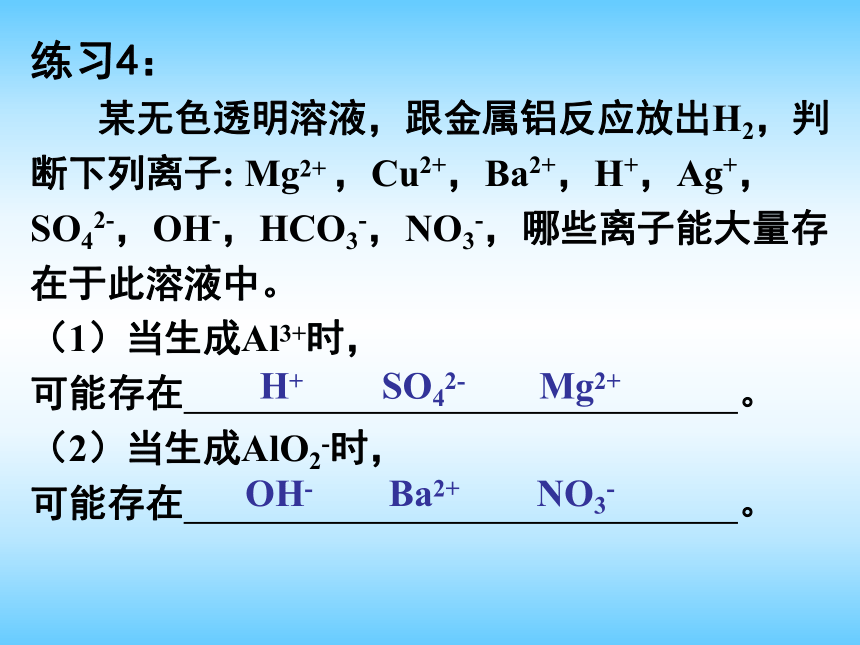
某无色透明溶液,跟金属铝反应放出H2,判断下列离子: Mg2+ ,Cu2+,Ba2+,H+,Ag+,SO42-,OH-,HCO3-,NO3-,哪些离子能大量存在于此溶液中。
(1)当生成Al3+时,
可能存在 。
(2)当生成AlO2-时,
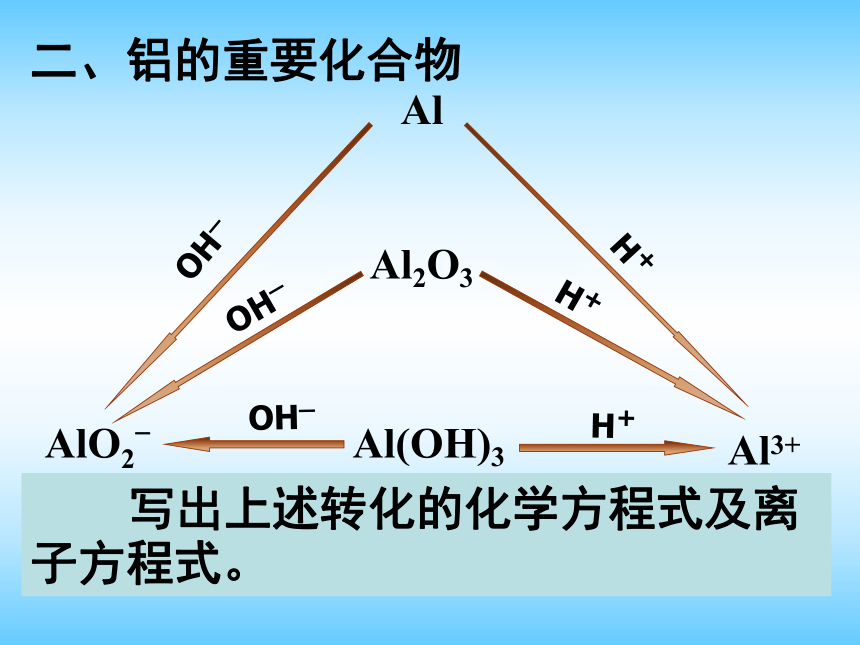
可能存在 。H+Mg2+SO42-OH-Ba2+NO3-AlO2?AlAl2O3OH_H+OH_H+OH_H+二、铝的重要化合物Al(OH)3Al3+ 写出上述转化的化学方程式及离子方程式。 写出实验室由AlCl3制备氢氧化铝[Al(OH)3]的化学方程式和离子方程式。制备铝的工艺流程: NaOHNaAlO2NaHCO3Al(OH)3Al2O3CO21、通入CO2酸化的作用是什么?能用盐酸代替CO2酸化吗?
2、上述制取过程中有无涉及氧化还原反应,如有请用双线桥法分析该反应。
3、还有没有别的方案可以从铝土矿中制取出单质铝?思考: 1、现有两瓶无色透明的溶液分别是AlCl3溶液和MgCl2溶液,请问如何鉴别。 2、 如果有AlCl3和MgCl2的固体混合物,应如何分离提纯?思考:
3、下列图中,横坐标表示加入物质的量,纵坐标表示生成沉淀的量,从中选择相应序号填入表中。BA三、Al3+ 、 AlO2? 、 Al(OH)3的相互转化AlO2?OH_H+H+OH_OH_Al(OH)3Al3+H+练习5:
向30mL 、1mol/L的AlCl3溶液中逐渐加入浓度为4mol/L的NaOH溶液,若产生0.78g白色沉淀,则加入的NaOH溶液的体积可能是多少。 [Al(OH)3摩尔质量78g/mol]
铝及其重要化合物的相互转化1、和铝粉可以发生铝热反应的是 ( )
A.氧化钠 B.镁粉 C.氧化钨 D.硫粉2、在MgO中混有少量的Al2O3杂质,欲将杂质除去可选用的试剂是 ( )
A.稀硫酸 B.氨水
C.稀盐酸 D.氢氧化钠溶液CD3、现有MgCl2、AlCl3、CuCl2、FeCl3、NH4Cl五种溶液,如果只用一种试剂把它们鉴别开来,应选用的试剂是 ( )
A.氨水 B.AgNO3
C.NaOH溶液 D.NaCl溶液C4、在一定条件下可实现下图所示物质之间的转化,请填写以下空白:
(1)孔雀石的主要成分是Cu2(OH)2CO3(碱式碳酸铜),受热易分解。图中的F是 。
(2)写出明矾溶液与过量NaOH溶液反应的离子方程式: 。
(3)图中所得G和D都为固体,混和后在高温下可发生反应,写出该反应的化学方程式: 。
(4)每生成1mol D,同时生成 mol E。5、在MgCl2和AlCl3的混和溶液中,逐滴加入NaOH溶液直至过量,经测定,加入NaOH的物质的量和所得沉淀的物质的量的关系如下图所示,则:
(1)图中C点表示当加入 mol NaOH时,Al3+已经 ,Mg2+已经 。
(2)图中线段OA:AB= 。
等质量的铝分别与足量的盐酸、NaOH溶液反应,产生H2的量之比是多少?参加反应的HCl、NaOH的物质的量之比为多少?练习2:
为了除去镁粉中的少量铝粉,可选用的试剂是 ( )
A.氢氧化钠溶液
B.稀盐酸
C.氨水
D.浓硝酸A练习3:
用铝箔包住0.1mol金属钠,用针扎出一些小孔,放入水中,完全反应,用排水集气法收集产生的气体,则收集到的气体在标准状况下是 ( )
A.O2和H2的混合气体 B.1.12L的H2
C.大于1.12L的H2 D.小于1.12L的H2C练习4:
某无色透明溶液,跟金属铝反应放出H2,判断下列离子: Mg2+ ,Cu2+,Ba2+,H+,Ag+,SO42-,OH-,HCO3-,NO3-,哪些离子能大量存在于此溶液中。
(1)当生成Al3+时,
可能存在 。
(2)当生成AlO2-时,
可能存在 。H+Mg2+SO42-OH-Ba2+NO3-AlO2?AlAl2O3OH_H+OH_H+OH_H+二、铝的重要化合物Al(OH)3Al3+ 写出上述转化的化学方程式及离子方程式。 写出实验室由AlCl3制备氢氧化铝[Al(OH)3]的化学方程式和离子方程式。制备铝的工艺流程: NaOHNaAlO2NaHCO3Al(OH)3Al2O3CO21、通入CO2酸化的作用是什么?能用盐酸代替CO2酸化吗?
2、上述制取过程中有无涉及氧化还原反应,如有请用双线桥法分析该反应。
3、还有没有别的方案可以从铝土矿中制取出单质铝?思考: 1、现有两瓶无色透明的溶液分别是AlCl3溶液和MgCl2溶液,请问如何鉴别。 2、 如果有AlCl3和MgCl2的固体混合物,应如何分离提纯?思考:
3、下列图中,横坐标表示加入物质的量,纵坐标表示生成沉淀的量,从中选择相应序号填入表中。BA三、Al3+ 、 AlO2? 、 Al(OH)3的相互转化AlO2?OH_H+H+OH_OH_Al(OH)3Al3+H+练习5:
向30mL 、1mol/L的AlCl3溶液中逐渐加入浓度为4mol/L的NaOH溶液,若产生0.78g白色沉淀,则加入的NaOH溶液的体积可能是多少。 [Al(OH)3摩尔质量78g/mol]
铝及其重要化合物的相互转化1、和铝粉可以发生铝热反应的是 ( )
A.氧化钠 B.镁粉 C.氧化钨 D.硫粉2、在MgO中混有少量的Al2O3杂质,欲将杂质除去可选用的试剂是 ( )
A.稀硫酸 B.氨水
C.稀盐酸 D.氢氧化钠溶液CD3、现有MgCl2、AlCl3、CuCl2、FeCl3、NH4Cl五种溶液,如果只用一种试剂把它们鉴别开来,应选用的试剂是 ( )
A.氨水 B.AgNO3
C.NaOH溶液 D.NaCl溶液C4、在一定条件下可实现下图所示物质之间的转化,请填写以下空白:
(1)孔雀石的主要成分是Cu2(OH)2CO3(碱式碳酸铜),受热易分解。图中的F是 。
(2)写出明矾溶液与过量NaOH溶液反应的离子方程式: 。
(3)图中所得G和D都为固体,混和后在高温下可发生反应,写出该反应的化学方程式: 。
(4)每生成1mol D,同时生成 mol E。5、在MgCl2和AlCl3的混和溶液中,逐滴加入NaOH溶液直至过量,经测定,加入NaOH的物质的量和所得沉淀的物质的量的关系如下图所示,则:
(1)图中C点表示当加入 mol NaOH时,Al3+已经 ,Mg2+已经 。
(2)图中线段OA:AB= 。
