2010年高考化学复习漫谈
图片预览







文档简介
课件56张PPT。谢幕前的绝唱
2010年高考化学复习漫谈南昌三中 胡建平 2010 . 3一、化学试题中的基本理论
二、回归课本,怎么看?何时看?
三、新课标习题的利与弊
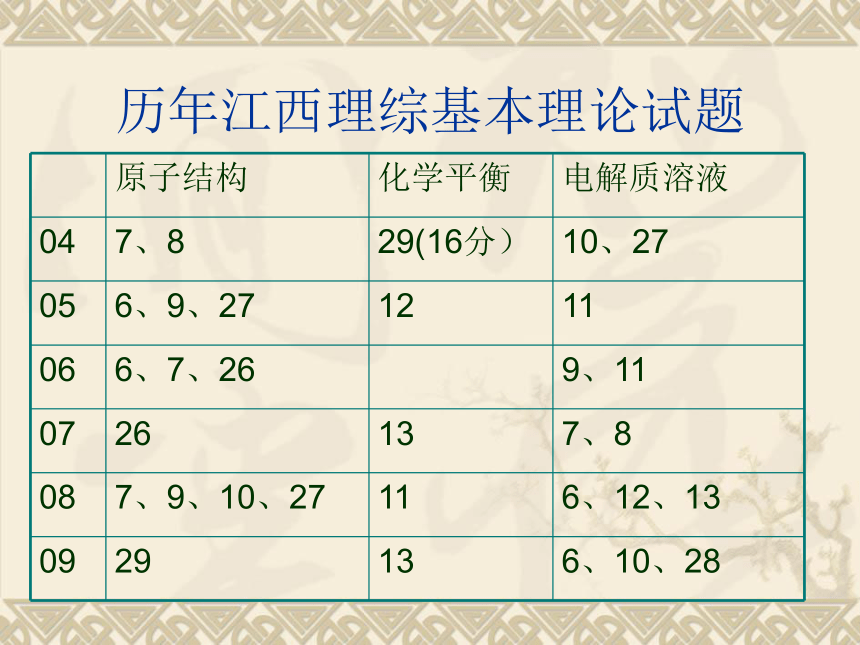
四、新课标超出原人教版教材题例一、化学试题中的基本理论 历年江西理综基本理论试题
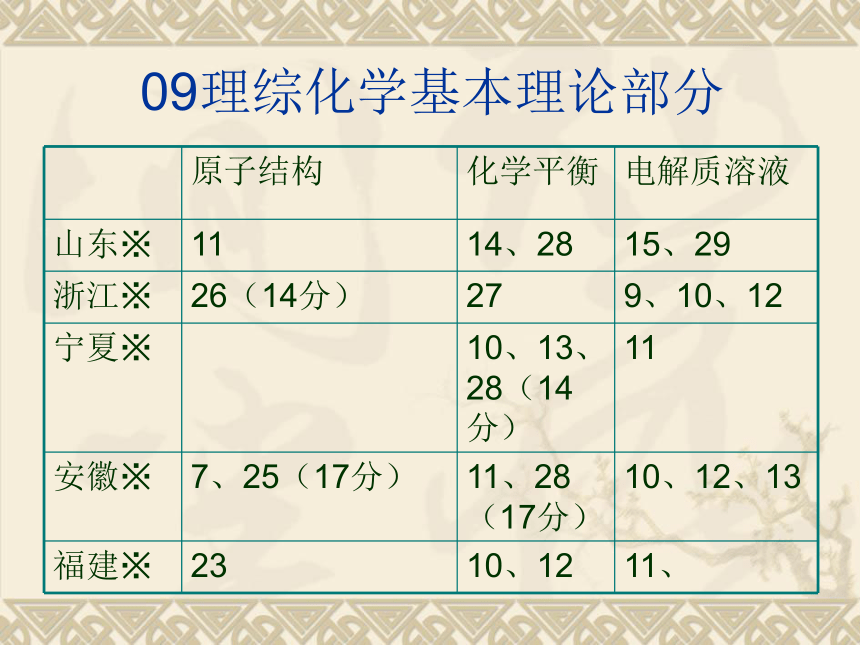
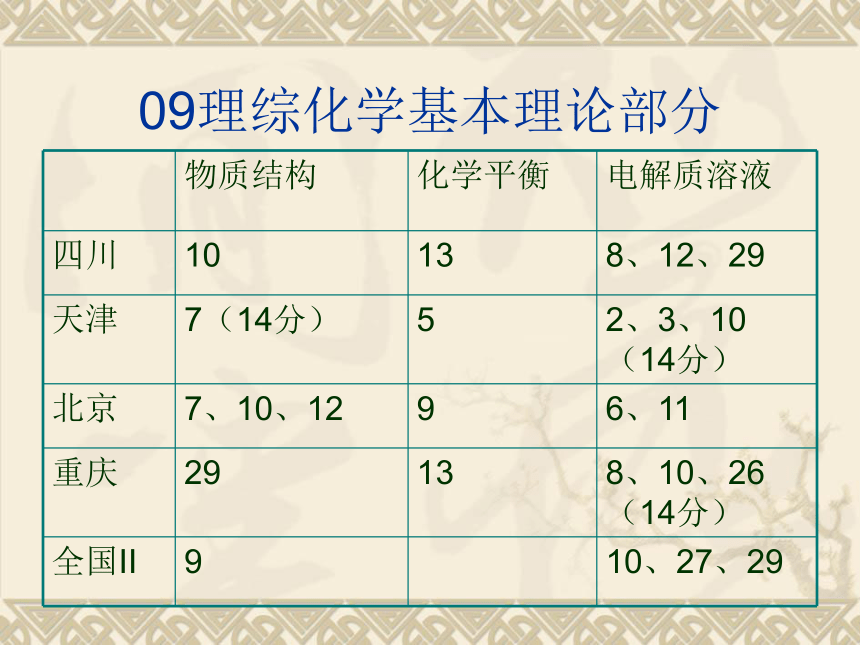
09理综化学基本理论部分
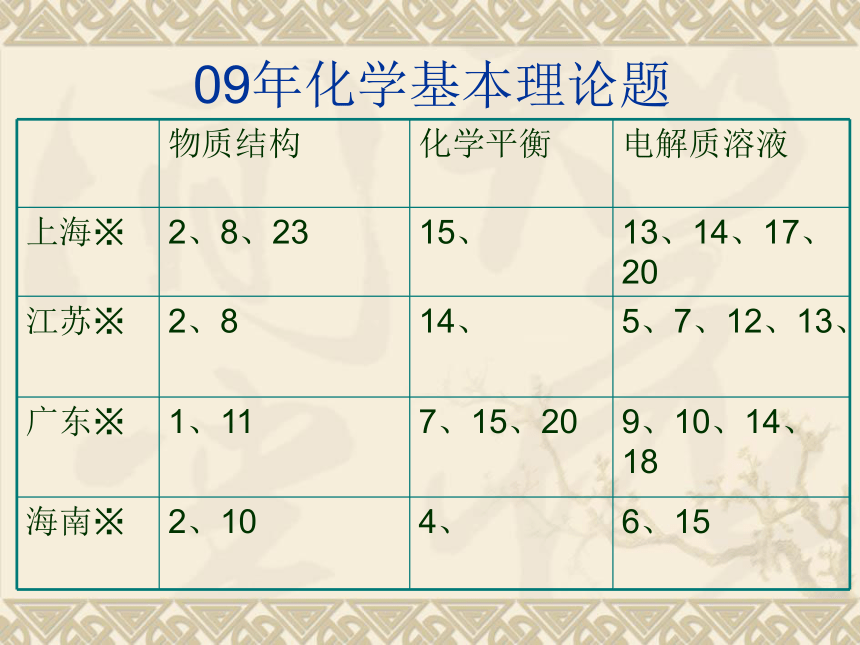
09年化学基本理论题
物质结构试题答案特点及字数
基本理论试题中的计算
第二轮复习----专题小型化历年江西理综基本理论试题09理综化学基本理论部分09理综化学基本理论部分09年化学基本理论题物质结构试题答案特点化学式(分子式、电子式、结构式、原子结构示意图)
化学方程式或离子方程式
空间构型、晶体类型
稳定性、熔沸点排序
09年物质结构题有51个中文字和16个分子式(化学式)
09年电化学约100个字,13个化学式和数据。
08年物质结构题只有8个化学式
07年物质结构题只有9个化学式
11、(09)已知周期表中,元素Q、R、W、Y与元素X相邻。Y的最高化合价氧化物的水化物是强酸。回答下列问题: (1)W与Q可以形成一种高温结构陶瓷材料。W的氯化物分子呈正四面体结构,W的氧化物的晶体类型是原子晶体; (2)Q的具有相同化合价且可以相互转变的氧化物是?NO2和N2O4 ; (3)R和Y形成的二元化合物中,R呈现最高化合价的化合物的化学式是?As2S5 ;?????? (4)这5个元素的氢化物分子中,①立体结构类型相同的氢化物的沸点从高到低排列次序是(填化学式)?NH3> AsH3 > PH3,其原因是?因为前者中含有氢键,后两者构型相同,分子间作用力不同; ②电子总数相同的氢化物的化学式和立体结构分别是??②电子数相同的有SiH4、PH3和H2S结构分别为正四面体,三角锥和V形. (5)W和Q所形成的结构陶瓷材料的一种合成方法如下:W的氯化物与Q的氢化物加热反应,生成化合物W(QH2)4和HCl气体;W(QH2)4在高温下分解生成Q的氢化物和该陶瓷材料。上述相关反应的化学方程式(各物质用化学式表示)是SiCl4 + 4NH3 = Si(NH2)4 + 4HCl,3Si(NH2)4 = 8NH3 + Si3N4 。 (09)下图(图略)所示装置中,甲、乙、丙三个烧杯依次分别盛放100g5.00%的NaOH溶液、足量的CuSO4溶液和l00g10.00%的K2SO4溶液.电极均为石墨电极。
(1)接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加。据此回答问题: ①电源的N端为正 极; ②电极b上发生的电极反应为???4OH-?-4e-= 2H2O + O2↑ ; ③列式计算电极b上生成的气体在标准状况下的体积:2.8? L ??; ④电极c的质量变化是???16 g ???⑤电解前后各溶液的酸、碱性大小是否发生变化,简述其原因: 甲溶液??碱性增大,因为电解后,水量减少溶液是NaOH浓度增大 ; 乙溶液??酸性增大,因为阳极上OH-生成O2,溶液中H+离子浓度增加 ???; 丙溶液??酸碱性大小没有变化,因为K2SO4是强酸强碱盐,浓度增加不影响溶液的酸碱性 ??;
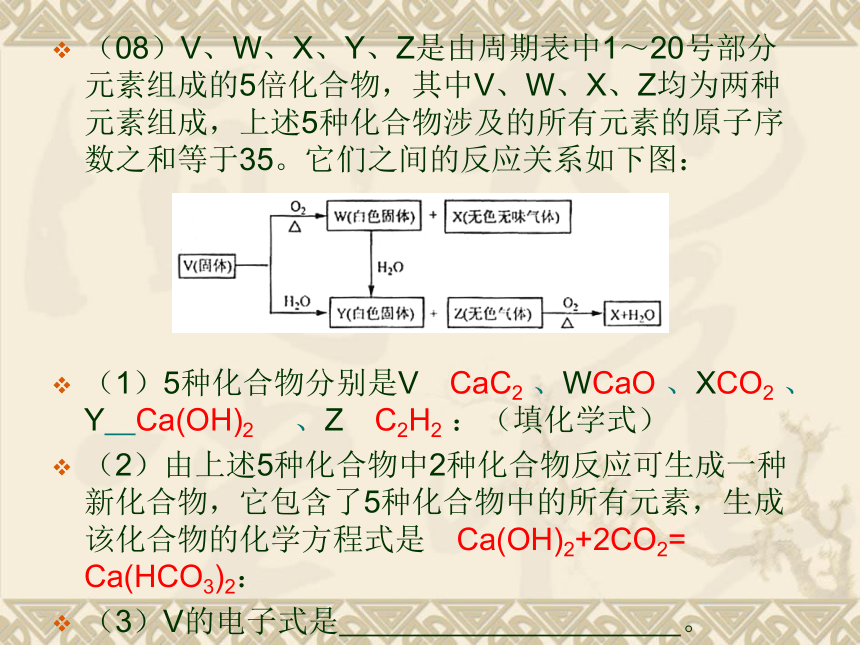
(2)如果电解过程中铜全部析出.此时电解能否继续进行,为什么? ????能继续进行,因为CuSO4溶液已转变为H2SO4溶液,反应也就变为水的电解反应。(08)V、W、X、Y、Z是由周期表中1~20号部分元素组成的5倍化合物,其中V、W、X、Z均为两种元素组成,上述5种化合物涉及的所有元素的原子序数之和等于35。它们之间的反应关系如下图:
(1)5种化合物分别是V CaC2 、WCaO 、XCO2 、Y Ca(OH)2 、Z C2H2 :(填化学式)
(2)由上述5种化合物中2种化合物反应可生成一种新化合物,它包含了5种化合物中的所有元素,生成该化合物的化学方程式是 Ca(OH)2+2CO2= Ca(HCO3)2:
(3)V的电子式是 。(07) W、X、Y和Z都是周期表中前20号元素,已知:
①W的阳离子Y的阴离子具有相同的核外电子排布,且能形成组成为WY的化合物;
②Y和Z属同族元素,它们能形成两种常见化合物;
③X和Z属同一周期元素。它们能形成两种气态化合物
④W和X能形成组成为WX2的化合物;
⑤X和Y不在同一周期,它们能形成组成为XY2的化合物。
请回答:
(1)W元素是Ca;Z元素是O。
(2)化合物WY和WX2的化学式分别是CaS和CaC2。
(3)Y和Z形成的两种常见化合物的分子式是SO2 和SO3。
(4)写出X和Z形成的一种气态化合物跟WZ反应的化学方程式:CO2+CaO=CaCO3
基本理论试题中的计算例1(08)实验室可由软锰矿(主要成分为MnO2)制备KMnO4,方法如下:软锰矿与过量固体KOH和KClO3在高温下反应,生成锰酸钾(K2MnO4)和KCl:用水溶解,滤去残渣,滤液酸化后,K2MnO4。请回答:
(3)若用2.5g软锰矿(含MnO280%)进行上述实验,计算KMnO4的理论产量;
(5)上述制得的KMnO4产品0.165g,恰好与0.335gNa2C2O4反应完全,计算该KMnO4的纯度。(3)3MnO2——————2KMnO4
3×87 2×158
2.5g×80% m(KMnO4)
m(KMnO4)= 2×158×2.5g×80% /(3×87) =2.4g。
(5)2KMnO4———— 5Na2C2O4
2×158 5×134
m(KMnO4) 0.335g
m(KMnO4)= 2×158×0.335g/(5×134)=0.158g
KMnO4纯度=(0.158g/0.165g)×100%=95.8%.例2(08宁夏)已知化合物A中各元素的质量分数分别为C 37.5%,H 4.2%和O 58.3%。请填空
(1)0.01molA在空气中充分燃烧需消耗氧气1.01L(标准状况),则A的分子式是 ;
(2)实验表明:A不能发生银镜反应。1molA与足量的碳酸氢钠溶液反应可以放出3mol二氧化碳。在浓硫酸催化下,A与乙酸可发生酯化反应。核磁共振氢谱表明A分子中有4个氢处于完全相同的化学环境。则A的结构简式是 ;
(3)在浓硫酸催化和适宜的的反应条件下,A与足量的乙醇反应生成B(C12H20O7),B只有两种官能团,其数目比为3∶1。由A生成B的反应类型是 ,该反应的化学方程式是 ;
(4)A失去1分子水后形成化合物C,写出C的两种可能的结构简式及其官能团的名称① ,② 。由百分含量求原子个数比
n(C):n(H):n(O)=0.375/12:0.042/1:0.583/16
由耗氧量:(x+y/4-z/2)=101/22.4
A+3C2H5OH=C12H20O7 +3H2O
得A:C6H8O7
第二轮复习-----专题小型化1:关于pH溶液
2:电化学中的化学方程式、离子方程式
1:关于pH溶液 .自由氢离子与可提供氢离子
例1 :pH=2的盐酸与pH=2的醋酸各100mL
0.01mol/L的盐酸与0.01mol/L的醋酸各100mL
A、与足量的锌粉反应
B、与适量的锌粉反应
(1)初始产生氢气的速率
(2)一段时间内产生氢气的平均速率
(3)产生氢气的体积
例2:等体积混合下列溶液,混合后的溶液pH为
A ≥7 B ≤7 C =7 D 无法判断 HCl NaOH
pH=3 H2SO4 Ba(OH)2 pH=11
HAc NH3.H2O
例3:(全国I 7).室温时,下列混合溶液的pH一定小于7的是
A.pH=3的盐酸和pH=11的氨水等体积混合
B.pH=3的盐酸和pH=11的氢氧化钡溶液等体积混合
C.pH=3的醋酸和pH=11的氢氧化钡溶液等体积混合
D.pH=3的硫酸和pH=11的氨水等体积混合2:电化学中的几个问题(1):电极方程式的写法
原电池的电极反应要注意溶液的酸碱性。
电解池的电极反应不考虑介质。
即: 2H++2e-=H2↑
4OH-—4e-= O2+2H2O
(2)阴极的放电顺序
Ag+>Cu2+>(H+ ) >Pb2+>Fe2+>Zn2+>(H+)>Al3+>Mg2+例1:(04全国-27).电解原理在化学工业中有广泛应用。右图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
(1)若X、Y都有是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则,①电解池中X极上的
电极反应式为 。在X极附近
观察到的现象是 。
②Y电极上的电极反应式为 ,
检验该电极反应产物的方法是 。
(2)(略)27.(1)①2H++2e-=H2↑;放出气体,溶液变红。
②2Cl-+2e-=Cl2↑;把湿润的碘化钾淀粉试纸放在Y电极附近,试纸变蓝色。
(2)①纯铜;Cu2++2e-=Cu ;
②粗铜,Cu -2e-=Cu2+。例2(09江苏14)可用于电动汽车的铝-空气燃料电池,通常以NaCl溶液或NaOH溶液为电解液,铝合金为负极,空气电极为正极。下列说法正确的是
A.以NaCl溶液或NaOH溶液为电解液时,正极反应都为:O2+2H2O+4e-=4OH-
B.以NaOH溶液为电解液时,负极反应为:Al+3OH--3e-=Al(OH)3↓
C.以NaOH溶液为电解液时,电池在工作过程中电解液的pH保持不变
D.电池工作时,电子通过外电路从正极流向负极例3(09天津10)氢氧燃料电池是符合绿色化学理念的新型发电装置。下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:
(1)氢氧燃料电池的能量转化主要形式是 ,在导线中电子流动方向为
(用a、b 表示)。
(2)负极反应式为
H2+2OH--2e- === 2H2O 。
(3)电极表面镀铂粉的
原因为 。(以下略) 例4(08全国Ⅰ卷)电解100mL含 c(H+)=0.30mol/L的下列溶液,当电路中通过0.04mol电子时,理论上析出金属质量最大的是( )
A.0.10mol/LAg + (1.08 g)
B.0.02mol/L Zn2 + (0.130 g)
C.0.20mol/L Cu2+ (1.28 g)
D.0.20mol/L Pb2+ (4.14 g,1.035g) 二、回归课本要看书, 怎么看?何时看? 对老师:
(一)几个版本的变化
试验本,试验修订本,2002年审定本。
(高考提前一个月的微调)
(二)两省一市版与新课标人教版、山东版
对学生
(一)争对具体问题
(二)元素及化合物,实验。P12 并不是所有的氧化还原都能用来造福于人类.
P14 三个灯泡的低暗
P17 碳酸盐固体或溶液 (图1-12)
P19 温度计无刻度
P21 研究性课题
P29能浮在水面上
P29但氧化钠不稳定。过氧化钠比较稳定
P30 演示实验2-4 塑料瓶收集
P30 高压钠灯
P12删去
P14删去 “低”增加”适量”两个字
P17删去“或溶液”
P19增加”刻度”
P21增加锅炉供热效率
研究性学习课题
P29删去 “能浮在水面上”
P29删去“但氧化钠不稳定。过氧化钠比较稳定”
P30改为 铝箔
P30图象全变
高一化学教材(试验修订本与审定本)P36
P37
P44
P55容量瓶无温度
P57演示3-17 配Na2CO3
P58
P76 碘化合物的主要用途
P36增加Na K密度大小的解释
P37增加金属性强弱判断内容
P44 物质的量重点内容加红底(定义)
P56 图3-6 增加温度20度
P56改为 配NaCl
P56增加轻摇的图
P58删去讨论 (稀释前后)
P67增加讨论题Cl2中含有杂质如何除去
P76 改为选 学,增加“调查2000年缺碘情况”
高二化学目录比较旧教材
P2 第六节 石油 煤
P3 实验五 镁铝及化合物的性质
P3 实验六 原电池原理、铁及其化合物的性质
P3 实验七 乙烯的制取和性质(删除)
P4 实验八 溴乙烷的性质(删除)乙醇的性质
P4 实验九 苯酚的性质 乙醛的性质
P4 实验十 乙酸乙酯的制取 肥皂的制取
P4 实验十一 葡萄糖、蔗糖、淀粉、纤维素的性质
P4 实验十二 蛋白质的性质
P4 实验十三 实验习题
P4 选做实验二 金属的电化学腐蚀(放在实验六)
P4 选做实验五 合成有机高分子化合物的性质
P4 附录Ⅰ——Ⅲ顺序(与新教材顺序)新教材
P2 第六节 石油的分馏
P3 实验五 镁、铝、铁及其化合物的性质
P3 实验六 原电池原理 金属的电化学腐蚀
P3 实验七 乙醇、苯酚、乙醛的性质
P4 实验八 乙酸、乙酯的制取 肥皂的制取
P4 实验九 葡萄糖、蔗糖、淀粉、纤维素的性质
P4 实验十 蛋白质的性质
P4 实验十一 实验习题
P4 实验十二 无P4 实验十三 无
P4 选做实验二 几种化学肥料的鉴别(增加)
P4 选做实验五 有机合成高分子化合物的性质(与旧教材说法不同)
P4 选做实验六 相对分子质量的测定(增加)
P4 附录Ⅰ——Ⅲ顺序(与旧教材变动顺序)高二化学教材内容比较旧教材
P12 制氨气讨论(3)中装置中收集氨的试管口放置的棉花应用什么溶液浸湿?作用是什么?(与新教材说法发生改变)
P16 删去阅读材料——玻尔的诺贝尔金质奖章
P17 删去习题四计算题第一题。
P28 复习题选择题第8题删除。
P36 删去选择题第2题。
P39—P40 删除化学平衡常数新教材
P3 增加第四段(氮分子……H2、O2、Cl2等)
P10 增加氨的结构及2个图:1-11,图1-12
P12 制氨气讨论(3)与旧教材说法不同
P13 习题中增加选择题第一题
P13 习题中增加问答题第5、6题
P14 硝酸的氧化性 实验1-7说法与旧教材不同P41 删除选择题第3题
P45 删除阅读化学反应的方向
P56 删除第6题
P59—P60 删除电离平衡常数
P60 删除填空题第3题
P69 删去最后一句例如不纯KNO3
P73 删除1,学习电解质的电离平衡特征
P73 删除2,电离平衡常数
P83 删去1、2、3标题中铝字(与非金属反应)
P88 删去选学硬水及软化
P136 删去苯的磺化反应
P140 删去第六节标题及第二段和—石油的炼制P16 Cu与浓HNO3、稀HNO3装置图与旧教材完全不同
P29 增加 非极性分子和极性分子
P30 增加复习题选择题第8题
P33 第一节 化学反应速率旧教材第一段在新教材中分成两段
P35 第一段倒数第5行与旧教材说法不同(关于分子碰撞分子)
P37 最后一段与旧教材说法不同且删除一些影响因素
P39 增加标题——化学平衡建立
P45 资料勒夏特列简介最后一段说法不同
P56 增加H3PO4 分步电离方程式
P58 最后一段与旧教材说法不同(关于水的离子积)P141 删去1,石油的分馏
P142 图5-24删去裂化部分
P143 石油中的裂化和裂解和煤的综合利用改为选学内容
P146 删去习题1,填空题2,删去选择题1、2、4
P142 删去石油和煤
P149 删去选择题第6题
P151 删去 官能团苯磺酸C6H5SO3H
P160 删去家庭小实验——自制甜酒酿
P166 删去习题第4题
P167 删去苯酚的物理性质和苯酚的化学性质标题(但内容没有删),苯酚与水的互溶温度由700C改为650C
P170 删去习题二第4题
P173 删去习题三第1、2问
P186 删去选学一造纸
P222 删去习题一第16题
P223——P225 删去第18、21、27P66 习题—第2题前面增加在一段情况下
P67习题四第1题与旧教材说法不同
P100 4新型燃料电池中第三段说法不同
P121 习题四化学式改变
P121 乙烯的实验室制法,第一句话说法与旧教材不同
P128 增加助剂含义(在左边小字)
P136 第六节 标题改变
P137 图5-24石油分馏产品及用途示意图改变
P141增加习题问答题
P144 增加习题四第5节苯使高锰酸钾酸性溶液褪色
P148 增加左边小字“卤代烷……”
P173 增加习题七第3题
P184 倒数第十行增加“一部分”
P184 增加自制甜酒酿(旧教材P160移动章节)
P227 增加实验四中和滴定图五、图六、图七(结构、操作、读数)
实验见目录改变 关于电池反应(1)高二课本P88资料
负极(锌筒):Zn-2e-=Zn2+
正极(石墨):2MnO2+2NH4++2e-=Mn2O3+2NH3+H2O
总反应:Zn+2MnO2+2NH4+=Zn2++Mn2O3+2NH3+H2O
(08年版:890mmX1240mm
老版本:890mmX1194mm在P99))选修4----P75负极:Zn+2OH-+2e-=Zn(OH)2
正极:2MnO2+2H2O+2e-=2MnOOH+2OH-一个标准多个版本 -------理解变化的意义例:关于离子键
原课本(新课标山东版):使阴、阳离子结合成化合物的静电作用,叫做离子键。
新课标人教版:带相反电荷的离子之间的相互作用称为离子键。
例:2009年开始的必修I、2010年版的必修II溶解性表中的碳酸铜由“不”改为“-”学生怎么看书?带着问题去看书。
侧重于元素及化合物,实验。
24.(2004年全国卷Ⅲ 27) (3)F(经推断是乙醇)和小粒金属钠反应的化学方程式是 ,
实验现象是 ,反应类型是 。(4)写出F在浓H2SO4作用下在170℃发生反应的化学方程式:
,实验现象是 ,反应类型是 。
(5)写出F与H在加热和浓H2SO4催化作用下发生反应的化学方程式 ,实验现象是 ,反应类型是 。(6)在B、C、D、F、G、I化合物中,互为同系物的是 。 高二化学课本P136…..在这个反应里,金属钠置换出了羟基中的氢,……..
……….因此乙醇可以看做是水分子里的氢原子被乙基取代的产物………20.(2004年全国理综Ⅱ26)粉末状试样A是由等物质的量的MgO和Fe2O3组成的混合物。进行如下实验:
①取适量A进行铝热反应,产物中有单质B生成;
②另取20 g A全部溶于0.15 L 6.0 mol·L—1盐酸中,得溶液C;
③将①中得到的单质B和溶液C反应,放出 l.12 L(标况)气体同时生成溶液D,还残留有固体物质B;
④用KSCN溶液检验时,溶液D不变色。请填空:
(1)①中引发铝热反应的实验操作是_________________________,
产物中的单质B是_______。
(2)②中所发生的各反应的化学方程式是_____________________________________。
(3)③中所发生的各反应的离子方程式是_____________________________________。
(4)若溶液D的体积仍视为0.15 L,则该溶液中c(Mg2+)为______, c(Fe2+)为_______。加少量KClO3,插上Mg条并将其点燃 Fe 。
( 1 ) Na2S2O3与酸的反应
( 2 ) FeSO4与KMnO4的反应
( 3 ) FeCl3与KI的反应
( 4 ) Fe 2+与铁氰化钾的反应
( 5 )镀锌、锡铁的腐蚀
( 6 )乙醇与CuO的反应
( 7 )固体酒精
( 8 )溴乙烷的制取
( 9 )相对分子质量的测定 强化课本重点在元素化合物部分,有机化学部分(包括实验部分):新课标试题的利与弊(一)新颖的试题不一定有利于学生能力的培养
(二)新课标试题07山东理综化学与技术溴单质在四氯化碳中的溶解度比在水中大得多,四氯化碳与水不互溶,故可用于萃取溴,但在上述工艺中却不用四氯化碳,原因是
答案:四氯化碳萃取法工艺复杂、设备投资大;经济效益低、环境污染严重。新课标离真实的化学更接近例:(08江苏9)以下实验或操作不能达到目的的是
A.用溴水鉴别苯、乙醇、四氯化碳
B.准确称取0.4000g的NaOH固体配成1000mL浓度为0.01000 mol·L-1的溶液
C.为除去苯中的少量苯酚,向混合物中加入适量的溴水后过滤
D.用激光笔检验淀粉溶液的丁达尔现象关于一定物质的量浓度溶液的配制1:仪器(天平、量筒、)
2:基准物质
例:准确称取0.4000g的NaOH固体配成1000mL浓度为0.01000 mol·L-1的溶液
例:用98.4%的硫酸溶液(密度为1.84g/cm3)
配制 1000mL浓度为0.1mol·L-1的溶液
四、新课改高考新增考点(一):焓变、熵变和活化能(选修4)
例:(08海南15)反应A(g)+B(g) ?C(g) +D(g)过程中的能量变化如图所示,回答下列问题。
`(1)该反应是放热反应(填“吸热”“放热”); (2)当反应达到平衡时,升高温度,A的转化率减小(填“增大”“减小”“不变”), 原因是该反应正反应为放热反应,升高温度使平衡向逆反应方向移动; (3)反应体系中加入催化剂对反应热是否有影响不影响,原因是催化剂不改变平衡的移动 (4)在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1减小,E2减小(填“增大”“减小、”“不变”)。 (四)、原电池中的盐桥(选修4)例.(07海南14)依据氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池如图所示。
请回答下列问题:
(1)电极X的材料是 ;
电解质溶液是 ;
(2)银电极为电池的 极,
发生的电极反应为 ;
X电极上发生的电极反应为 ;
(3)外电路中的电子是从
电极流向 电极。(五)、溶度积(选修4)例(08山东15)某温度时,BaSO4在水中的沉淀溶解平衡曲线如图(略)所示。下列说法正确的是 提示:BaSO4(s)=Ba2+(aq)+SO42-(aq)的平衡常数Ksp=c(Ba2+)·c(SO42-),称为溶度积常数。 A.加入Na2SO4可以使溶液由a点变到b点 B.通过蒸发可以使溶液由d点变到c点 C.d点无BaSO4沉淀生成 D.a点对应的Ksp大于c点对应的Ksp (六)、化学平衡常数(选修4)例(08宁夏25).已知可逆反应:
请回答下列问题:
(1)在某温度下,反应物的起始浓度分别为:c(M)= 1 mol,·L-1, c(N)=2.4 mol·L-1; 达到平衡后,M的转化率为60%,此时N的转化率为25% ;
(2)若反应温度升高,M的转化率增大(填“增大”“减小”或“不变”;)
(3)若反应温度不变,反应物的起始浓度分别为:c(M)= 4mol·L-1,c(N)=a mol·L-1;达到平衡后,c(P)=2 mol·L-1,a=6 ;
(4)若反应温度不变,反应物的起始浓度为:c(M)= c(N)=b mol·L-1达到平衡后,M的转化率为41% 。
今年有:江苏-14、20,浙江-27
(七):电离、水解平衡常数(选修4)例:(09福建10). 在一定条件下,Na2CO3溶液存在水解平衡: 。
下列说法正确的是
A. 稀释溶液,水解平衡常数增大
B. 通入CO2,平衡朝正反应方向移动
C. 升高温度, 减小
D. 加入NaOH固体,溶液PH减小(八)杂化轨道、电负性、 键和 键(选修3)(09山东32).C和Si元素在化学中占有极其重要的地位。
(1)写出Si的基态原子核外电子排布式1s22s22p63s23p2 。
从电负性角度分析,C、Si和O元素的非金属活泼性由强至弱的顺序为
O>C>Si 。
(2)SiC的晶体结构与晶体硅的相似,其中C原子的杂化方式为sp3 ,微粒间存在的作用力是共价键 。
(3)氧化物MO的电子总数与SiC的相等,则M为Mg (填元素符号)。MO是优良的耐高温材料,其晶体结构与NaCl晶体相似。MO的熔点比CaO的高,其原因是Mg2+半径比Ca2+小,MgO晶格能大 。
(4)C、Si为同一主族的元素,CO2和SiO2化学式相似,但结构和性质有很大不同。CO2中C与O原子间形成键和键,SiO2中Si与O原子间不形成上述健。从原子半径大小的角度分析,为何C、O原子间能形成,而Si、O原子间不能形成上述键:Si的原子半径较大,Si、O原子间距离较大,p-p轨道肩并肩重叠程度较小,不能形成上述稳定的π键
。习题的流行与变迁 任何事物发挥到极致意味着灭亡
例:关于氧化还原反应方程式的配平
例:pH的有关计算
舆论的影响
例:关于硫化氢
例: 关于稀有气体的原子半径
(删除有争议的习题)
与各位老师共同探讨
不足之处敬请指正
电子信箱chemistry8281@sina.com
手机:13707918281
二、回归课本,怎么看?何时看?
三、新课标习题的利与弊
四、新课标超出原人教版教材题例一、化学试题中的基本理论 历年江西理综基本理论试题
09理综化学基本理论部分
09年化学基本理论题
物质结构试题答案特点及字数
基本理论试题中的计算
第二轮复习----专题小型化历年江西理综基本理论试题09理综化学基本理论部分09理综化学基本理论部分09年化学基本理论题物质结构试题答案特点化学式(分子式、电子式、结构式、原子结构示意图)
化学方程式或离子方程式
空间构型、晶体类型
稳定性、熔沸点排序
09年物质结构题有51个中文字和16个分子式(化学式)
09年电化学约100个字,13个化学式和数据。
08年物质结构题只有8个化学式
07年物质结构题只有9个化学式
11、(09)已知周期表中,元素Q、R、W、Y与元素X相邻。Y的最高化合价氧化物的水化物是强酸。回答下列问题: (1)W与Q可以形成一种高温结构陶瓷材料。W的氯化物分子呈正四面体结构,W的氧化物的晶体类型是原子晶体; (2)Q的具有相同化合价且可以相互转变的氧化物是?NO2和N2O4 ; (3)R和Y形成的二元化合物中,R呈现最高化合价的化合物的化学式是?As2S5 ;?????? (4)这5个元素的氢化物分子中,①立体结构类型相同的氢化物的沸点从高到低排列次序是(填化学式)?NH3> AsH3 > PH3,其原因是?因为前者中含有氢键,后两者构型相同,分子间作用力不同; ②电子总数相同的氢化物的化学式和立体结构分别是??②电子数相同的有SiH4、PH3和H2S结构分别为正四面体,三角锥和V形. (5)W和Q所形成的结构陶瓷材料的一种合成方法如下:W的氯化物与Q的氢化物加热反应,生成化合物W(QH2)4和HCl气体;W(QH2)4在高温下分解生成Q的氢化物和该陶瓷材料。上述相关反应的化学方程式(各物质用化学式表示)是SiCl4 + 4NH3 = Si(NH2)4 + 4HCl,3Si(NH2)4 = 8NH3 + Si3N4 。 (09)下图(图略)所示装置中,甲、乙、丙三个烧杯依次分别盛放100g5.00%的NaOH溶液、足量的CuSO4溶液和l00g10.00%的K2SO4溶液.电极均为石墨电极。
(1)接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加。据此回答问题: ①电源的N端为正 极; ②电极b上发生的电极反应为???4OH-?-4e-= 2H2O + O2↑ ; ③列式计算电极b上生成的气体在标准状况下的体积:2.8? L ??; ④电极c的质量变化是???16 g ???⑤电解前后各溶液的酸、碱性大小是否发生变化,简述其原因: 甲溶液??碱性增大,因为电解后,水量减少溶液是NaOH浓度增大 ; 乙溶液??酸性增大,因为阳极上OH-生成O2,溶液中H+离子浓度增加 ???; 丙溶液??酸碱性大小没有变化,因为K2SO4是强酸强碱盐,浓度增加不影响溶液的酸碱性 ??;
(2)如果电解过程中铜全部析出.此时电解能否继续进行,为什么? ????能继续进行,因为CuSO4溶液已转变为H2SO4溶液,反应也就变为水的电解反应。(08)V、W、X、Y、Z是由周期表中1~20号部分元素组成的5倍化合物,其中V、W、X、Z均为两种元素组成,上述5种化合物涉及的所有元素的原子序数之和等于35。它们之间的反应关系如下图:
(1)5种化合物分别是V CaC2 、WCaO 、XCO2 、Y Ca(OH)2 、Z C2H2 :(填化学式)
(2)由上述5种化合物中2种化合物反应可生成一种新化合物,它包含了5种化合物中的所有元素,生成该化合物的化学方程式是 Ca(OH)2+2CO2= Ca(HCO3)2:
(3)V的电子式是 。(07) W、X、Y和Z都是周期表中前20号元素,已知:
①W的阳离子Y的阴离子具有相同的核外电子排布,且能形成组成为WY的化合物;
②Y和Z属同族元素,它们能形成两种常见化合物;
③X和Z属同一周期元素。它们能形成两种气态化合物
④W和X能形成组成为WX2的化合物;
⑤X和Y不在同一周期,它们能形成组成为XY2的化合物。
请回答:
(1)W元素是Ca;Z元素是O。
(2)化合物WY和WX2的化学式分别是CaS和CaC2。
(3)Y和Z形成的两种常见化合物的分子式是SO2 和SO3。
(4)写出X和Z形成的一种气态化合物跟WZ反应的化学方程式:CO2+CaO=CaCO3
基本理论试题中的计算例1(08)实验室可由软锰矿(主要成分为MnO2)制备KMnO4,方法如下:软锰矿与过量固体KOH和KClO3在高温下反应,生成锰酸钾(K2MnO4)和KCl:用水溶解,滤去残渣,滤液酸化后,K2MnO4。请回答:
(3)若用2.5g软锰矿(含MnO280%)进行上述实验,计算KMnO4的理论产量;
(5)上述制得的KMnO4产品0.165g,恰好与0.335gNa2C2O4反应完全,计算该KMnO4的纯度。(3)3MnO2——————2KMnO4
3×87 2×158
2.5g×80% m(KMnO4)
m(KMnO4)= 2×158×2.5g×80% /(3×87) =2.4g。
(5)2KMnO4———— 5Na2C2O4
2×158 5×134
m(KMnO4) 0.335g
m(KMnO4)= 2×158×0.335g/(5×134)=0.158g
KMnO4纯度=(0.158g/0.165g)×100%=95.8%.例2(08宁夏)已知化合物A中各元素的质量分数分别为C 37.5%,H 4.2%和O 58.3%。请填空
(1)0.01molA在空气中充分燃烧需消耗氧气1.01L(标准状况),则A的分子式是 ;
(2)实验表明:A不能发生银镜反应。1molA与足量的碳酸氢钠溶液反应可以放出3mol二氧化碳。在浓硫酸催化下,A与乙酸可发生酯化反应。核磁共振氢谱表明A分子中有4个氢处于完全相同的化学环境。则A的结构简式是 ;
(3)在浓硫酸催化和适宜的的反应条件下,A与足量的乙醇反应生成B(C12H20O7),B只有两种官能团,其数目比为3∶1。由A生成B的反应类型是 ,该反应的化学方程式是 ;
(4)A失去1分子水后形成化合物C,写出C的两种可能的结构简式及其官能团的名称① ,② 。由百分含量求原子个数比
n(C):n(H):n(O)=0.375/12:0.042/1:0.583/16
由耗氧量:(x+y/4-z/2)=101/22.4
A+3C2H5OH=C12H20O7 +3H2O
得A:C6H8O7
第二轮复习-----专题小型化1:关于pH溶液
2:电化学中的化学方程式、离子方程式
1:关于pH溶液 .自由氢离子与可提供氢离子
例1 :pH=2的盐酸与pH=2的醋酸各100mL
0.01mol/L的盐酸与0.01mol/L的醋酸各100mL
A、与足量的锌粉反应
B、与适量的锌粉反应
(1)初始产生氢气的速率
(2)一段时间内产生氢气的平均速率
(3)产生氢气的体积
例2:等体积混合下列溶液,混合后的溶液pH为
A ≥7 B ≤7 C =7 D 无法判断 HCl NaOH
pH=3 H2SO4 Ba(OH)2 pH=11
HAc NH3.H2O
例3:(全国I 7).室温时,下列混合溶液的pH一定小于7的是
A.pH=3的盐酸和pH=11的氨水等体积混合
B.pH=3的盐酸和pH=11的氢氧化钡溶液等体积混合
C.pH=3的醋酸和pH=11的氢氧化钡溶液等体积混合
D.pH=3的硫酸和pH=11的氨水等体积混合2:电化学中的几个问题(1):电极方程式的写法
原电池的电极反应要注意溶液的酸碱性。
电解池的电极反应不考虑介质。
即: 2H++2e-=H2↑
4OH-—4e-= O2+2H2O
(2)阴极的放电顺序
Ag+>Cu2+>(H+ ) >Pb2+>Fe2+>Zn2+>(H+)>Al3+>Mg2+例1:(04全国-27).电解原理在化学工业中有广泛应用。右图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
(1)若X、Y都有是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则,①电解池中X极上的
电极反应式为 。在X极附近
观察到的现象是 。
②Y电极上的电极反应式为 ,
检验该电极反应产物的方法是 。
(2)(略)27.(1)①2H++2e-=H2↑;放出气体,溶液变红。
②2Cl-+2e-=Cl2↑;把湿润的碘化钾淀粉试纸放在Y电极附近,试纸变蓝色。
(2)①纯铜;Cu2++2e-=Cu ;
②粗铜,Cu -2e-=Cu2+。例2(09江苏14)可用于电动汽车的铝-空气燃料电池,通常以NaCl溶液或NaOH溶液为电解液,铝合金为负极,空气电极为正极。下列说法正确的是
A.以NaCl溶液或NaOH溶液为电解液时,正极反应都为:O2+2H2O+4e-=4OH-
B.以NaOH溶液为电解液时,负极反应为:Al+3OH--3e-=Al(OH)3↓
C.以NaOH溶液为电解液时,电池在工作过程中电解液的pH保持不变
D.电池工作时,电子通过外电路从正极流向负极例3(09天津10)氢氧燃料电池是符合绿色化学理念的新型发电装置。下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:
(1)氢氧燃料电池的能量转化主要形式是 ,在导线中电子流动方向为
(用a、b 表示)。
(2)负极反应式为
H2+2OH--2e- === 2H2O 。
(3)电极表面镀铂粉的
原因为 。(以下略) 例4(08全国Ⅰ卷)电解100mL含 c(H+)=0.30mol/L的下列溶液,当电路中通过0.04mol电子时,理论上析出金属质量最大的是( )
A.0.10mol/LAg + (1.08 g)
B.0.02mol/L Zn2 + (0.130 g)
C.0.20mol/L Cu2+ (1.28 g)
D.0.20mol/L Pb2+ (4.14 g,1.035g) 二、回归课本要看书, 怎么看?何时看? 对老师:
(一)几个版本的变化
试验本,试验修订本,2002年审定本。
(高考提前一个月的微调)
(二)两省一市版与新课标人教版、山东版
对学生
(一)争对具体问题
(二)元素及化合物,实验。P12 并不是所有的氧化还原都能用来造福于人类.
P14 三个灯泡的低暗
P17 碳酸盐固体或溶液 (图1-12)
P19 温度计无刻度
P21 研究性课题
P29能浮在水面上
P29但氧化钠不稳定。过氧化钠比较稳定
P30 演示实验2-4 塑料瓶收集
P30 高压钠灯
P12删去
P14删去 “低”增加”适量”两个字
P17删去“或溶液”
P19增加”刻度”
P21增加锅炉供热效率
研究性学习课题
P29删去 “能浮在水面上”
P29删去“但氧化钠不稳定。过氧化钠比较稳定”
P30改为 铝箔
P30图象全变
高一化学教材(试验修订本与审定本)P36
P37
P44
P55容量瓶无温度
P57演示3-17 配Na2CO3
P58
P76 碘化合物的主要用途
P36增加Na K密度大小的解释
P37增加金属性强弱判断内容
P44 物质的量重点内容加红底(定义)
P56 图3-6 增加温度20度
P56改为 配NaCl
P56增加轻摇的图
P58删去讨论 (稀释前后)
P67增加讨论题Cl2中含有杂质如何除去
P76 改为选 学,增加“调查2000年缺碘情况”
高二化学目录比较旧教材
P2 第六节 石油 煤
P3 实验五 镁铝及化合物的性质
P3 实验六 原电池原理、铁及其化合物的性质
P3 实验七 乙烯的制取和性质(删除)
P4 实验八 溴乙烷的性质(删除)乙醇的性质
P4 实验九 苯酚的性质 乙醛的性质
P4 实验十 乙酸乙酯的制取 肥皂的制取
P4 实验十一 葡萄糖、蔗糖、淀粉、纤维素的性质
P4 实验十二 蛋白质的性质
P4 实验十三 实验习题
P4 选做实验二 金属的电化学腐蚀(放在实验六)
P4 选做实验五 合成有机高分子化合物的性质
P4 附录Ⅰ——Ⅲ顺序(与新教材顺序)新教材
P2 第六节 石油的分馏
P3 实验五 镁、铝、铁及其化合物的性质
P3 实验六 原电池原理 金属的电化学腐蚀
P3 实验七 乙醇、苯酚、乙醛的性质
P4 实验八 乙酸、乙酯的制取 肥皂的制取
P4 实验九 葡萄糖、蔗糖、淀粉、纤维素的性质
P4 实验十 蛋白质的性质
P4 实验十一 实验习题
P4 实验十二 无P4 实验十三 无
P4 选做实验二 几种化学肥料的鉴别(增加)
P4 选做实验五 有机合成高分子化合物的性质(与旧教材说法不同)
P4 选做实验六 相对分子质量的测定(增加)
P4 附录Ⅰ——Ⅲ顺序(与旧教材变动顺序)高二化学教材内容比较旧教材
P12 制氨气讨论(3)中装置中收集氨的试管口放置的棉花应用什么溶液浸湿?作用是什么?(与新教材说法发生改变)
P16 删去阅读材料——玻尔的诺贝尔金质奖章
P17 删去习题四计算题第一题。
P28 复习题选择题第8题删除。
P36 删去选择题第2题。
P39—P40 删除化学平衡常数新教材
P3 增加第四段(氮分子……H2、O2、Cl2等)
P10 增加氨的结构及2个图:1-11,图1-12
P12 制氨气讨论(3)与旧教材说法不同
P13 习题中增加选择题第一题
P13 习题中增加问答题第5、6题
P14 硝酸的氧化性 实验1-7说法与旧教材不同P41 删除选择题第3题
P45 删除阅读化学反应的方向
P56 删除第6题
P59—P60 删除电离平衡常数
P60 删除填空题第3题
P69 删去最后一句例如不纯KNO3
P73 删除1,学习电解质的电离平衡特征
P73 删除2,电离平衡常数
P83 删去1、2、3标题中铝字(与非金属反应)
P88 删去选学硬水及软化
P136 删去苯的磺化反应
P140 删去第六节标题及第二段和—石油的炼制P16 Cu与浓HNO3、稀HNO3装置图与旧教材完全不同
P29 增加 非极性分子和极性分子
P30 增加复习题选择题第8题
P33 第一节 化学反应速率旧教材第一段在新教材中分成两段
P35 第一段倒数第5行与旧教材说法不同(关于分子碰撞分子)
P37 最后一段与旧教材说法不同且删除一些影响因素
P39 增加标题——化学平衡建立
P45 资料勒夏特列简介最后一段说法不同
P56 增加H3PO4 分步电离方程式
P58 最后一段与旧教材说法不同(关于水的离子积)P141 删去1,石油的分馏
P142 图5-24删去裂化部分
P143 石油中的裂化和裂解和煤的综合利用改为选学内容
P146 删去习题1,填空题2,删去选择题1、2、4
P142 删去石油和煤
P149 删去选择题第6题
P151 删去 官能团苯磺酸C6H5SO3H
P160 删去家庭小实验——自制甜酒酿
P166 删去习题第4题
P167 删去苯酚的物理性质和苯酚的化学性质标题(但内容没有删),苯酚与水的互溶温度由700C改为650C
P170 删去习题二第4题
P173 删去习题三第1、2问
P186 删去选学一造纸
P222 删去习题一第16题
P223——P225 删去第18、21、27P66 习题—第2题前面增加在一段情况下
P67习题四第1题与旧教材说法不同
P100 4新型燃料电池中第三段说法不同
P121 习题四化学式改变
P121 乙烯的实验室制法,第一句话说法与旧教材不同
P128 增加助剂含义(在左边小字)
P136 第六节 标题改变
P137 图5-24石油分馏产品及用途示意图改变
P141增加习题问答题
P144 增加习题四第5节苯使高锰酸钾酸性溶液褪色
P148 增加左边小字“卤代烷……”
P173 增加习题七第3题
P184 倒数第十行增加“一部分”
P184 增加自制甜酒酿(旧教材P160移动章节)
P227 增加实验四中和滴定图五、图六、图七(结构、操作、读数)
实验见目录改变 关于电池反应(1)高二课本P88资料
负极(锌筒):Zn-2e-=Zn2+
正极(石墨):2MnO2+2NH4++2e-=Mn2O3+2NH3+H2O
总反应:Zn+2MnO2+2NH4+=Zn2++Mn2O3+2NH3+H2O
(08年版:890mmX1240mm
老版本:890mmX1194mm在P99))选修4----P75负极:Zn+2OH-+2e-=Zn(OH)2
正极:2MnO2+2H2O+2e-=2MnOOH+2OH-一个标准多个版本 -------理解变化的意义例:关于离子键
原课本(新课标山东版):使阴、阳离子结合成化合物的静电作用,叫做离子键。
新课标人教版:带相反电荷的离子之间的相互作用称为离子键。
例:2009年开始的必修I、2010年版的必修II溶解性表中的碳酸铜由“不”改为“-”学生怎么看书?带着问题去看书。
侧重于元素及化合物,实验。
24.(2004年全国卷Ⅲ 27) (3)F(经推断是乙醇)和小粒金属钠反应的化学方程式是 ,
实验现象是 ,反应类型是 。(4)写出F在浓H2SO4作用下在170℃发生反应的化学方程式:
,实验现象是 ,反应类型是 。
(5)写出F与H在加热和浓H2SO4催化作用下发生反应的化学方程式 ,实验现象是 ,反应类型是 。(6)在B、C、D、F、G、I化合物中,互为同系物的是 。 高二化学课本P136…..在这个反应里,金属钠置换出了羟基中的氢,……..
……….因此乙醇可以看做是水分子里的氢原子被乙基取代的产物………20.(2004年全国理综Ⅱ26)粉末状试样A是由等物质的量的MgO和Fe2O3组成的混合物。进行如下实验:
①取适量A进行铝热反应,产物中有单质B生成;
②另取20 g A全部溶于0.15 L 6.0 mol·L—1盐酸中,得溶液C;
③将①中得到的单质B和溶液C反应,放出 l.12 L(标况)气体同时生成溶液D,还残留有固体物质B;
④用KSCN溶液检验时,溶液D不变色。请填空:
(1)①中引发铝热反应的实验操作是_________________________,
产物中的单质B是_______。
(2)②中所发生的各反应的化学方程式是_____________________________________。
(3)③中所发生的各反应的离子方程式是_____________________________________。
(4)若溶液D的体积仍视为0.15 L,则该溶液中c(Mg2+)为______, c(Fe2+)为_______。加少量KClO3,插上Mg条并将其点燃 Fe 。
( 1 ) Na2S2O3与酸的反应
( 2 ) FeSO4与KMnO4的反应
( 3 ) FeCl3与KI的反应
( 4 ) Fe 2+与铁氰化钾的反应
( 5 )镀锌、锡铁的腐蚀
( 6 )乙醇与CuO的反应
( 7 )固体酒精
( 8 )溴乙烷的制取
( 9 )相对分子质量的测定 强化课本重点在元素化合物部分,有机化学部分(包括实验部分):新课标试题的利与弊(一)新颖的试题不一定有利于学生能力的培养
(二)新课标试题07山东理综化学与技术溴单质在四氯化碳中的溶解度比在水中大得多,四氯化碳与水不互溶,故可用于萃取溴,但在上述工艺中却不用四氯化碳,原因是
答案:四氯化碳萃取法工艺复杂、设备投资大;经济效益低、环境污染严重。新课标离真实的化学更接近例:(08江苏9)以下实验或操作不能达到目的的是
A.用溴水鉴别苯、乙醇、四氯化碳
B.准确称取0.4000g的NaOH固体配成1000mL浓度为0.01000 mol·L-1的溶液
C.为除去苯中的少量苯酚,向混合物中加入适量的溴水后过滤
D.用激光笔检验淀粉溶液的丁达尔现象关于一定物质的量浓度溶液的配制1:仪器(天平、量筒、)
2:基准物质
例:准确称取0.4000g的NaOH固体配成1000mL浓度为0.01000 mol·L-1的溶液
例:用98.4%的硫酸溶液(密度为1.84g/cm3)
配制 1000mL浓度为0.1mol·L-1的溶液
四、新课改高考新增考点(一):焓变、熵变和活化能(选修4)
例:(08海南15)反应A(g)+B(g) ?C(g) +D(g)过程中的能量变化如图所示,回答下列问题。
`(1)该反应是放热反应(填“吸热”“放热”); (2)当反应达到平衡时,升高温度,A的转化率减小(填“增大”“减小”“不变”), 原因是该反应正反应为放热反应,升高温度使平衡向逆反应方向移动; (3)反应体系中加入催化剂对反应热是否有影响不影响,原因是催化剂不改变平衡的移动 (4)在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1减小,E2减小(填“增大”“减小、”“不变”)。 (四)、原电池中的盐桥(选修4)例.(07海南14)依据氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池如图所示。
请回答下列问题:
(1)电极X的材料是 ;
电解质溶液是 ;
(2)银电极为电池的 极,
发生的电极反应为 ;
X电极上发生的电极反应为 ;
(3)外电路中的电子是从
电极流向 电极。(五)、溶度积(选修4)例(08山东15)某温度时,BaSO4在水中的沉淀溶解平衡曲线如图(略)所示。下列说法正确的是 提示:BaSO4(s)=Ba2+(aq)+SO42-(aq)的平衡常数Ksp=c(Ba2+)·c(SO42-),称为溶度积常数。 A.加入Na2SO4可以使溶液由a点变到b点 B.通过蒸发可以使溶液由d点变到c点 C.d点无BaSO4沉淀生成 D.a点对应的Ksp大于c点对应的Ksp (六)、化学平衡常数(选修4)例(08宁夏25).已知可逆反应:
请回答下列问题:
(1)在某温度下,反应物的起始浓度分别为:c(M)= 1 mol,·L-1, c(N)=2.4 mol·L-1; 达到平衡后,M的转化率为60%,此时N的转化率为25% ;
(2)若反应温度升高,M的转化率增大(填“增大”“减小”或“不变”;)
(3)若反应温度不变,反应物的起始浓度分别为:c(M)= 4mol·L-1,c(N)=a mol·L-1;达到平衡后,c(P)=2 mol·L-1,a=6 ;
(4)若反应温度不变,反应物的起始浓度为:c(M)= c(N)=b mol·L-1达到平衡后,M的转化率为41% 。
今年有:江苏-14、20,浙江-27
(七):电离、水解平衡常数(选修4)例:(09福建10). 在一定条件下,Na2CO3溶液存在水解平衡: 。
下列说法正确的是
A. 稀释溶液,水解平衡常数增大
B. 通入CO2,平衡朝正反应方向移动
C. 升高温度, 减小
D. 加入NaOH固体,溶液PH减小(八)杂化轨道、电负性、 键和 键(选修3)(09山东32).C和Si元素在化学中占有极其重要的地位。
(1)写出Si的基态原子核外电子排布式1s22s22p63s23p2 。
从电负性角度分析,C、Si和O元素的非金属活泼性由强至弱的顺序为
O>C>Si 。
(2)SiC的晶体结构与晶体硅的相似,其中C原子的杂化方式为sp3 ,微粒间存在的作用力是共价键 。
(3)氧化物MO的电子总数与SiC的相等,则M为Mg (填元素符号)。MO是优良的耐高温材料,其晶体结构与NaCl晶体相似。MO的熔点比CaO的高,其原因是Mg2+半径比Ca2+小,MgO晶格能大 。
(4)C、Si为同一主族的元素,CO2和SiO2化学式相似,但结构和性质有很大不同。CO2中C与O原子间形成键和键,SiO2中Si与O原子间不形成上述健。从原子半径大小的角度分析,为何C、O原子间能形成,而Si、O原子间不能形成上述键:Si的原子半径较大,Si、O原子间距离较大,p-p轨道肩并肩重叠程度较小,不能形成上述稳定的π键
。习题的流行与变迁 任何事物发挥到极致意味着灭亡
例:关于氧化还原反应方程式的配平
例:pH的有关计算
舆论的影响
例:关于硫化氢
例: 关于稀有气体的原子半径
(删除有争议的习题)
与各位老师共同探讨
不足之处敬请指正
电子信箱chemistry8281@sina.com
手机:13707918281
同课章节目录
